Virus di Epstein-Barr
C. Mengoli, 2008
Tassonomia
► Il
virus di Epstein-Barr, EBV, è un membro
delle Herpesviridae.
► Appartiene alla sottofamiglia
Gammaherpesvirinae, genere
Lymphocryptovirus.
► L'infezione è comune, diffusa
ubiquitariamente e, in età infantile,
solitamente subclinica.
Infezione acuta e oncogenicità
► La
mononucleosi infettiva (M.I.) con
anticorpi eterofili è la manifestazione
morbosa più comune (interessa soprattutto
l’adolescente, il giovane adulto).
► La MI comprende la triade clinica costituita
da febbre, linfoadenopatia, angina.
► Inoltre EBV provoca il linfoma di Burkitt
africano e il carcinoma nasofaringeo.
Flash storico
► Descrizione
di Filatov e Pfeiffer alla fine del
19° secolo della "febbre ghiandolare"
(Drusenfieber)
► Descrizione di sei casi clinici di M.I. in
giovani adulti (Sprunt e Evans, 1921)
► Downey, 1923: descrizione dettagliata dei
linfociti atipici nella M.I.
Anticorpi eterofili, linfoma e virus
► Paul-Bunnell
(1932);
Davidsohn
(1937):
descrizione di agglutinine attive su emazie di
pecora previo assorbimento dell'anticorpo eterofilo
su cellule renali di cavia o eritrociti di bue.
► Descrizione di un linfoma insolito con predilezione
di capo e collo (Burkitt, 1958)
► Epstein, Barr, Achong (1964): descrizione di
particelle virali simili-erpetiche in colture di cellule
di linfoma di Burkitt.
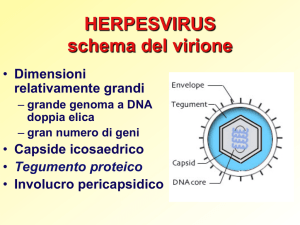
Aspetti virologici
icosaedrica, = 180-200 mm,
involucro complesso. Nucleocapside = 100 nm,
162 capsomeri allineati regolarmente con il
“modulo erpetico" 5:3:2.
► Virione
costituito da numerosi polipeptidi
distinguibili all'analisi SDS-PAGE.
► Genoma a DNA, lineare, doppio filamento, 172
kbp, 101 3 megadaltons.
► In vivo cresce produttivamente nelle cellule
epiteliali orafaringee e nei linfociti B; ambedue i
tipi di cellula hanno recettori di superficie per EBV
(CD21, recettore per C3d).
► Simmetria
Linfoma e Mononucleosi
Werner e Gertrude Henle (1966, 1968):
► sviluppano un procedimento di IF indiretta
per ricercare anticorpi anti-EBV
► dimostrano alti titoli anticorpali nel siero di
pazienti con linfoma di Burkitt e con M.I.
Linfotropismo
virus cresce in vitro solo nei linfociti B umani e di
certi primati ; generalmente non produce effetto
citopatico.
► A seguito dell'infezione, cellule che contengono il
genoma virale si trasformano o immortalizzano.
► Le cellule trasformate sono positive alla ricerca
degli antigeni virali in sede nucleare e alla ricerca
del genoma virale mediante ibridazione DNA-DNA.
► Il
Eventi precoci
linfociti B (e certi linfociti null con recettori per il
complemento) sono dotati di recettore per EBV.
► Nel nucleo della cellula infetta compare EBNA
prima che inizi la sintesi di proteine virali.
► Nelle cellule trasformate alcune copie del genoma
virale possono integrarsi nel DNA cellulare, benchè
la maggior parte rimanga in forma libera, circolare,
non integrata (episomiale).
►I
Integrazione
► L'integrazione
viene stimolata da mitogeni
B-specifici (LPS).
► La cellula ospite si immortalizza sia che il
virus si integrato, sia che sia episomiale, sia
che si trovi in ambedue le forme.
Linee linfoblastoidi
► Normalmente
meno del 10% delle cellule B
esposte al virus forma linee continue; la cellula
trasformata contiene numerose genocopie virali ;
produce e/o secerne Ig.
► Le linee cellulari che contengono genoma di EBV
si distinguono in produttrici e non produttici. Le
prime contengono VCA (antigene virale capsidico)
nel citoplasma, liberano virioni maturi, esprimono
EA (early antigens) in presenza di 5'-bromodeossiuridina (BUdR) o 5 -iodo, 2-deossiuridina
(IUdR).
Latenza
► Per
la maggior parte del tempo EBV rimane
latente sia in vivo (nel linfociti circolanti) sia
in vitro (in linee cellulari trasformate).
► La trasmissione parenterale è rara ma
riveste importanza nel paziente trapiantato.
Epidemiologia
► Negli
USA e nel Regno Unito prima dei 5 anni il
50% della popolazione è sieroconvertita.
► Nell'età adulta il 90-95% della popolazione è in
possesso di anticorpi.
► Nei pesi tropicali e nei gruppo socio-economici
inferiori gli anticorpi compaiono prima.
► Una seconda “ondata” di sieroconversioni si ha nel
secondo decennio di vita.
Prima infezione
► La
malattia clinicamente manifesta compare più
frequentemente negli adolescenti e nelle
popolazioni dove l'infezione primaria ha luogo
tardivamente (fra i 15 e 24 anni).
► L'incidenza è uguale in uomini e donne (2 anni
prima in media nella donna, all’età di 14-16 anni).
► Gli adolescenti e gli adulti con infezione primaria
sviluppano una M.I. nel 25-70% dei casi.
Viral shedding
► Cariche
virionali
modeste
sono
documentabili nella faringe dei malati con
M.I. (50-100% dei casi).
► EBV viene emesso dall'orofaringe per lunghi
periodi (fino a 18 mesi) dopo la prima
infezione.
► Il virus può essere isolato dal tampone
faringeo o gargarizzato di 12-25% dei
sieropositivi sani
Immunosoppressi
Gli immunosoppressi emettono il virus con
frequenza maggiore:
pazienti con tumori solidi (27%)
pazienti con HIV-1 (50%)
trapiantati renali (56-70%)
pazienti critici affetti da leucemie o linfomi (7492%).
Circolazione
► Il
virus è labile nell'ambiente esterno.
► Trattasi di un agente molto diffuso a bassa
contagiosità che richiede contatto intimo tra virus
shedder asintomatico e individuo suscettibile.
► Le epidemie non esistono.
► I malati con M.I. riportano contatti con altri
pazienti affetti dalla stessa malattia solo nel 6%
dei casi.
► La morbilità più alta si osserva nei collegi
universitari e fra i militari.
Clinica
►
►
►
►
►
Faringite, febbre, linfadenopatia.
Febbre nel 90% dei casi.
Malessere e cefalea sono frequenti.
La faringotonsillite con impegno bilaterale delle tonsille,
iperemia (con o senza essudato); frequenti le petecchie al
palato.
Eruzione esantematica nel 5% (90-100% se il malato
prende ampicillina)
Il rash può essere maculopapuloso, petecchiale, scarlattinoso,
orticarioide o simile a eritema multiforme
►
►
►
Adenopatia comune (80-90% dei casi), solitamente
generalizzata, più evidente nel distretto retrocervicale.
Splenomegalia nel 50% dei casi.
Lieve epatite con epatomegalia (10-15% dei casi),
elevazione transaminasemica (80-90%), ittero (5%).
Complicanze
► Rare
localizzazioni d’organo risultano
rappresentate da
sindromi neurologiche,
pericardite,
miocardite,
orchite.
Quadro ematologico della MI
► Più
del 50% dei leucociti sono cellule
mononucleate, più del 10% dei linfociti sono atipici
cellule di Downey
► Trattasi
di linfociti CD8+, soppressori/citotossici,
attivati
► Il citoplasma ampio, basofilo, vacuolizzato, con
margini talvolta “arrotolati”; il nucleo è ovale,
reniforme, lobulato, con cromatina irregolare;
talora sono riconoscibili nucleoli
► Nel complesso, il quadro ematologico periferico
appare polimorfo
► Il midollo osseo è normale
Morte
► Può
conseguire a malattia grave (rara), con
polmonite, febbre, pancitopenia, proliferazione
virale esuberante in individui apparentemente sani
in precedenza
► La morte può anche essere causata da
complicanze neurologiche, rottura di milza,
complicanze ematologiche (trombocitopenia,
granulocitopenia), insufficienza epatica (rarissima),
miocardite, ostruzione delle vie aeree
Sindrome di Duncan
► EBV
può svelare una immunodeficienza selettiva
familiare legata al cromosoma X, la sindrome di
Duncan.
► I maschi affetti possono morire in corso di
infezione primaria (nel 40% dei casi), oppure,
diversi anni anni dopo l’episodio di M.I., possono
presentare:
agammaflobulimenia
linfoma linfocitico
anemia aplastica
Complicanze ematologiche
► Anemia
emolitica autoimmune da
agglutinine fredde (solitamente anti-i).
► Trombocitopenia; raramente grave; possibile
genesi autoimmune.
Reticoloendotelite
► V’è
una reticoloendotelite diffusa.
► I linfonodi sono ingrossati, con un aumento del
numero dei follicoli che appaiono ingranditi.
► I centri germinativi sono ingrossati; contengono
blasti, istiociti e linfociti.
► La milza é aumentata di volume (di 2 o 3 volte)
con edema capsulare e trabecolare. V’è iperplasia
della polpa rossa, nella quale sono evidenti cellule
blastiche pleiomorfiche; la polpa bianca è
relativamente normale; sono frequenti emorragie
focali, soprattutto subcapsulari.
Fegato e SNC
► Nel
fegato sono riconoscibili alterazioni
modeste con infiltrati linfo-monocitario negli
spazi portali.
► Per quanto riguarda il sistema nervoso
centrale, nei casi fatali sono stati notati
segni di degenerazione neuronale, manicotti
perivasali,
emorragie
perivascolari,
iperplasia
astrocitaria;
l'infiltrazione
mononucleare è scarsa.
Patogenesi della MI
► La
via di penetrazione del virus è l'orofaringe.
► Le cellule dell'epitelio sono dotate di recettori per
EBV (gli stessi che legano C3d).
► Studi di citoibridazione hanno dimostrato EBV DNA
entro le cellule epiteliali orofaringee.
► Il virus infetta anche le cellule B linfocitarie
orofaringee.
► Nel corso dei 30-50 gg di incubazione il virus si
dissemina nel tessuto linforeticolare,
sistemicamente.
Risposta immune
► La
risposta immune contro i B-linfociti
trasformati è umorale e cellulare.
► Fra gli anticorpi vi sono
quelli diretti contro il virus, anti-EBV
anticorpi eterofili.
Anticorpi virus-specifici
La tecnica è quella dell’immunofluorescenza indiretta
(nel caso di EBNA, immunofluorescenza indiretta
anti-complemento). Possono essere ricercati
anticorpi contro quattro principali sistemi antigene:
VCA
EA/D (early antigen - diffuse component)
EA/R (early antigen - restricted component)
EBNA
anti-VCA
IgM anti-VCA: persistono 4-8 sett., sensibili
(100%) e specifici; precoci
IgG anti-VCA: persistono a vita (significativi se
ad alto titolo, importanza epidemiologica);
precoci; gli anticorpi neutralizzanti si
correlano con le IgG anti-VCA e sono
indicatori di immunità
anti-EA
Anti-EA/D (IgG): poco sensibili (70%) ma
specifici, precoci; persistono 3-6 mesi, sono
correlati con malattia severa
►
anti-EA/R (IgG): pochissimo sensibili,
malattia severa o protratta, persistono da 2
mesi a 2 anni; alti titoli nel linfoma di Burkitt
africano; indice di infezione riattivata
nell'immunosoppresso
►
anti-EBNA
► Anti-EBNA:
compaiono tardivamente
(solitamente contrassegnano la risoluzione
del quadro di M.I.), persistono a vita nel
100% dei casi
► Gli anticorpi diretti contro antigeni solubili
(fissazione del complemento) hanno il
significato degli anti-EBNA
Profilo sierologico delle sindromi associate ad EBV
Igantigene
non
immune
IgM-VCA
-
IgG-VCA
IgA-VCA
IgG-EA/D
IgA-EA/D
IgG-EA/R
antiEBNA
i. primaria i. primaria i. passata riattivazione
in corso
recente
+
+
+/+
+/-
+
+
+/+/-
+
+
+
+/+/?
+/+
LB
CNF
++
++
+
++
++
++
++
+
Anticorpi eterofili
non
assorbiti
M.I:
Malattia da siero
Soggetto
sano
con
anticorpi anti-Forssman
++++
+++
+
dopo assorbimento
con
cellule emazie di
renali di
bue
cavia
+++
0
0
0
0
+
Anticorpi eterofili
► Presenza
transitoria
► Agglutinano le emazie di pecora e di cavallo,
emolizzano le emazie di bue.
► La classe immunoglobulinica è prevalentemente
IgM
► Anticorpi eterofili con specificità Paul-Bunnell
coesistono con anticorpi anti-Forssman
► Non v'è buona correlazione fra gravità della
malattia e titolo eterofili.
► Il significato patogenetico è incerto
Autoanticorpi
► Sono
anche frequenti auto-anticorpi contro
piastrine
neutrofili
linfociti
antigeni nucleari
ampicillina.
Immunità cellulare
► Si
osserva una depressione dell’immunità cellulare,
con anergia cutanea, ridotta rispota blastica a
mitogeni ed antigeni in vitro.
► La risposta immune cellulare antivirale include
cellule T citotossiche specifiche e cellule natural
killer.
► Linfociti T citotossici per linee cellulari contenentei
EBV sono stati documentati in pazienti con MI.
Risoluzione
► Con
la guarigione clinica il virus non viene
eliminato, ma persiste allo stato latente,
potendo riattivarsi soprattutto in corso di
immunosoppressione.
► La MI non ricompare, comunque.
Patogenicità sperimentale
La malattia non è trasmissibile all'animale.
Linfomi maligni sono stati peraltro indotti in
alcuni primati o in roditori neonati, ovvero
immunosoppressi, inoculando linee
linfoblastoidi umana contenenti EBV o EBV
cell-free.
Oncogenicità
► L’infezione
latente da EBV è associata alla
generazione di linee B-linfocitarie
immortalizzate
► Questo dimostra il potere oncogeno del
virus
Latenza
► Dopo
l’infezione primaria, i linfociti B del
sangue periferico contengono EBV nella
proporzione di un cellula su 105 - 106.
► Quando 106 - 107 linfociti del sangue
periferico ottenuti da un soggetto EBVsieropositivo sono messi in coltura in
assenza di linfociti T funzionanti, è probabile
che emergano linee continue B-linfocitarie
contenenti EBV
Trasformazione e latenza
► Il
10% delle cellule B primarie poste in
coltura in presenza di EBV si infetta e si
trasforma in elemento capostipite di linea
linfoblastoide
► La replicazione virale in queste cellule
trasformate è minimale o non dimostrabile
► La presenza del virus è tuttavia
documentata dall’espressione di antigeni
caratteristici dell’infezione virale “latente”
Marcatori di latenza
► Nei
B linfociti B con infezione latente, EBV
esprime non soltanto 6 EBNAs e 2 LMPs, ma
anche 2 piccoli RNA non poliadenilati
(EBERs) e “Bam A rightward transcripts”, or
BARTs.
► Questi prodotti genici mantengono
l’infezione latente e fanno sì che linfociti B
quiescenti entrino nel ciclo mitotico,
iniziando una attività proliferativa continua.
Espressione di geni di latenza
Trasformazione
► L’effetto
sulla crescita cellulare è immediato;
la maggior parte delle cellule infettate entra
nel primo ciclo di sintesi del DNA entro 4872 ore dopo l’infezione
► Il linfocita B con fenotipo resting è la cellula
più suscettibile a subire la conversione in
elemento linfoblastoide
Sindromi neoplastiche associate ad EBV
Neoplasie e sindromi linfoproliferative
►
►
►
►
►
Linfoma di Burkitt africano: associazione con EBV nel 90%
dei casi
LB extra-africano: associazione nel 15% dei casi
Carcinoma nasofaringeo (squamoso o indifferenziato, Cina
meridionale); associazione nel 100% dei casi
Altri linfomi B-linfocitari dell'immunodepresso, nell’AIDS in
particolare; nell’atassia-teleangectasia
Sindromi linfoproliferative policlonali nell'immunosoppresso
(soprattutto nel trapiantato renale e midollare): PTLD
1600
TACROLIMUS
160.000
MYCOPHENOLATE
PREDNISONE
1400
CYCLOSPORIN
Ig monoclonal peaks
120.000
ACUTE GVHD
1200
CHRONIC GVHD
BK+HEMATURIA
1000
80.000
800
lymphocytes/ml
40.000
First EBV
detection
Plasma EBV assay
(3500 copies/ml)
(0 copies/ml)
EBV DNA clearance
BMT
time
04-Apr
21-Mar
28-Mar
14-Mar
07-Mar
28-Feb
21-Feb
14-Feb
07-Feb
31-Jan
24-Jan
17-Jan
10-Jan
03-Jan
27-Dec
20-Dec
13-Dec
0
06-Dec
Genomic copies of EBV in peripheral blood
lymphocytes/ml
600
400
200