
Lezione 9-10 10-XI-06
Cercare le sequenze in banca dati
http://www.ncbi.nlm.nih.gov/
- Per nome del gene, della funzione, di una struttura o di un
elemento o di un dominio funzionale
- Per sequenza con un frammento, con una struttura o un
elemento corrispondente ad una regione con una funzione
specifica,
- per omologia a domini funzionali
Amplificazione del DNA
Blastn con primers noti
sequenze dei DNA
corrispondenti agli ampliconi
A che ci serve amplificare tramite PCR delle sequenze di
DNA note?
- per sequenziarle, se ci si aspettano mutazioni o polimorfismi
- per usarle come sonde (ibridaz. South. North. In-situ)
- per trasformare delle cellule (costrutti con funzioni
specifiche da esprimersi nelle cellule)
- per clonarle
- per mutagenizzarle
- per preparare dei costrutti,
- per fare diagnostica e per n + 1 scopi
Differenze tra Southern, Northern e PCR
Tramite analisi Southern si determina il peso (lunghezza) dei
frammenti di restrizione su cui ibridano le sonde (marcate)
Tramite analisi Northern si determina la presenza e la
lunghezza di RNA trascritti, poliadenilati e non, contenenti la
sequenza della sonda
Tramite PCR si ottiene un amplificato corrispondente
all’amplicone compreso tra i due primers prescelti, selezionati,
disegnati secondo i criteri che vedremo in seguito
Parentesi I
DNA was isolated from several clinical samples
using Gentra's PUREGENE DNA Isolation Kit
and electrophoresed through a 0.7% gel at 60V
for 2hr. DNA size marker Lambda digested (lane
1 Hind III; lane 8 BstE2), DNA isolated
from human whole
blood (lane 2), bone
marrow (lane 3), buffy
coat (lane 4), clotted
blood (lane 5), cultured
cells fixed in 70%
ethanol (lane 6) and
muscle (lane 7)
digested with EcoRI.
Parentesi II
negli eucarioti gli mRNA
sono stabilizzati (polyadeniltati),
essendo solo ~ il 5% se si cerca un
messaggero poco espresso
conviene eliminare il rRNA
In questa figura dopo
ibridazione con la sonda
specifica di un gene
non si vede differenza tra
la corsia dell’ mRNA
arrichito ed RNA totale
Altre possibili applicazioni della PCR
- Oltre all’amplificazione diretta del DNA si può fare RT-PCR
tramite reverse transcriptase da mRNA
RT-PCR è il metodo per determinare l’espressione o meglio la
trascrizione di un gene
- alternativa all’analisi Northern ma non determina la lunghezza
del mRNA, solo la presenza e volendo la quantità trascritta
Altre possibilità di analisi tramite PCR
- perfezionamenti delle tecniche e degli enzimi
- nuove macchine con determinazione in tempo reale (realtime PCR) tramite laser (light-cycler) del DNA o cDNA
amplificato proporzionale al templato iniziale presente nel
campione in analisi.
Questa è la PCR quantitativa, diversa dalla PCR
semiquantitativa o competitiva.
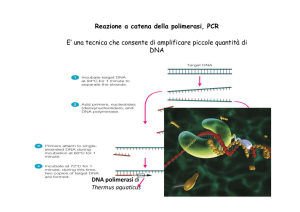
La reazione a catena della DNA polimerasi
PCR “polymerase chain reaction”
Descrizione della tecnica, metodo, componenti,
variabili, strumenti = termociclatori
Tecnica: amplificazione esponenziale a cicli successivi tramite
DNA polimerasi (adesso e’ termo resistente)
DNA polimerasi di “thermophilus aquaticus” (Taq polimerasi)
- salto di qualita’ del metodo, molto piu’ efficiente.
Le applicazioni si sono moltiplicate nella ricerca biologica e
medica, nella diagnostica e medicina forense (legale)
Il principio sfrutta l’efficienza (velocita’ di sintesi) della DNA
polimerasi utilizzando due inneschi (primers) artificiali scelti dallo
sperimentatore sulla sequenza da amplificare (modo esponenziale).
Come sintetizza la polimerasi
Ricordare per sempre:
Le polimerasi sintetizzano DNA o RNA in direzione 5’
partire da un innesco 3’ libero su un templato.
3’ a
Il DNA e’ una molecola a doppia elica, le due eliche sono
antiparallele, la sintesi avviene sempre nella stessa direzione
per ognuna delle eliche, quindi in verso opposto su ognuna di
esse, ma sempre 5’ 3’
La polimerasi poiche’ sintetizza in direzione 5’ 3’ scorrera’
sulla elica di DNA templato in direzione 3’ 5’
Come si fa la PCR, in cosa consiste
Reazione a Catena di Polimerizzazione RCP
PCR
- amplificazione tramite sintesi de-novo di nuovi filamenti di DNA
da parte della DNA polimerasi di Thermophilus aquaticus
- definizione: reazione ad amplificazione esponenziale con un
raddoppio teorico della quantità di DNA ad ogni ciclo di sintesi.
La DNA polimerasi di cosa ha bisogno ?
- del templato denaturato a singolo filamento (forca replicativa?)
- dei primers (inneschi)
- dei nucleotidi per la sintesi
- del tampone
- del Magnesio
Il ciclo (non il velocipede)
Primer frw.
+
_
= seq +
Denaturazione
5’
3’
3’
5’
Primer rev.
= seq -
2 eliche
Annealing a ~ 50°- 60° C
pr. rev.
5’
3’
pr. frw.
3’
5’
Extension (Polimerizzazione)
3’
5’
3’
5’
5’
3’
3’
I CICLO
5’
Denaturazione
5’
3’
3’
5’
5’
3’
3’
5’
4 eliche
Ciclo continuo
Annealing Extension (Polimerizzazione)
5’
3’
5’
3’
5’
5’
3’
5’
3’
5’
3’
3’
3’
5’
3’
II CICLO 4 eliche
5’
Denaturazione
5’
3’
5’
3’
3’
5’
3’
5’
5’
3’
5’
3’
3’
5’
3’
5’
8 eliche
IV ciclo
32 eliche…..
La crescita e’ esponenziale : teoricamente ad ogni ciclo un raddoppio di
DNA, ma dipende dalla messa a punto del protocollo di reazione,
molte variabili da ottimizzare
III CICLO
16 eliche
- senza contaminazioni amplificazione da quantita’ minime di DNA
(famtogrammi o singole cellule)
- genoma diploide
2 doppie eliche di templato in interfase
Le condizioni di reazione di ogni passaggio
vanno determinate per i tempi, temperature e
quantita’(conc.) ogni ciclo = 3 passaggi (fasi)
I
passaggio denaturazione (5-10 min. quella iniz. della reazione)
II passaggio appaiamento dei primers (annealing)
III passaggio di sintesi del DNA,
estensione del filamento di DNA a partire dai primers (inneschi)
Fine del ciclo
Alla fine dei cicli programmati viene fatta una estensione di
5 -10 min. per assicurare il completamento della sintesi di
tutti i nuovi frammenti iniziati e non terminati
Le componenti per la reazione:
Volume di reazione: da 10 a 50 ml (max 100 ml) per una preparativa.
Il DNA, abbastanza pulito, non deve essere purissimo, la quantita’ puo’ essere molto
poca, normamlmente si usano 10-100 ng di un genoma eucariotico, più di 500 ng
possono inibire della reazione
La Taq polimerasi, DNA polimerasi di “thermophilic eubacterium thermus
acquaticus” resiste a 95°, frequenza di errore superiore a quelle di eucarioti, 26 x106, ora ce ne sono per diverse finalita’, a basso tasso di errore = high fidelity 8.5 x10- 6,
e per frammenti lunghi genomici. Se ne usa da meno di 1U fino a 5 U, ma se si fanno
molti cicli conviene spezzare la reazione in due fasi e riaggiungerla
dNTPs: conc. standard 100 mM per ognuno
Il tampone: sale di Tris, il Mg concentrazione empirica tra 0. 5 mM e 4. 5 mM,
ogni Taq pol. ha un tampone con concentrazioni saline (buffer) ideali
I primers: scelti per funzionare in coppia, evitare GC ed AT finali, palindromi,
sequenze complementari, devono avere TM(melting) simili,
H2O q.b. sterile incontaminata per arrivare al volume finale
Fasi del ciclo, passaggi
I denaturazione, a 94°- 95°C, il Tempo a seconda della lunghezza del
frammento da amplificare. Prima del I ciclo si tiene a 95°C per qualche min. per la
denaturazione completa del DNA templato genomico. Cicli successivi meno si tiene ad
alta temperatura e meno si compromette l’attivita’ della Taq. Polimerasi 92°- 96°
II Temp. di “annealing” (appaiamento dei primers) Dipende dalla lunghezza
dei primers e dal contenuto in GC/AT (~3 gradi GC/ ~2 gradi AT) dipende anche dalla
concentrazione salina di NaCl e dal pH, ci sono programmi che la calcolano con un
algoritmo. La conc. finale dei primers di solito e’ 15 pmoli. La temperatura si tiene circa
4-10 gradi sotto la TM (Temp.Melting = 100% di denaturaz.)
III Extension, temperatura ottimale di sintesi della Taq polimerasi 72°C. Si usa ~1
unita’ di enzima per reazione, se il frammento e’ corto se ne puo’ usare 1/2; se il
frammento e’ lungo e il ciclo e’ lungo o ci sono molti cicli, si usano piu’ unita’. Si puo’
spezzare la reazione in due e riaggiungere Taq. Alcune Taq sono più attive vanno
calibrate.Volume aggiunto < 1/10 la soluz. della Taq contiene glicerolo anticongelante
Tempi di ogni passaggio (tipo di termociclatore)
I passaggio: denaturazione iniziale, una sola volta per tutta la reazione da 3’ a
10’ a 94°-95°secondo la lunghezza del frammento.
Ad ogni ciclo: denaturazione a 94°C 15’’- 45’’anche questa a seconda della
lunghezza e dalla % GC/AT
II passaggio: annealing dei primers secondo la TM tenendo la temp. 4°-10°
al di sotto della TM si sceglie la temp. ottimale in modo sperimentale aggiustandola
in modo da evitare amplificazione di frammenti aspecifici.
La durata di questo passaggio puo’ variare da 15’’ad 1 minuto (puo’ dipendere
anche dalla velocita’dello strumento a far variare la temperatura della piastra porta
provette (velocita’ di rampa).
III passaggio: sintesi del DNA a partire dai due primers (extension), la temp. e’
di solito 72°C. La durata puo’ essere di 15’’ fino ad 10 minuti se il frammento
supera le 5 kb fino a 20kb. La temp. puo’ essere piu’ alta (max.75°C) o piu’ bassa.
Se non ci sono frammenti aspecifici, si puo’ unificare con la fase di annealing e il
ciclo sara’ di due fasi anche 64°- 68°C.
Conclusioni:
Ogni PCR va aggiustata empiricamente per:
La quantita’ di DNA templato di partenza
La conc. del MgCl standard a 1.5mM(tra 0.5 - 4.5mM)
La conc. dei primers standard 15pmoli
La conc. dei dNTPs da 50mM a 200mM per seq. molto lunghe o molto
DNA da sintetizzare
Il volume di reazione di solito varia tra 15 e 100 m a seconda della
quantita’ finale di DNA che vogliamo o dello strumento, per PCR
preparative il volume puo’ essere maggiore (però piu’ lento a scaldarsi)
I tempi delle varie fasi (passaggi) dei cicli dipendono anche dal tipo di
macchina* che si usa, dal tipo di provette e dal volume di reaz.
Se e’ moderna* e rapida nel passaggio da una temperatura ad un’altra
delle tre temperature della reazione, si accorciano i tempi del ciclo.



![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)

![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)





