Amminoacidi
e
Proteine
Prof. Paolo Abis
Lic. Classico “D. A. Azuni”
SASSARI
Gli amminoacidi
ammoniaca
ammine
H
H
H
N
R
H
N
H
amminoacidi
Gruppo
carbossilico
H
Gruppo
amminico
H2N
C
R
COOH
Gruppo
radicale
Gli amminoacidi
• Gli amminoacidi sono i componenti base
delle proteine.
• Contengono un gruppo carbossilico ed un
gruppo amminico .
• Il gruppo radicale R rende l’amminoacido
unico e caratteristico.
R
gruppo radicale
|
H2N— C —COOH
|
H
Esempi di amminoacidi
H
I
H2N—C —COOH
I
H
glicina
CH3
I
H2N—C —COOH
I
H
alanina
Gli amminoacidi
• Gli amminoacidi che compaiono più
frequentemente nelle proteine degli organismi
viventi sono 20 e sono detti ordinari o
proteinogeni.
• Insieme a loro ne compaiono alcuni più rari, detti
occasionali.
• Alcuni di essi vengono prodotti per modifiche
chimiche successive alla sintesi della proteina.
• In natura sono stati finora scoperti oltre 500
amminoacidi diversi, alcuni sono stati addirittura
trovati nelle meteoriti.
Gli amminoacidi
• Piante e batteri sono in grado di produrre
amminoacidi particolari, che possono essere
trovati negli antibiotici peptidici, ad esempio la
nisina e l'alameticina.
• Oltre a quelli coinvolti nella sintesi delle proteine,
vi sono altri amminoacidi biologicamente
importanti quali:
•
•
•
•
la glicina,
l'acido gamma-amminobutirrico (GABA, un γ amminoacido)
e l'acido glutammico
la carnitina (coinvolta nel trasporto dei lipidi all'interno della
cellula), l'ornitina, la citrullina, l'omocisteina, l'idrossiprolina,
l'idrossilisina e la sarcosina.
Caratteristiche anfotere
• In soluzione acquosa sia - NH2 che - i gruppi di COOH
degli amminoacidi subiscono la ionizzazione.
• Per questo motivo gli AA hanno proprietà sia basiche
che acide.
• La forma presente in soluzione acquosa dipende dal
pH.
O
H
H3N
R
O
O
HO
OH
H
pKa1 = 2
O
H
H3N
O
OH
H
H2 N
H
R
pKa2 = 9-10
pH isoelettrico
R
Forma Zwitterionica
A causa della basicità
del gruppo amminico e
dell'acidità di quello
carbossilico, gli
amminoacidi isolati si
presentano in forma di
zwitterioni,
cioè ioni che recano
contemporaneamente
le due cariche opposte
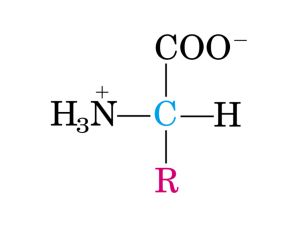
Al punto isoelettrico (pi), le cariche + e nello zwitterione sono uguali.
COO
+
H 3N
C
R
H
Gli amminoacidi sono acidi
• Nelle soluzioni con pH superiore al pi, il
gruppo NH3+ nell'amminoacido dona un
protone.
+
H3N—CH2—COO–
Zwitterione
al pI
OH–
H2N—CH2—COO–
Ione negativo
alto pH
Gli amminoacidi sono basi
• Nelle soluzioni con pH inferiore al pi, il
gruppo COO- dell'amminoacido accetta un
protone.
+
H+
+
H3N—CH2—COO–
H3N—CH2—COOH
Zwitterione
al pI
Ione positivo
basso pH
Un legame peptidico è un legame fra il gruppo
carbossilico di un amminoacido ed il gruppo amminico
dell'amminoacido seguente.
R
H
N
H
H
O
C
N
C
C
H
OH
H
R
O
C
H
+ H2O
R
H
N
H
C
H
O
C
N
R
C
H H
O
C
OH
OH
Peptidi e Proteine
• il legame che unisce due amminoacidi prende il nome di
legame peptidico. Una catena di più amminoacidi legati
attraverso legami peptidici prende il nome di generico di
polipeptide, uno o più polipeptidi, a volte accompagnati
da altre molecole ausiliarie, costituiscono una proteina.
• Un polipeptide che contiene 50 o più amminoacidi
è denominato proteina.
Proteine
semplici
Formate
esclusivamente da
amminoacidi
coniugate
Formate anche
da altri composti
Funzioni
All’interno del corpo, le proteine, svolgono numerose funzioni:
• funzione plastica promuovono la sintesi, la riparazione e
l’accrescimento tissutale
• funzione regolatrice controllano processi di natura biochimica per
mezzo di enzimi e ormoni di natura proteica
• funzione di trasporto veicolano gas e nutrienti nel torrente ematico
• funzione di difesa e protezione rivestono il ruolo di
immunoglobuline e di strutture cheratinizzate
• funzione energetica possono entrare a far parte dei processi di
produzione di energia
• Funzione contrattile e di movimento consentono alle cellule o alle
varie parti dell’organismo di contrarsi, cambiare forma e muoversi;
permettono il movimento di ciglia e flagelli
Possono essere individuati 4
Struttura
livelli
di struttura
Struttura primaria
è data dalla sequenza
amminoacidica nella catena
polipeptidica.
Struttura secondaria
l’alfa-elica e la struttura a
foglietto beta
Struttura terziaria
combinazione di più regioni
ad alfa-elica e/o beta-foglietto
collegate tra loro
Struttura quaternaria
più catene polipeptidiche
unite
(subunità)
Struttura primaria
• è data dalla sequenza amminoacidica nella catena polipeptidica.
• È l’ordine col quale si succedono gli amminoacidi lungo la catena
polipeptidica,
• ogni proteina possiede una propria caratteristica sequenza.
Struttura secondaria
• Consiste nella disposizione
nello spazio della catena
polipeptidica,
• E’ dovuta a legami
idrogeno tra il gruppo –NHdi un legame peptidico e il
gruppo –CO- di un altro
• Può essere ad elica o a
foglietto ripiegato
Struttura secondaria
• foglietto beta
Struttura terziaria
• è data dalla combinazione di
più regioni ad alfa-elica e/o
beta-foglietto collegate tra
loro da segmenti che formano
delle anse, le regioni ad
ansa.
• Le regioni ad ansa
costituiscono in genere il sito
funzionale della proteina: il
sito attivo di un enzima o il
sito di legame di una
proteina di trasporto o di un
anticorpo.
sito funzionale per l’0ssigeno
Mioglobina
Struttura quaternaria
• la proteina è formata da più
catene polipeptidiche (subunità)
unite con lo stesso tipo di legami
che stabilizzano le struttura
terziaria.
• Es.: la proteina completa
dell’emoglobina è formata da
quattro catene polipeptidiche
ripiegate. I gruppi eme sono
strutture non proteiche attaccate
alle catene polipeptidiche e
contenenti atomi di ferro che
legano e trasportano ossigeno.
Emoglobina
I livelli strutturali
Denaturazione
La denaturazione modifica la struttura secondaria,
terziaria o quaternaria delle proteine senza modificare
la composizione e la sequenza degli amminoacidi,
ovvero senza rompere i legami peptidici.
Questa trasformazione comporta vari fenomeni:
- perdita delle attività biologiche (ad esempio inattivazione degli
enzimi);
- coagulazione e aggregazione, per esempio con formazione di
schiume;
- incremento della sensibilità agli enzimi digestivi, ovvero aumento
della digeribilità che si verifica in genere con la cottura;
Denaturazione
La denaturazione può essere causata
da diversi agenti:
il calore è senz'altro il più importante,
poiché rompe i legami che
stabilizzano la forma nativa.
La formazione di schiume (come
l'albume montato a neve) avviene
grazie alla denaturazione
irreversibile delle proteine che si
dispiegano e si dispongono
all'interfaccia aria/liquido,
consentendo di intrappolare l'aria.