Fondamenti di chimica organica
Janice Gorzynski Smith
University of Hawai’i
Capitolo 9
Alcoli, eteri ed epossidi
Prepared by Rabi Ann Musah
State University of New York at Albany
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Fondamenti di chimica organica
Janice Gorzynski Smith
1
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Introduzione—Struttura e Legami
• Gli alcoli contengono un gruppo ossidrilico (OH) legato a
un atomo di carbonio ibridato sp3.
Fondamenti di chimica organica
Janice Gorzynski Smith
2
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Introduzione—Struttura e Legami
• I composti che hanno un gruppo ossidrilico legato a un
atomo di carbonio ibridato sp2 - enoli e fenoli –
reagiscono in maniera diversa dagli alcoli.
• Gli eteri hanno due gruppi alchilici legati a un atomo di
ossigeno.
Fondamenti di chimica organica
Janice Gorzynski Smith
3
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Introduzione—Struttura e Legami
• Gli epossidi sono eteri con un atomo di ossigeno
inserito in un anello a tre termini. Gli epossidi sono
chiamati anche ossirani.
• L’angolo di legame C—O—C di un epossido deve essere
di 60°, che risulta una considerevole deviazione
dall’angolo di legame tetraedrico di 109.5°. Per questo
motivo l’anello degli epossidi è sottoposto a tensione
angolare, che li rende molto più reattivi degli altri eteri.
4
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Introduzione—Struttura e Legami
• L’atomo di ossigeno in alcoli, eteri ed epossidi è ibridato
sp3. Alcoli ed eteri hanno una forma ripiegata come
quella di H2O.
• L’angolo di legame intorno all’atomo di O in un alcol o in
un etere è simile all’angolo di legame tetraedrico di
109.5°.
• Poichè l’O è molto più elettronegativo del carbonio e
dell’idrogeno, i legami C—O e O—H sono polari.
Fondamenti di chimica organica
Janice Gorzynski Smith
5
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Nomenclatura degli Alcoli
Fondamenti di chimica organica
Janice Gorzynski Smith
6
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Nomenclatura degli Alcoli
• Quando un gruppo OH è legato a un anello, l’anello viene
numerato a partire dal gruppo OH.
• Poichè il gruppo funzionale è sempre al C1, il numero 1 è di
solito omesso dal nome.
• L’anello è quindi numerato in senso orario o antiorario, in modo
da dare al sostituente successivo il numero più basso.
Figura 9.1
Nomenclatura
degli alcoli ciclici
Fondamenti di chimica organica
Janice Gorzynski Smith
7
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Nomenclatura degli Alcoli
• Per alcoli semplici si usano spesso dei nomi comuni. Per
assegnare un nome comune:
Nominare tutti gli atomi di carbonio di una molecola
come un singolo gruppo alchilico.
Aggiungere il termine alcol, separando le due parole
con uno spazio.
Fondamenti di chimica organica
Janice Gorzynski Smith
8
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Nomenclatura degli Alcoli
• I composti con due gruppi ossidrilici sono chiamati dioli
o glicoli. I composti con tre gruppi ossidrilici sono
chiamati trioli e così via.
Fondamenti di chimica organica
Janice Gorzynski Smith
9
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
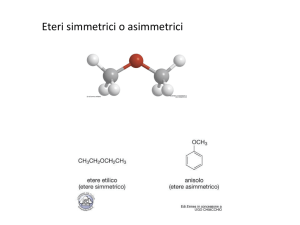
Nomenclatura degli Eteri
• Agli eteri semplici vengono generalmente assegnati
nomi comuni. Per assegnare un nome comune:
Nominare entrambi i gruppi alchilici legati all’ossigeno,
metterli in ordine alfabetico, e aggiungere la parola etere.
Per gli eteri simmetrici, nominare il gruppo alchilico ed
aggiungere il prefisso “di-”.
Fondamenti di chimica organica
Janice Gorzynski Smith
10
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Proprietà Fisiche
• Alcoli, eteri ed epossidi mostrano interazioni dipolo-dipolo
perchè possiedono una struttura ripiegata con due legami polari.
• Gli alcoli sono anche capaci di formare legami a idrogeno
intermolecolari, risultando perciò molto più polari degli eteri e
degli epossidi.
• I fattori sterici influenzano l’intensità del legame a idrogeno.
Fondamenti di chimica organica
Janice Gorzynski Smith
11
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Nomenclatura degli Eteri
• Gli eteri più complessi sono denominati secondo il sistema
IUPAC. Uno dei gruppi alchilici è chiamato come una catena
idrocarburica, e l’altro è chiamato come parte di un
sostituente legato a questa catena:
Chiamare il gruppo alchilico più semplice (insieme all’atomo
di O) come un sostituente alcossi cambiando la desinenza
–ile del gruppo alchilico in –ossi.
Chiamare il restante gruppo alchilico come un alcano, con il
gruppo alcossi come un sostituente legato a questa catena.
• Gli eteri ciclici hanno un atomo
di O nell’anello. Un esempio è il
tetraidrofurano (THF).
Fondamenti di chimica organica
Janice Gorzynski Smith
12
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Preparazione di Alcoli, Eteri ed Epossidi
• Alcoli ed eteri sono entrambi prodotti comuni delle
reazioni di sostituzione nucleofila.
• La preparazione degli eteri con il metodo descritto nelle
ultime due equazioni è detta sintesi di Williamson degli
13
eteri.
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Preparazione di Alcoli, Eteri ed Epossidi
• In teoria, gli eteri non simmetrici possono essere
sintetizzati in due modi diversi, ma in pratica uno dei due
percorsi è preferibile.
Fondamenti di chimica organica
Janice Gorzynski Smith
14
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Preparazione di Alcoli, Eteri ed Epossidi
• Per preparare un etere è necessario il sale di un
alcossido.
• Gli alcossidi possono essere preparati dagli alcoli,
mediante una reazione acido-base di BrØnsted-Lowry.
Per esempio, l’etossido di sodio (NaOCH2CH3) viene
preparato per trattamento dell’etanolo con NaH.
• NaH è una base particolarmente buona per preparare un
alcossido perchè il prodotto secondario della reazione,
H2, è un gas che evolve dalla miscela di reazione.
15
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Reazioni degli Alcoli
• Ricordare che, a differenza degli alogenuri alchilici in cui
l’alogeno si comporta come buon gruppo uscente, il gruppo
OH negli alcoli è un cattivo gruppo uscente.
• Perchè un alcol possa dare una reazione di sostituzione
nucleofila, è necessario che l’OH venga convertito in un
miglior gruppo uscente. Quando un alcol è trattato con un
acido, l’ ¯OH può essere convertito in H2O, un buon gruppo
uscente.
Fondamenti di chimica organica
Janice Gorzynski Smith
16
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Conversione di Alcoli ad Alogenuri Alchilici con HX
• Le reazioni di sostituzione nucleofila si verificano sugli alcoli
solo se il gruppo ¯OH è convertito in un miglior gruppo
uscente.
• La reazione degli alcoli con HX (X = Cl, Br, I) è un metodo
generale per la preparazione di alogenuri alchilici 1°, 2°, e 3°.
Fondamenti di chimica organica
Janice Gorzynski Smith
17
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Conversione di Alcoli ad Alogenuri Alchilici con HX
• Gli alcoli più sostituiti abitualmente reagiscono più rapidamente
con HX:
• Questo ordine di reattività può essere razionalizzato
considerando il meccanismo della reazione, che dipende dalla
struttura del residuo alchilico R.
Fondamenti di chimica organica
Janice Gorzynski Smith
18
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Conversione di Alcoli ad Alogenuri Alchilici con HX
• La conoscenza del meccanismo ci consente di prevedere la
stereochimica dei prodotti quando la reazione avviene su un
centro stereogenico.
Fondamenti di chimica organica
Janice Gorzynski Smith
19
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Conversione di Alcoli ad Alogenuri Alchilici con SOCl2
e PBr3
• Gli alcoli 1° e 2° possono essere convertiti nei
corrispondenti alogenuri alchilici usando SOCl2 e PBr3.
• SOCl2 (cloruro di tionile) converte gli alcoli in cloruri
alchilici.
• PBr3 (tribromuro di fosforo) converte gli alcoli in bromuri
alchilici.
• Entrambi i reagenti convertono in situ (cioè direttamente
nella miscela di reazione) ¯OH in un buon gruppo
uscente e forniscono anche il nucleofilo, Cl¯ o Br¯, che
sposterà il gruppo uscente.
Fondamenti di chimica organica
Janice Gorzynski Smith
20
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Conversione di Alcoli ad Alogenuri Alchilici con SOCl2 e PBr3
• Il trattamento di un alcol 1° o 2° con SOCl2 e piridina forma un cloruro
alchilico, insieme a SO2 e HCl.
• Il trattamento di un alcol 10 o 20 con PBr3 forma un bromuro alchilico.
Fondamenti di chimica organica
Janice Gorzynski Smith
21
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Reazioni degli Eteri con Acidi Forti
• Perchè gli eteri possano dare reazioni di sostituzione o di
eliminazione, il cattivo gruppo uscente presente deve essere
convertito in un buon gruppo uscente, per reazione con acidi
forti, come HBr e HI, che sono anche una fonte di buoni
nucleofili (Br¯ e I¯).
• Quando gli eteri reagiscono con HBr e HI, si ha la rottura di
entrambi i legami C—O e la formazione di due alogenuri alchilici.
Fondamenti di chimica organica
Janice Gorzynski Smith
22
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Reazioni degli Alcoli—Disidratazione
• La disidratazione, come la deidroalogenazione, è una
reazione di eliminazione in cui OH ed H sono rimossi
rispettivamente dagli atomi di carbonio in e .
• La disidratazione è tipicamente realizzata con l’uso di H2SO4 e
di altri acidi forti, o con ossicloruro di fosforo (POCl3) in
presenza di una ammina.
Fondamenti di chimica organica
Janice Gorzynski Smith
23
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Reazioni degli Alcoli—Disidratazione
• Alcuni degli acidi comunemente usati per la disidratazione
degli alcoli sono H2SO4 o l’acido p-toluensolfonico (TsOH).
• Gli alcoli più sostituiti disidratano più facilmente, in base al
seguente ordine di reattività:
Fondamenti di chimica organica
Janice Gorzynski Smith
24
Copyright © 2009 – The McGraw-Hill Companies srl
Alcoli, Eteri ed Epossidi
Reazioni degli Alcoli—Disidratazione
• Quando un alcol ha due o tre differenti atomi di carbonio in ,
la disidratazione è regioselettiva e segue la regola di Zaitsev.
• Quando è possibile ottenere una miscela di isomeri
costituzionali, il prodotto principale della reazione è l’alchene
più sostituito.
Fondamenti di chimica organica
Janice Gorzynski Smith
25
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazione e Riduzione
Ossidazione degli Alcoli
• Gli alcoli sono ossidati a una varietà di composti carbonilici.
Fondamenti di chimica organica
Janice Gorzynski Smith
26
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazione e Riduzione
Ossidazione degli Alcoli
• L’ossidazione degli alcoli a composti carbonilici è eseguita in
maniera classica con ossidanti a base di Cr6+, che nei prodotti
sono ridotti a Cr3+.
• CrO3, Na2Cr2O7, e K2Cr2O7 sono ossidanti forti, non selettivi, usati
in soluzioni acquose acide (H2SO4 + H2O).
• PCC è solubile in CH2Cl2 (diclorometano) e può essere usato in
assenza di acidi forti, risultando perciò un agente ossidante più
blando e più selettivo.
Fondamenti di chimica organica
Janice Gorzynski Smith
27
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazione e Riduzione
Ossidazione di Alcoli 2°
• Tutti gli ossidanti al Cr6+ ossidano efficacemente alcoli 2°
a chetoni.
Fondamenti di chimica organica
Janice Gorzynski Smith
28
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazione e Riduzione
Ossidazione di Alcoli 1°
• Gli alcoli 1° sono ossidati ad aldeidi o ad acidi
carbossilici, in funzione del reagente usato.
Fondamenti di chimica organica
Janice Gorzynski Smith
29
Copyright © 2009 – The McGraw-Hill Companies srl