Corso di Chimica Fisica II
2011
Prof. Marina Brustolon
6. La particella nella scatola
La particella nella scatola
Una scatola monodimensionale
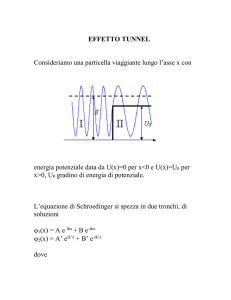
Consideriamo il moto lungo x di una particella di massa m
costretta in una “scatola” fatta in questo modo:
Come sarà la sua
funzione d’onda?
Dentro la
scatola il
potenziale
è zero
Fuori dalla
scatola il
potenziale
è infinito
Fuori dalla
scatola il
potenziale
è infinito
V=0
V=
0
V=
L
x
Dentro la scatola le condizioni del moto sono come quelle della
particella libera: quindi, le autofunzioni e gli autovalori saranno
della forma
2k 2
ikx
ikx
E
( x) Ae Be
2m
Riscriviamo la soluzione generale come:
dove A’ e B’ sono costanti.
V=0
0
L
x
Ma…Oh
( x) A'cielo!
sin kxMi
Bviene
' cos kx
un dubbio
Tutte le funzioni
angoscioso! Ma siamo sicuri che
( x) A sin kx B cos kx
tutte le funzioni
vanno bene per descrivere
( x) A sin kx B cos kx
il moto della particella
vadano bene per descrivere il
libera…
moto della particella anche in
questo caso??!
Non tutte le funzioni possono descrivere uno
stato fisico reale!
Come abbiamo già visto ci sono funzioni che non possono essere
funzioni d’onda perché non rappresentano stati fisici possibili.
La funzione è
discontinua
La sua pendenza è
discontinua
Non è a valore
singolo
E’ infinita in una
regione finita
Le condizioni al contorno
Non tutte le funzioni della famiglia di autofunzioni
dell’Hamiltoniano della particella libera sono funzioni
accettabili per la particella nella scatola. Vediamo perché.
Riscriviamo l’eq. di Schroedinger così:
2 d 2 ( x)
(V E ) ( x)
2
2m dx
Curvatura
della funzione
Ora occupiamoci delle funzioni d’onda per la particella fuori dalla buca.
Fingiamo che inizialmente il potenziale fuori della scatola non sia infinito,
ma molto grande. Avremo allora (V-E) > 0 al di fuori della buca.
In questo caso, la curvatura della funzione sarebbe negativa, se (x)
è positiva, o positiva, se (x) è negativa. Ma quello che importa è che
la curvatura resterebbe sempre dello stesso segno allontanandosi
dalla scatola, e quindi la continuerebbe a crescere, tendendo a + ,
o a decrescere, tendendo a - . Una funzione di questo genere
sarebbe inaccettabile, cioè non potrebbe rappresentare uno stato
reale della particella.
Qual è l’unica conclusione possibile?
Se non può essere (x) > 0,
né (x) < 0, allora deve essere
(x)=0 !
Ma allora, perché la
funzione sia continua, se è
uguale a zero appena fuori
dalla scatola, deve essere
= 0 anche sulle pareti!
V=0
0
Ecco quindi le due condizioni “al
contorno”:
L
(x)=0
x
(0) = 0, (L) = 0
L’effetto delle condizioni al contorno
( x) A sin kx B cos kx
(0) A sin 0 B cos 0 B
( L) A sin kL 0
(0) = 0
(L) = 0
Quindi deve essere B=0
solo se k L = n con n = 1 ,2,. . .
Quindi, le due condizioni al contorno hanno limitato le funzioni compatibili
a quelle della forma
( x) A sin
n
x
L
Non sono più
possibili tutte
le energie!!
2k 2
Di conseguenza, ricordando che l’energia è E
:
2m
2 n 2 2
h 2 n 2 2 n 2 h 2
E
2
2
2
2mL
4 2mL 8mL2
2
2
nh
E
8mL2
Compare un numero
n
quantico:
Le energie permesse
n2h2
E
8mL2
Notate che per la particella libera tutte le energie
erano permesse, perché non c’erano restrizioni: la
particella libera può avere qualsiasi energia cinetica
(si è visto che per esempio l’elettrone viene
accelerato inizialmente da una differenza di
potenziale, che può essere scelta arbitrariamente).
Viceversa, per la particella nella scatola le
condizioni al contorno impongono restrizioni alle
funzioni d’onda e quindi all’energia, che è ora
quantizzata. Appare per la prima volta un numero
quantico, che è il numero intero n =1,2,3. . .
Tutti gli stati della particella dei quali ci
occuperemo d’ora in poi saranno stati quantici.
Questi hanno solo alcune energie permesse,
caratterizzate da uno o più numeri quantici. Il
numero di numeri quantici dipende dai gradi di
libertà del sistema.
La forma delle autofunzioni
1. Le funzioni con n pari e
dispari sono rispettivamente
antisimmetriche e
simmetriche rispetto
all’inversione di direzione
dell’asse x.
2. La funzione con n=1, cioè
quella che corrisponde
all’energia minima, non
diventa mai = 0 (a parte per
x=0 e x=L), cioè non ha nodi.
Poi, al crescere di n,
aumenta il numero di nodi.
3. Si noti come, al
crescere dei valori
dell’energia (che è solo
cinetica) aumenti la
curvatura delle
funzioni.
( x) A sin
n=5
n=4
n=3
n=2
n=1
n
x
L
Le funzioni vanno
normalizzate!
Cerchiamo il valore di
A che normalizza la
funzione.
0
( x) * ( x)
L
A
2
2
sin
0
0
L
Perché sia
n
x dx
L
L
A2
2
( x) * ( x) 1
1/ 2
2
L
n ( x) sin
n
x
L
1/ 2
deve essere:
2
A
L
Le funzioni d’onda
1/ 2
2
n ( x)
L
sin
n
x
L
(x)
E
Si usano spesso grafici in cui
si fa vedere la forma della
funzione d’onda o il suo
quadrato in corrispondenza
del rispettivo livello
energetico.
n=4
n=3
n=2
n=1
Probabilità di
trovare la
particella ai
diversi valori di x
2 ( x)
n 1, 2 L
n 2, L
0
Esercizio
Osservando che la lunghezza
d’onda delle funzioni della
particella nella scatola è uguale a
2L/n, usare la relazione di De
Broglie per ottenere l’energia
degli stati.
n 3, 2 L / 3
0
L
1/ 2
2
n ( x)
L
n
sin
x
L
L’energia è solo cinetica (V=0 dentro la
scatola), quindi si può usare la
relazione di De Broglie per ottenere il
momento lineare, e calcolare l’energia
cinetica:
Come trovato
h
hn
pn
risolvendo l’eq. di
( n) 2 L
Schroedinger
pn2 n 2 h 2
Ecin (n)
2m 8mL2
Altre proprietà della particella nella scatola
•
•
Come abbiamo già visto, le funzioni del tipo sin x non sono autofunzioni del
momento lineare. Quindi la particella nella scatola non ha un valore
definito del momento lineare (si può immaginare come un’onda stazionaria,
che quindi non corrisponde ad un moto uniforme in una direzione).
•
Come abbiamo visto, la particella nella scatola non può avere energia = 0.
L’energia minima, che corrisponde a n=1, è chiamata “energia del punto
zero”. Questa proprietò può essere messa in relazione con il principio di
indeterminazione: se l’energia fosse zero, il momento sarebbe p=0, quindi
perfettamente definito. Ma poiché l’incertezza nella posizione della
particella non è infinita, il momento non può essere perfettamente
definito.
La probabilità di trovare la particella quantistica in
diversi punti della scatola, è diversa per le diverse
funzioni, e diversa da punto a punto. Per esempio non
potrà mai trovarsi nei punti di nodo. Si noti il diverso
comportamento di una particella classica, che in una
scatola potrebbe essere trovata con eguale
probabilità ovunque.
0
0
Nel grafico è riportata la 40: ad alti n il comportamento è via via più simile a
quello classico principio di corrispondenza.
L
Ma c’è qualche caso reale che assomigli
alla particella nella scatola?
Negli idrocarburi insaturi con legami coniugati, gli elettroni dei legami
sono delocalizzati su tutta la molecola, sono cioè mobili lungo tutta la
molecola. Vediamo per esempio la molecola del butadiene.
Gli elettroni sono mobili
H
C
H
H
H
C
C
C
H
H
Esercizio
Trattando questo poliene coniugato come una scatola per gli elettroni ,
calcolare la differenza di energia tra il primo e il secondo livello energetico.
Ragionamento. Gli elettroni dei legami si considerano intrappolati nella
scatola costituita dai legami C-C. La distanza C-C nelle catene coniugate è di
circa 130 pm, quindi essendoci qui 7 legami, otteniamo una scatola di circa
1000 pm, cioè 1 nm.
n2h2
34
-31
-9
h
6
.
62
10
J
s
m
9.11
10
kg
L
10
m
E
2
8mL
Primo livello, n=1
Secondo livello, n=2
h2
(6.62) 2
(1034 ) 2
J 2s2
1068
20
E1
0
.
6
J
6
10
J
2
31
18
2
49
8mL
8 9.11 10 10
kg m
10
4h 2
E2
8mL2
4h 2
h2
3h 2
20
E2 E1
18
10
J
2
2
2
8mL 8mL 8mL
Immaginiamo una transizione
dell’elettrone dal primo livello al
secondo
n=4
n=3
n=2
E 18 1020 J
h =E
n=1
E 18 1020 J
14 1
3
10
s
34
h 6.62 10 J s
h
Alcuni coloranti naturali
La scatola è molto più estesa, L è più grande, le differenze di
energia sono più piccole, la frequenza delle transizioni
elettroniche si sposta dall’UV al visibile.
La particella nella scatola
bidimensionale
( x, y ) X ( x)Y ( y )
2
En1n2
2
n1 h 2 n2 h 2
2
2
8mL1 8mL2
1/ 2
4
n
n
sin 1 x sin 2 y
n n
L1
L2
L1 L2
1 2
Vediamo la forma delle funzioni per la scatola
quadrata (L1=L2)
Questa è la che
corrisponde all’energia
più bassa.
E11
L1 e L2 eguali
E12
piano
nodale
Questa funzione d’onda corrisponde ad
un’energia uguale alla precedente, ed è
caratterizzata dai numeri quantici 2,1.
E21
Questa funzione d’onda corrisponde ad
un’energia più alta della precedente, ed è
caratterizzata dai numeri quantici 2,2.
E22
Energia potenziale
Particella nella scatola a pareti finite
infiniti livelli
nulla sulle pareti
livelli in numero finito (a
energie più alte l’energia è un
continuo)
simile come forma, ma
penetra nelle pareti (tunneling).
Modo di costruire una “buca quantica” (“quantum
well”) con metodi di ingegneria su nanoscala
Processo: epitassia con fasci molecolari
AlGaAs
GaAs
AlGaAs
Al
Ga
As
Celle effusive
U(x)
x
Un elettrone ha meno energia in GaAs che in AlGaAs. Può quindi
essere intrappolato nella buca, e i suoi livelli di energia diventano
quantizzati. Si creano così nuove proprietà elettriche e ottiche, che
vengono sfruttate nella costruzione di dispositivi.



![[20120717] G.Giuni - La particella di Dio](http://s1.studylibit.com/store/data/007496773_1-f092519b9bc101b4085a20f32004c93f-300x300.png)