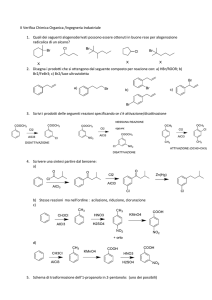
Cinetica chimica
• Studio delle velocità di
• la velocità di reazione
reazione e del modo in
• concentrazione, tempo e
cui procedono:
temperatura
il meccanismo.
• Equazione di Arrhenius • Termodinamica
• Molecolarità reazione
(DG e Keq): è favorito il
prodotto o il reagente?
• Energia di attivazione
Nessuna informazione
• Catalisi
sull’equilibrio.
Cinetica chimica
una velocità è la variazione di una
proprietà per unità di tempo:
variazione della concentrazione del
reagente o prodotto
diviso
tempo impiegato perché la
variazione si compia
l'unità della velocità di reazione è
mol/(L . s)
Iniziale, Media, Istantanea
N2O4
2NO2
Velocità di reazione
Si definisce velocità della reazione
A+B C+D
l'aumento della concentrazione dei prodotti o la diminuzione della
concentrazione dei reagenti nell'unità di tempo
V=-
d [A]
dt
= -
d [B]
dt
=
d [C]
dt
=
Concentrazione di A si indica con [A]
d [D]
dt
Velocità e concentrazione
Fattori che modificano la velocità:
• Stato fisico dei reagenti e prodotti
• Concentrazione
• Temperatura
• Catalizzatori
• Per studiare un meccanismo di reazione si
analizza come la velocità dipende dalla
concentrazione
Velocità istantanea di reazione
Calcolo della
velocità
istantanea
• Man mano che la concentrazione dei reagenti
diminuisce la velocità in genere cambia, quindi la
velocità varia col tempo.
Velocità iniziale
Legge della velocità
e ordine di una reazione
La costante k che appare nella
equazione di velocità è detta costante
di velocità e dipende dal tipo di
reazione e dalla temperatura
Reazioni di primo ordine
è di 1° ordine perché
sperimentalmente si
trova che :
La velocità iniziale dipende SOLO dalla
concentrazione del reagente
3H
3He
+ e-
V = k [3H]
V = k [N2O5]
Il decadimento radioattivo del trizio è
di primo ordine in quanto la
sua velocità dipende linearmente dalla
concentrazione dell’isotopo
Cinetiche di primo ordine
Se v aumenta proporzionalmente al crescere di [X] si dice che la
reazione è del primo ordine rispetto a X; la k di velocità è del I°
ordine ed è data dalla pendenza della retta
v = k [X]1 (l’esponente in genere si omette)
La k ha le dimensioni di sec-1
[X]
i punti rossi rappresentano dati ottenuti
sperimentalmente, misurando la
velocità a concentrazioni diverse di X;
la K è data dalla pendenza della retta
che si ottiene ottimizzando
(generalmente col metodo dei minimi
quadrati) la retta individuata dai punti
sperimentali; i punti non giacciono tutti
esattamente sulla retta dato che sono
soggetti a errori sperimentali.
Dipendenza dal tempo
Consideriamo la reazione A prodotti
V = k [A] = -d[A]/dt ; da cui -d[A]/[A] = kdt
Se integriamo l’equazione differenziale tra 0 e t avremo che:
-
A
d[ A ]/[ A ] = K
A0
t
dt
da cui derivando:
0
ln [A]/[A]0 = -k (t)
[A] = [A]0 e -Kt
ln = logaritmo naturale,
[A]0 = concentrazione a tempo 0,
A
100
[A] = concentrazione a tempo t
0
[A]
80
K = 0.1
60
40
20
0
0
10
20
30
t
40
50
Se partendo da:
ln [A]/[A]0 = -k (t)
in questa poniamo [A] = 1/2 [A]0, (se vogliamo cioè che la concentrazione sia
la metà dell'iniziale, come definito per il tempo di dimezzamento), e dato che t0
= 0 (inizio della reazione), avremo:
Da cui
k = 0.693 / t1/2
la K cinetica di I° ordine è indipendente dalla
[reagente] e possiede come unità dimensionale
il reciproco del tempo
Tempo di dimezzamento - I° ordine
Nelle reazioni di I° ordine
la velocità può essere
espressa in emivita
cinetiche di I° ordine
5
100
k = 0,2
AB
90
80
0
0
70
2
3
-5
60
[A]
1
50
ln[A]
40
30
4
k=1
-10
-15
20
-20
10
k=5
0
t1/2
0
1
0,14 0,69
2
3
t (s)
3,47
4
5
-25
t (s)
K = 0.693 / t1/2
5
“linearizzazione” della cinetica di I° ordine
Grafico ln [A] contro t per una
reazione del I° ordine.
ln[A] = -kt + ln[A]0
E' possibile capire se una reazione è
del I° ordine calcolando i logaritmi
delle concentrazioni misurate a tempi
definiti e riportando in diagramma le
coppie di valori.
Se i punti stanno su una retta, allora la
reazione è del I° ordine, la K è l'inverso
della pendenza della retta e
la concentrazione iniziale è calcolabile
dall'intercetta sull'asse delle ordinate.
ln [A]0
Reazioni di secondo ordine
la reazione è di secondo ordine se l’equazione cinetica
derivata sperimentalmente è:
V = k [A]2
H2 + I2
2HI
V = k [H2] [I2]
La reazione è di 2° ordine perché la
somma degli esponenti che compaiono
nell’equazione cinetica è uguale a 2
Cinetiche di secondo ordine
2 casi
A
+
A
A
+
B
PRODOTTO
PRODOTTO
Cinetiche di secondo ordine
60
1° caso
50
Esaminiamo ora una reazione del II° ordine
che può essere, per esempio,
V
2 A prodotti
V=K
[A]2
= -d[A]/dt
da cui
40
-
d[A]/[A]2 = K dt
Se integriamo questa equazione
differenziale otteniamo che
30
20
10
0
0
5
10
15
20
25
[A]
K è espressa in (sec-1 mol-1 L).
Risolvendo la precedente equazione
Pendenza =
possiamo linearizzare in:
1/[A] = 1/[A]0 + Kt
1/[A]0
K
V = k [A] [B]
2° caso
Se [A]= costante e [A]o >>[B]o ln [B]/[B]o =-K[A]ot
In queste condizioni il grafico ln[B] vs t risulta lineare
(la reazione è di I ordine rispetto a B) la kapp ricavabile dalla pendenza
(a differenza di quanto accade in una vera reazione di I° ordine) dipenderà dalla [A]o
[A]0[B]
ln
=
[A][B]0
A
A
A
A
A
A
A
A
A
A
A
A
A
A
A
A
A
A
B
A
A
A
A
A
A
A
A
B
A
A
A
A
A
A
A
A
A
A
A
A
A
[B]0
= -K[A]0t
Ln[B]
A
A
A
A
B
A
ln
[B]
ln [B]0
Pendenza= -k[A]0
A
Reazioni di ordine zero
Le cinetiche di ordine 0 sono verificabili in certe condizioni quando
V = -d[A]/dt = K
da cui
- D[A] = Kt
Riassunto dei metodi grafici per individuare l’ordine di reazione
rate= k[A][B]
ln
[A]0[B]
[A][B]0
k ([B]0-[A]0)
2 N2O5 4 NO2 + O2
Confrontando i diversi “plots
diagnostici” quello che
risulta in una linea retta
darà l’indicazione sull’ordine
di reazione
Leggi cinetiche e costanti
Le costanti di velocità possono avere valori molto
diversi nei diversi tipi di reazioni
Aumentano sempre all’aumentare della temperatura
Dipendenza dalla temperatura
• La velocità delle reazioni
aumenta con la
temperatura
• Quindi k è dipendente
dalla temperatura
• Equazione di Arrhenius:
k=A·
Ea
-RT
e
A= fattore pre-esponenziale
Ea= energia di attivazione
T= temperatura assoluta
R= costante dei gas
lnk = lnA -
Frazione di molecole dotate
dell’energia minima per la reazione
Ea
RT
Equazione di Arrhenius
nella forma logaritmica
Equazione di Arrhenius
k Ae
E a / RT
Ea
ln k ln A
R
1
T
Ea
pendenza
R
intercetta = ln A
Parametri di Arrhenius
Fattori pre-esponenziali A ed Ea
di alcune reazioni
Energia di Attivazione
L’energia di Attivazione è la barriera energetica che si
deve superare affinché si formi il complesso attivato e la
reazione possa procedere verso la formazione dei prodotti.
Essa determina la Costante di velocità. Maggiore è
l’Energia di Attivazione, minore sarà la costante di velocità
k = Ae-Ea/RT
L’energia cinetica è funzione della temperatura
T1
Ec = 1 mv2
2
Energia
cinetica
massa
T2 > T1
v = 3RT/pM
Velocità
media
temperatura
Ec=RT. 3/2(m/pM)
Peso
molecolare
frazione di molecole aventi energia inetica
Distribuzione di Maxwell-Boltzmann
0,1
dN/N = 4p(m/2pkT)3/2 e-(1/2)mEc /kT Ec2
dEc
0,09
T1
0,08
T1 < T2 < T3 < T4
0,07
0,06
0,05
T2
0,04
Energia
di attivazione
0,03
All’aumentare della temperatura,
aumenta la frazione di molecole con
energia cinetica maggiore
dell’energia di attivazione, l’area
sottesa alla curva, a destra
dell’energia di attivazione, è una
misura della frazione di popolazione
di molecole con Ec Ea
T3
0,02
T4
0,01
0
0
20
40
60
80
energia cinetica
100
120
Meccanismo di reazione
• Lo studio della velocità di reazione dà indicazioni
sul meccanismo di reazione e sulla molecolarità
della reazione elementare (numero di molecole
che vi partecipano).
• Le reazioni possono essere considerate come
composte da sequenze di reazioni elementari.
Quella più lenta determina la legge cinetica
• Le reazioni di I° ordine sono solitamente monomolecolari
• Quelle di II° ordine sono bi-molecolari.
Teoria delle collisioni (gas)
o del complesso attivato
Le molecole per reagire devono
collidere
Si avrà reazione solo se le
particelle collidenti possiedono
una energia maggiore di un
valore minimo detto energia di
attivazione
In questo caso si parla di urto
efficace
animazione
1.
A temperatura costante, la velocità della
reazione è proporzionale alla concentrazione dei
reagenti
occorre che A e B entrino in collisione, Quindi, quanto maggiori
sono le concentrazioni di A e di B tanto maggiore è la probabilità
che A e B collidano
2. la costante di velocità della reazione
aumenta esponenzialmente con la temperatura
la frequenza delle collisioni aumenta con l’energia cinetica media
delle particelle, che è funzione della temperatura:
EM = 1/2 mv2 = 3/2 RT
Se la reazione A + B C + D comporta la collisione
fra una molecola di A e una molecola di B, come fase
lenta del processo ...
C
Ea
A
D
B
A-B
risultano efficaci soltanto le collisioni nelle quali viene
scambiata un’energia uguale o superiore ad un valore
limite: l’energia di attivazione Ea della reazione.
Si chiama complesso attivato l’intermedio ad alta
energia indicato con A-B
A...B
E
N
E
R
G
I
A
Ea
A+B
C+D
coordinata di reazione
Anche se energeticamente adeguate, non tutte le
collisioni fra A e B sono efficaci, esempio di
reazione di 2° ordine.
CH3Cl + OH-
CH3OH + Cl-
La collisione fra i due reagenti deve consentire la
formazione del complesso attivato…
Cl
I
II
+
-
Sono efficaci soltanto gli urti nei quali lo ione
ossidrile attacca l’alogeno-derivato alchilico dal
lato opposto a quello dove è legato l’atomo di
alogeno
Rate limiting Step
(stadio limitante della velocità)
Ciascuno dei passaggi intermedi ha una sua
velocità di reazione
La velocità complessiva è determinata DAL PIU’
LENTO DEI PASSAGGI INTERMEDI
2O3 (g) 3O2 (g)
Stadio 1, monomolecolare:
O3 (g) O2 (g) + O (g)
Stadio 2,
O3 (g) + O (g) 2O2 (g)
bimolecolare:
I processi elementari
H2 + Br2 2HBr
v = k [H2][Br2]
Questa reazione avviene attraverso una serie di processi
elementari:
Br2 2Br°
Formazione di radicale (veloce)
Br° + H2 HBr + H°
stadio lento
H°+ Br2 HBr + Br° propagazione della catena (veloce)
2Br° Br2
Reazione di terminazione delle catena (veloce)
vreazione = k’ [H2][Br°]
La concentrazione di Br non può però
essere dedotta sperimentalmente, quindi va
espressa in funzione di quella di Br2
Br2
2Br°
vreazione = k [H2][Br2]
H2 + Br2 2 HBr
molecole = 2
V = K[H2][Br2]
ordine di reaz. = 1+1=2
Br2 2 Br
TAPPA LENTA
Br + H2 HBr + H
H + Br HBr
V = K[H2][Br] = K[H2][Br2]
esempio
H2 + I2 2 HI
molecole = 2
V = K[H2][I2]
ordine di reaz. = 2
OH- + BrC(CH)3 Br- + HOC(CH)3 molecole = 2
V = K[BrC(CH)3]
ordine di reaz. = 1
CH3
|
H3C- C +…… Br|
CH3
CH3
|
H3C- C+……. OH|
CH3
CH3
|
H3C- C - Br
OH-
|
CH3
CH3
|
H3C- C+
|
CH3
BrCH3
|
H3C- C - OH
|
CH3
Br-
La catalisi
• Un catalizzatore è una sostanza che causa
un aumento della velocità di una reazione
senza venire consumata dalla reazione.
• Esso influisce sul meccanismo di reazione
CATALYSIS
Catalysis and activation energy
Br2 catalyzes
decomposition of H2O2
2 H2O2 ---> 2 H2O + O2
Uncatalyzed reaction
Catalyzed reaction
Catalizzatore omogeneo
2 H2O2 (aq) 2H2O (l) + O2 (g)
Catalizzata da Br2
Br2(aq) + H2O2(aq) 2Br-(aq) +2H+(aq) + O2
2Br-(aq) +H2O2(aq) + 2H+ Br2(aq) + 2H2O
L’ossido di platino è un catalizzatore. La sua
funzione è quella di modificare il valore della
costante di velocità della reazione.
+3 H2
C6H6
+
PtO2
3H2
Reazione veloce
C6H12
La reazione di esterificazione di un acido
carbossilico è un processo lento.
H+
O
H3C C
OH
H O CH3
O
H2O
H3C C
OCH3
É accelerata aggiungendo un acido minerale che ha
funzioni di catalizzatore.
Il catalizzatore consente la formazione degli stessi
prodotti seguendo un percorso di reazione caratterizzato
da un più basso valore della energia di attivazione.
frazione di molecole aventi energia inetica
0,03
Ea di reazione
catalizzata
0,025
Ea di reazione
non catalizzata
0,02
0,015
0,01
0,005
0
0
20
40
60
80
100
120
energia cinetica
Un catalizzatore abbassando** l’energia di attivazione di
una reazione permette di reclutare, alla stessa temperatura,
un maggior numero di molecole dotate di energia
sufficiente a raggiungere lo stato di transizione.
** l’affermazione abbassare l’energia di attivazione è semplicistica. Quello che
accade in realtà, è che il catalizzatore fornisce un “via alternativa” al cammino di
reazione.
Conversione di acido formico in
monossido di carbonio ed acqua
Reazione in ambiente acido
Come cambia il plot di Arrhenius
per una reazione catalizzata?
lnK = lnA - Ea . 1_
R
T
Aumenta valore di
intercetta sull’asse
delle ordinate
lnA
lnA
Reazione
catalizzata
ln K
Reazione non
catalizzata
Ea < Ea
1/T
Diminuisce la
pendenza
Esempio di reazione catalizzata
animazione
Etilene + idrogeno
C2H4 + H2
sulla superficie di un
metallo catalizzatore
Reazione non
catalizzata
2 H2O2
Gli enzimi sono catalizzatori
biologici estremamente efficienti
Reazione catalizzata
da polvere di Pt
2 H2O + O2
Reazione catalizzata
dalla catalasi
Gruppo prostetico eme
Atomo di Fe
Struttura tridimensionale della
catalasi di eritrocita umano
Enzima
libero
Complesso
enzima-substrato
Complesso
enzima-prodotto
Enzima
libero
Sito attivo vuoto
dell’enzima
Substrato
nel sito attivo
La straordinaria complementarietà del sito attivo di
un enzima al suo substrato lo rende un catalizzatore
estremamente efficiente e specifico
Conclusioni
• L’equazione della velocità è ottenuta
sperimentalmente e non necessariamente
correlata alla equazione chimica
• Essa varia con la temperatura ed il tipo di
reazione.
• I catalizzatori modificano il meccanismo di
reazione, ed abbassano Ea