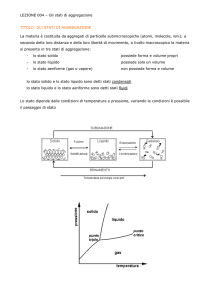
Cinetica chimica ed equilibrio chimico
Prendiamo un’equazione chimica; ad esempio:
2 H 2 + O2
2 H2O
a) in quanto tempo avverrà?
b) andrà a compimento?
c) produrrà energia o la assorbirà?
Velocità di reazione
Velocità di reazione:
numero di molecole che si trasformano in un determinato
intervallo di tempo.
Indichiamo con [A] , [B] , [C] , [D] le concentrazioni dei reagenti e dei prodotti di
una generica equazione chimica
A +
B
C
+
D
la velocità di reazione si scrive:
d[A]
v= - ________
dt
d[B]
v= - ________
dt
d[C]
v= ________
dt
d[D]
v= ________
dt
Andamento di una reazione ipotetica
[A]
[A0]
d[A]
A
d[A]
dt
B
La velocità è:
v
d[A]
dt
v k[A]
Quindi:
dt
t
d[A]
k[A]
dt
[B]
d[B]
dt
A
dt
t
d[A]
A [A] t kdt
0
0
d[B]
t
d[A]
kdt
[A]
ln
[A]
kt
[A 0 ]
[A] [A 0 ]e kt
Tempo di dimezzamento
[A]
A
[A0]
B
La velocità è:
1/2[A0]
v
d[A]
dt
v k[A]
[A] [A 0 ]e kt
t1/2
t
Tempo di dimezzamento t1/2
ln
Quando [A] = 1/2[A0]
1/2[A 0 ]
1
kt1/2 ln
[A 0 ]
2
ln2 0.693
t1/2
k
k
Teoria delle collisioni
La reazione avviene quando le molecole collidono.
Non tutte le collisioni sono efficaci, infatti devono soddisfare ad alcuni requisiti:
- giusta orientazione delle molecole
- energia cinetica sufficiente per rompere i legami chimici
Molecole semplici e sferiche reagiscono meglio di molecole complesse e con forme complicata
(effetto sterico).
La velocità di reazione dipende dal numero di collisioni efficaci, quindi dalle concentrazioni
delle molecole e quindi dei reagenti.
per la reazione generica:
A +
B
C
v = k[A][B]
+
D
Teoria delle collisioni
H2O + CO2
Numero di molecole
O
C
H2CO3
O
C
O
O
T1
Ec =
1
mV2
2
Velocità
A +
B
C
v = k[A][B]
k = costante di velocità
Diagramma della coordinata di reazione per una
reazione chimica ENERGIA LIBERA ED
ENERGIA DI ATTIVAZIONE
Energia di attivazione
minima quantità di energia
necessaria per superare la
barriera tra reagenti e prodotti
e quindi per fare avvenire la
reazione
Energia libera, G
Stato di transizione ( ‡ )
G‡
A
B
G‡
B
G°
A
Stato
basale
A
B
Stato
basale
Coordinata di reazione
k Ae
- G‡
RT
A = fattore di frequenza
Reazioni favorite e sfavorite ed
ENERGIA DI ATTIVAZIONE
Energia di attivazione
reazione diretta
Energia libera, G
Stato di transizione ( ‡ )
Gd‡
A
razione inversa
B
Gi‡
B
G°
A
Stato
basale
A
B
Stato
basale
Coordinata di reazione
k d Ad e
k i Aie
- G d‡
RT
- G i‡
RT
Numero di molecole
La velocità di reazione dipende dalla temperatura
T1
T2
Ec =
Velocità
Ec = G‡
1
mV2
2
Equilibrio chimico
aA + bB
vd = kd [A]a [B]b
All’equilibrio si ha:
cC + dD
vi = ki [C]c [D]d
vd = vi
kd [A]a [B]b = ki [C]c [D]d
k d [C]c [D]d
K eq
a
b
k i [A] [B]
Legge di azione di massa
Principio di Le Chatelier:
Quando l’equilibrio di un sistema viene variato, il sistema reagisce
in modo da annullare la variazione e ristabilire l’equilibrio
aA + bB
[C]c [D]d
Q
[A]a [B] b
cC + dD
[C]c [D]d
K eq
[A]a [B] b
Relazioni tra costante di equilibrio e
energia libera di una reazione
k d Ad e
- G d‡
RT
k i Aie
- G d‡
RT
k d Ade
K eq
e
‡
-G i
ki
A i e RT
- G
ln K eq
RT
-G d‡ G i‡
RT
- G i‡
RT
e
-G
RT
G RT ln K eq
Relazione termodinamica tra
Energia libera, Entalpia ed Entropia
In un processo termodinamico
G = H - TS
G < O
Processo spontaneo
G > O
Processo non spontaneo
G = O
Processo all’equilibrio
H < O
Processo esotermico
H > O
Processo endotermico
Significato del valore del G e di Ke
G (kJ mol-1)
Ke
-200
-100
-50
-10
-1.0
1
10
50
100
200
1,1 x 1035
3,3 x 1017
5,8 x 108
5,6 x 10
1,5
6,7 x 10-1
1,8 x 10-2
1,7 x 10-9
3 x 10-18
9,1 x 10-36
significato
reazione quantitativa
più prodotti che reagenti
più reagenti che prodotti
la reazione non avviene