BIOENERGETICA
pag. 1
ATP E ADP
I LEGAMI “ALTAMENTE ENERGETICI”
O
O
O
Adenina - Ribosio – O – P – O – P – O – P – O-
˜
O-
˜
O-
ATP Mg 2+
OMg 2+
O
O
Adenina - Ribosio – O – P – O – P –
˜
O-
OMg 2+
O-
ADP Mg 2+
Nei composti “altamente energetici”
l’idrolisi causa nei prodotti:
• aumento di forme di risonanza
• diminuzione di tensione
elettrostatica
pag. 2
I COMPOSTI “ALTAMENTE ENERGETICI”
Un composto è definito “altamente energetico” quando contiene legami con
energia libera di idrolisi superiore a 5000 cal /mole (G’° <
- 5000 cal/mole)
idrolisi ortofosforica
Mg 2+ ATP 4- Mg 2+ ADP 3- + Pi + H+
G’° = - 7300 cal/mole
idrolisi pirofosforica
Mg 2+ ATP 4- Mg 2+ AMP 2- + PPi
PPi 2Pi
(enzima pirofosfatasi)
G’° = - 7300 cal/mole
G’° = - 8000 cal/mole
ADP AMP + Pi
G’° = - 7300 cal/mole
AMP adenosina + Pi
G’° = - 3400 cal/mole
Il G’° di idrolisi di ATP pari a –7300 cal/mole è calcolato a pH 7, 25°C, forza
ionica 0.2, Mg 2+ 1mM
pag. 3
G , G°
ΔG = ΔG˚ + RT ln Q
Q: quoziente di reazione
A+B
Q=
All’equilibrio:
C+D
[C] [D]
[A] [B]
ΔG = 0
Q = Keq
ΔG˚ = - RT ln Keq
Autore: Professoressa Carla Bovina
pag. 4
IL TRASFERIMENTO DI GRUPPO
Le reazioni enzimatiche in cui interviene ATP non sono usualmente
idrolisi in cui H2O distacca Pi oppure PPi ma sono trasferimenti di
gruppi quali
ortofosfato (Pi) e adenilato (AMP)
su di un residuo aminoacidico di un enzima oppure su di un substrato,
facendone così aumentare il contenuto in energia libera.
Eccezionalmente alcuni processi utilizzano invece l’idrolisi di ATP.
Esempi:
• rifornimento di energia necessaria per il cambio conformazionale di
una proteina
• rifornimento di energia necessaria nel processo di contrazione
muscolare
• dispersione di calore per la termoregolazione
pag. 5
ENERGIE LIBERE DI IDROLISI
E POTENZIALI
DI TRASFERIMENTO DI GRUPPO
prodotti di idrolisi
G’° cal/mole
PEP
piruvato + Pi
-14.800
14,8
1,3 BPG
3-P glicerato + Pi
-13.000
13,0
Succinil-CoA
succinato + CoA
-10.400
10,4
Creatina-P
creatina + Pi
-10.300
10,3
ATP4-
AMP 2- + PPi 3-
-8.900
8,9
Acetil-CoA
acetato + CoA
-8.400
8,4
ATP 4-
ADP3- + Pi
-8.200
8,2
PPi
2 Pi
-8.000
Mg ATP 2-
Mg ADP- + Pi
-5.700
5,7
Glucoso-1-P
glucoso + Pi
-5.000
5,0
Glucoso-6-P
glucoso + Pi
-3.300
3,0
AMP 2-
adenosina + Pi
-2.300
2,0
potenziale
8,0
pag. 6
LE REAZIONI ACCOPPIATE
Le reazioni di sintesi di molecole nelle cellule sono endoergoniche e richiedono
energia per avvenire. Il G’° di queste reazioni è positivo e tali reazioni, quindi
non possono avvenire se non sono “accoppiate” a reazioni esoergoniche che
liberano energia.
“L’accoppiamento” avviene grazie alla presenza di un composto intermedio
comune.
GLUCOSO + Pi GLUCOSO 6-P + H2O
reazione parziale endoergonica
G’° = + 3300 cal/mole
ATP + H2O ADP + Pi
reazione parziale esoergonica
G’° = - 7300 cal/mole
GLUCOSO + ATP GLUCOSO 6-P + ADP
reazione globale esoergonica
G’° = - 4000 cal/mole
L’intermedio comune è Pi
I G’° sono di segno opposto ma non di valore assoluto identico in modo che la
reazione globale accoppiata risulti esoergonica.
pag. 7
LO STATO STAZIONARIO
In un sistema chiuso l’equilibrio è statico
In un sistema aperto l’equilibrio è dinamico = stato stazionario
Per lo “stato di benessere” nella cellula [ATP]/[ADP][Pi] sono in stato stazionario
Esempi:
[ATP]
[ADP]
[Pi]
Eritrociti
1,35
0,20
0.47
Muscoli
3,00
0,50
1.00
pag. 8
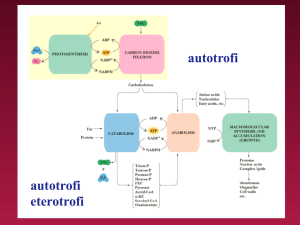
ATP MEDIATORE ENERGETICO CELLULARE:
IMPORTANZA DELLE REAZIONI ACCOPPIATE
La concentrazione di ATP nelle cellule viene mantenuta relativamente
costante attraverso lo stato stazionario dei sistemi che lo producono e di
quelli che lo utilizzano.
NH3
ATP
CO2
ENERGIA
LIBERA
H2O
CATABOLISMO
1.
2.
3.
4.
Biosintesi, attivazione
Contrazione e motilità
Trasporto attivo: H+, Na+, K+, Ca2+
Trasferimento di informazione genetica
O2
SOSTANZE
COMBUSTIBILI
ADP + Pi
La sintesi di ATP da ADP + Pi è una reazione endoergonica:
G’° = + 12.000 cal/mole
pag. 9
LA PRODUZIONE
DELL’ENERGIA CELLULARE
Per attuare la reazione di sintesi di ATP (endoergonica)
ADP + Pi ATP
Si può ottenere energia da:
- la luce solare
- reazioni di ossidazione delle sostanze organiche nutrienti
In ogni processo sono sempre coinvolte reazioni di ossido-riduzione
(esoergoniche).
Il meccanismo dell’accoppiamento (intermedi in comune) delle reazioni endo- ed
esoergoniche conduce alla sintesi dell’ATP.
I processi biochimici relativi sono:
- la fotosintesi clorofilliana (cloroplasti)
- la catena respiratoria (mitocondri)
- la fosforilazione ossidativa (mitocondri)
- la fosforilazione “a livello del substrato” (ad esempio PEP nella glicolisi)
pag. 10
CHIMICA E BIOCHIMICA
Reazioni chimiche
Reazioni biochimiche
Termodinamica chimica
Termodinamica biochimica
Perché c’è la necessità di distinguerle?
Le molecole coinvolte nelle reazioni dei sistemi
biologici (reazioni biochimiche) sono poli-anioni
Ciò implica che i reagenti delle reazioni biochimiche
consistano di vari addotti in equilibrio con acidi di Lewis
quali H+, Mg2+, ecc.
Di conseguenza ogni reazione biochimica definisce
un sistema complesso (multi-equilibrio) di reazioni
chimiche
Leganti
Cationi
Na+
ATP4K+
ADP3PO4
3-
H+
Mg2+
Reazioni chimiche e biochimiche
Ad ogni reazione biochimica sono associate una serie
di reazioni chimiche
Le specie che prendono parte alle reazioni chimiche
associate alla reazione biochimica vengono chiamati:
PSEUDOISOMERI
PSEUDOISOMERI
ATP
PSEUDOISOMERI
ADP
PSEUDOISOMERI
Pi
Reazioni chimiche e biochimiche
REAZIONI CHIMICHE
ATP4− + H2O
ADP3− + PO43− + 2H+
MgATP2− + H2O
MgADP− + H2PO4−
REAZIONE BIOCHIMICA
ATP + H2O
ADP + Pi
K’ATPhyd =
[SATP]
[SADP] [SPi]
[ATP4-]
K ATPhyd =
[ADP3-] [HPO42-] [H+]
SATP = ATP4- + HATP3- + H2ATP2- +…….MgATP2- +… MgHATP- +……NaATP3- + ……..KATP3- + …….
SADP = ADP3- + HADP2- + H2ADP- +…….MgADP- + MgHADP +……NaADP2- + ……..KADP2- + ………
SPi = PO43- + HPO3- + ……….MgPO4- + ……..MgHPO4 + …….NaPO42- + ……….KPO42- + ……………
VARIAZIONE DELL’ ENERGIA LIBERA IN UNA REAZIONE CHIMICA
MgATP2− + H2O
MgADP− + H2PO4−
[MgADP−]
ΔG = ΔG 0 + RT ln Q
Q=
[H2PO4−]
[MgATP2− ]
VARIAZIONE DELL’ ENERGIA LIBERA IN UNA REAZIONE BIOCHIMICA
ATP + H2O
ADP + Pi
[ADP]
ΔG′ = ΔG′ 0 + RT ln Q′
Q′ =
[Pi]
[ATP]
ATP + H2O → ADP + Pi
ΔG’˚ = −30.5 kJ/mol (−7.3 kcal/mol)
Variazione di energia libera standard G’0
In condizioni considerate standard da un punto di
vista biochimico (temperatura di 25°C (298K), pH=7,
concentrazione dei reagenti e dei prodotti 1M
concentrazione dell’acqua 55.5M) si definisce la
variazione di energia libera standard G’0
ΔG’˚ = −30.5 kJ/mol (−7.3 kcal/mol)
[S ADP ][S Pi ]
= G ' + RT ln
G'
ATP hyd
[S ATP ]
G°’ = F { pH, pMg }
Reazioni chimiche e
biochimiche
REAZIONI CHIMICHE
ATP4− + H2O
ADP3− + PO43− + 2H+
MgATP2− + H2O
MgADP− + H2PO4−
G1
G2
REAZIONE BIOCHIMICA
ATP + H2O
ADP + Pi
G’
Nei sistemi biologici per calcolare la variazione di energia libera dei vari processi
cellulari (sintesi, lavoro meccanico e trasporto attivo) si utilizza solitamente il ΔG′
della reazione di idrolisi di ATP secondo la seguente equazione:
[ ADP ][ Pi ]
'
'
GATP-hyd
GATP-hyd
RT ln
[ ATP ]
Tuttavia, è il complesso MgATP2- la specie enzimaticamente attiva, e quindi,
solo l’energia libera di idriolisi di questo pseudoisomero è rilevante nel descrivere
lo stato energetico intracellulare secondo la reazione chimica:
La cui corrispondente energia libera di idrolisi è data dalla seguente equazione:
K K'
Q Q'
ΔGMgATP2- ΔG’ATP-hydr
ΔGMgATP2- ΔG’ATP-hydr
ΔG ΔG’
Implicazioni
applicative
Implicazioni
concettuali
Implicazioni
“filosofiche”
Implicazioni applicative
Una conseguenza significativa di tale
proprietà è che si può quantificare la
variazione di energia libera di ogni
reazione enzimatica anche se non si
conosce quale specie chimica è substrato
dell’enzima
Implicazioni concettuali
Una sostanziale parte della
termodinamica chimica e biochimica,
prima trattate separatamente, può essere
ora unificata in un singolo sistema
concettuale
Implicazioni “filosofiche”
Alcune delle proprietà termodinamiche
locali di un sistema biologico coincidono
con quelle globali
Per l’energia libera: locale e globale non
sono antonimi
ovvero
la parte è uguale al tutto