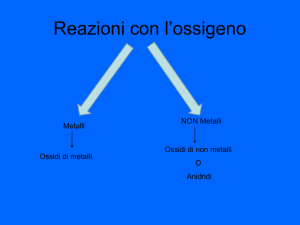
GLI OSSIDI
Classi 2^ E 2^ F- DOCENTE: LOI ANNALISA
SONO COMPOSTI BINARI FORMATI DALLA COMBINAZIONE TRA UN METALLO E L’OSSIGENO
L’OSSIDO, DAL PUNTO DI VISTA ELETTRONICO PUO’ ESSERE CONSIDERATO UN COMPOSTO
FRA L’OSSIGENO E UN ELEMENTO IN CUI IL LEGAME SIA PREVALENTEMENTE IONICO.
Vecchia nomenclatura (1)
Se il metallo ha un’unica valenza si dirà ossido di……
Se il metallo ha due valenze l’ossido che si ottiene utilizzando la valenza minore prende la desinenza
–OSO l’ossido che si ottiene utilizzando la valenza maggiore prende la desinenza –ICO.
LaO ossido di lantanio
Fe2O3 ossido ferrico
TaO ossido di tallio
FeO
ossido ferroso
K2O ossido di potassio
Cu2O ossido rameoso
Cs2O ossido di cesio
CuO ossido rameico
MgO ossido di magnesio
PbO2 ossido piombico
Vecchia nomenclatura (2)
Esiste una nomenclatura nella quale il nome dell’ossido si costruisce in base alla valenza del metallo e al
rapporto fra questo e l’ossigeno.
Protossidi o emiossidi se il metallo è monovalente per cui in ogni molecola il rapporto fra gli atomi del
metallo e quello dell’ossigeno è di 2 a 1.
Na2O protossido o emiossido di sodio
K2O protossido o emiossido di potassio
Li2O protossido o emiossido di litio
Monossidi o ossidi propriamente detti, se il metallo è bivalente per cui ogni molecola risulta formata
da un atomo di metallo e uno di ossigeno.
CaO monossido di calcio
BaO monossido di bario
MgO monossido di magnesio
PbO monossido di piombo
Sesquiossidi, se il metallo è trivalente per cui in ogni molecola il rapporto fra metallo e ossigeno è 2 a 3.
Al2O3 sesquiossido di alluminio
Fe2O3 sesquiossido di ferro
Biossidi, se il metallo è tetravalente, per cui in ogni molecola si hanno un atomo di metallo e due di
ossigeno.
PbO2 biossido di piombo
OsO2 biossido di osmio
Uno stesso ossido può chiamarsi in modo diverso.
Cu2O ossido rameoso
protossido di rame
PbO2 ossido piombico
biossido di piombo
Al2O3 ossido di alluminio
sesquiossido di alluminio
Nomenclatura Jupac
La nomenclatura internazionale consiglia per gli ossidi dei nomi i quali indichino con prefissi greci la
quantità dei singoli componenti.
I prefissi utilizzati sono:
mono per 1
di per 2
tri per 3
tetra per 4
penta per 5
esa per 6
epta per 7
otta per otto
ennea per 9
deca per 10
Esempi di come dovrebbero essere chiamati gli ossidi con la nomenclatura Jupac.
Cu2O Monossido di dirame
Fe2O3 triossido di diferro
V2O5 pentossido di divanadio
FeO monossido di ferro
CONFRONTI FRA LE NOMENCLATURE
FORMULA
N2O
NO
NO2
FeO
Fe2O3
PbO2
Na2O
CaO
Cu2O
CuO
NiO
Ni2O3
VECCHIA NOM. (1)
Ossido
Ossido
Ossido
Ossido
Ossido
Ossido
Ossido
Ossido
Ossido
ferroso
ferrico
piombico
di sodio
di calcio
rameoso
rameico
nicheloso
nichelico
VECCHIA NOM. (2)
Protossido d’azoto
Monossido d’azoto
Biossido d’azoto
Monossido di ferro
Sesquiossido di ferro
Biossido di piombo
Protossido di sodio
Monossido di calcio
Protossido di rame
Monossido di rame
Monossido di nichel
Sesquiossido di nichel
NOM. jUPAC
Monossido di diazoto
Monossido d’azoto
diossido d’azoto
Monossido di ferro
Triossido di diferro
Biossido di piombo
Monossido di disodio
Monossido di calcio
Monossido di dirame
Monossido di rame
Monossido di nichel
Triossido di dinichel
LE ANIDRIDI
SONO COMPOSTI BINARI FORMATI DALLA COMBINAZIONE TRA UN NONMETALLO E
L’OSSIGENO
L’ANIDRIDE, DAL PUNTO DI VISTA ELETTRONICO PUO’ ESSERE CONSIDERATO UN COMPOSTO
FRA L’OSSIGENO E UN ELEMENTO IN CUI NEL LEGAME PREVALE IL CARATTERE COVALENTE.
Vecchia nomenclatura
Se il nonmetallo ha un’unica valenza l’anidride che si ottiene prenderà la desinenza -ICA……
Se il nonmetallo ha due valenze l’anidride che si ottiene utilizzando la valenza minore prende la
desinenza –OSO l’anidride che si ottiene utilizzando la valenza maggiore prende la desinenza –ICO.
B2O3 anidride borica
N2O3 anidride nitrosa
N2O5 anidride nitrica
Alcuni non metalli formano anidridi con più di due valenze, quando le valenze sono 4 le desinenze da
utilizzare saranno le seguenti:
valenza più piccola
seconda valenza
terza valenza
valenza più grande
IPO…….OSA
OSA
ICA
PER….… ICA
CLORO
1 anidride ipoclorosa Cl2O
3anidride clorosa Cl2O3
5 anidride clorica Cl2O5
7 anidride perclorica Cl2O7
MANGANESE
4 anidride manganosa MnO2
6 anidride manganica Mn2O3
7 anidride permanganica Mn2O7
IODIO
1 anidride ipoiodosa I2O
5 anidride iodica I2O5
7 anidride periodica I2O7
BROMO
1 anidride ipobromosa Br2O
3 anidride bromosa Br2O3
5 anidride bromica Br2O5
7 anidride perbromica Br2O7
La nomenclatura Jupac attribuisce il nome alle anidridi con gli stessi criteri degli ossidi.
Es. Cl2O anidride ipoclorosa con la vecchia nomenclatura con la Jupac monossido di dicloro.
CONFRONTI FRA LE NOMENCLATURE
FORMULA
Cl2O7
MnO2
N2O3
N2O5
CO2
P2O3
P2O5
Mn2O7
VECCHIA NOMENCLATURA
Anidride perclorica
anidride manganosa
Anidride nitrosa
Anidride nitrica
Anidride carbonica
Anidride fosforosa
Anidride fosforica
Anidride permanganica
NOMENCLATURA JUPAC
Eptossido di dicloro
Biossido di dimanganese
Triossido di diazoto
Pentossido di diazoto
Biossido di carbonio
Triossido di difosforo
Pentossido di difosforo
Eptossido di dimanganese
GLI OSSOACIDI
Sono composti ternari, derivano dalla combinazione di una anidride con l’acqua. Hanno lo stesso nome
dell’anidride dalla quale derivano volto al maschile.
Cl2O7 HClO4
N2O3 HNO2
N2O5 HNO3
CO2
H2CO3
P2O5 HPO3
Alcune anidridi in cui il non metallo ha valenza pari possono sommare 1 o 2 molecole d’acqua e generare
due ossiacidi che si distinguono con i prefissi meta e orto.
SiO2 + H2O H2SiO3 acido metasilicico
SiO2 + 2H2O H2SiO4 acido ortosilicico
Altre in cui la valenza del nonmetallo è dispari può sommare 1 o 3 molecole di acqua e generare due
ossiacidi che si distinguono con i prefissi meta e orto.
B2O3 + H2O 2HBO2
acido metaborico
B2O3 + 3H2O 2H3BO3 acido ortoborico
Se da due molecole di ossiacido si sottrae una molecola d’acqua l’acido ottenuto prende il prefisso di
piro.
ES.
2H3PO4 – H2O H4P2O7
acido pirofosforico
2H2SO4 – H2O H2S2O7 acido pirosolforico
I nomi adoperati dalla nomenclatura Jupac segue la regola generale di indicare il numero degli atomi di
ossigeno, il nome del non metallo e utilizzare la desinenza ICO e mettendo dopo tra le parentesi il
numero romano che indica la valenza del non metallo.
H2MnO3 acido triossomanganico (IV)
H2MnO4 acido tetraossomanganico (VI)
HNO3 acido triossoinitrico (V)
HNO2 acido diossonitrico (III)
CONFRONTI FRA LE NOMENCLATURE
FORMULA
H2SO4
H2SO3
H3PO4
HClO3
HNO3
HClO
VECCHIA NOMENCLATURA
Acido solforico
Acido solforoso
Acido ortofosforica
Acido clorico
Acido nitrico
Acido ipocloroso
NOMENCLATURA JUPAC
Acido tetraossosolforico (VI)
Acido triossosolforico (IV)
Acido tetraossofosforico (V)
Acido triossoclorico (V)
Acido triossonitrico (V)
Acido ossoclorico (I)
GLI IDROSSIDI
Sono composti ternari sono detti anche basi o idrati nelle cui molecole figurano un metallo e il gruppo
-OH detto ossidrile.
Dal punto di vista elettronico l’idrossido si può definire un composto fra H, O e un elemento metallico
in cui il legame fra O e l’elemento è prevalentemente ionico, mentre quello fra H e O è prevalentemente
covalente.
Sono composti ternari, derivano dalla combinazione di una ossido con l’acqua. Hanno lo stesso nome
dell’ossido dal quale derivano volto al maschile.
ES.
NaOH idrossido di sodio
Ca(OH)2 idrossido di calcio
Al(OH)3 idrossido di alluminio
Cu(OH)2 idrossido rameico
Pb(OH)2 idrossido piomboso
Pb(OH)4 idrossido piombico
I nomi adoperati dalla nomenclatura Jupac segue la regola generale di indicare il numero dei
raggruppamenti OH, (idrosso) e poi il nome del metallo.
ES.
Pb(OH)4 tetraidrossido di piombo
CuOH
monoidrossido di rame
Mn(OH)4 tetraidrossido di manganese
CONFRONTI FRA LE NOMENCLATURE
FORMULA
Al(OH)3
Pb(OH)2
KOH
VECCHIA NOMENCLATURA
Idrossido di alluminio
Idrossido piomboso
Idrossido di potassio
NOMENCLATURA JUPAC
Triidrossido di alluminio
Diidrossido di piombo
Monoidrossido di potassio
MANGANESE
(metallico) +2 MnO ossido manganoso monossido di manganese
(anfotero) +4 MnO2 anidride manganosa o ossido manganico biossido di manganese
(non metallico) +6 MnO3 anidride manganica triossido di manganese
(non metallico) +7 Mn2O7 anidride permanganica Eptossido di dimanganese
MnO ossido manganoso Mn(OH)2 idrossido manganoso
MnO2 ossido manganico Mn(OH)4 idrossido manganico
MnO2 anidride manganosa H2MnO3 acido manganoso
MnO3 anidride manganica H2MnO4 acido manganico
Mn2O7 anidride permanganica HMnO4 acido permanganico
CROMO
(metallico) +2 CrO ossido cromoso monossido di cromo
(anfotero) +3 Cr2O3 ossido cromico o anidride cromosa triossido di dicromo
(non metallico) +6 CrO3 anidride cromica triossido di cromo
CrO ossido cromoso Cr(OH)2 idrossido cromoso
Cr2O3 ossido cromico Cr(OH)3 idrossido cromico
Cr2O3 anidride cromosaHCrO2 acido cromoso
CrO3 anidride cromica H2CrO4 acido cromico
Esiste un acido dato dall’unione di 2 molecole di Cr 2O3 e una molecola di H2O è H2Cr2O7 acido dicromico
AZOTO
-3 NH3 idruro d’ammonio
(metallico) +1 N2O protossido d’azoto
(metallico) +2 NO monossido( o ossido) d’azoto
(non metallico) +3 N2O3 anidride nitrosa
(metallico) +4 NO2 biossido d’azoto
(non metallico) +5 N2O5 anidride nitrica
CARBONIO
(metallico) +2 CO monossido di carbonio
(non metallico) +4 CO2 anidride carbonica
STAGNO
(anfotero) +2 SnO ossido stannoso o anidride stannosa
(anfotero) +4 SnO2 ossido stannico o anidride stannica
SnO2 + 1H2O = H2SnO3 acido metastannico
SnO2 + 2H2O = H2SnO3 acido ortostannico
FOSFORO
-3 PH3 idruro di fosforo
(non metallico) +1 H3PO2 acido fosforoso (non esiste la corrispondente anidride)
(non metallico) +3 P2O3 anidride fosforosa
P2O3+ 3H2O = H3PO3 acido fosforoso
(non metallico) +5 P2O5 anidride fosforica
P2O5 + 1H2O = HPO3 acido metafosforico
P2O5+ 2H2O = H4P2O3 acido pirofosforico
P2O5+ 3H2O = H3PO4 acido ortofosforico
ARSENICO
(non metallico) +3 As2O3 anidride arseniosa
As2O3 + 1H2O = HAsO2 acido metarsenioso
As2O3 + 3H2O = H3AsO3 acido ortoarsenioso
(non metallico) +5 As2O5anidride arseniosa
As2O5 + 1H2O = HAsO3 acido metarsenico
As2O5+ 2H2O = H4As2O7 acido piroarsenico
As2O5+ 3H2O = H3AsO4 acido ortoarsenico
BORO
(anfotero) +3 B2O3 ossido borico o anidride borica
B2O3 + 1H2O = HBO2 acido metaborico
B2O3+ 3H2O = H3BO3 acido ortoborico
ALLUMINIO
(anfotero) +3 Al2O3 ossido alluminico o anidride alluminica
Al2O3 + 1H2O = HAlO2 acido metaalluminico
Al2O3+ 3H2O = H3AlO3 acido ortoalluminico oppure Al(OH)3 idrossido di alluminio
SILICIO
(non metallo) +4 SiO2 anidride silicica
SiO2 + 1H2O = H2SiO3 acido metasilicico
SiO2 + 2H2O = H4SiO4 acido ortosilicico
IDRACIDI
Sono composti binari tra un nonmetallo del VII gruppo più lo zolfo con l’idrogeno.
Vecchia nomenclatura
Si scrive la parola acido e si fa seguire il nome del nonmetallo la desinenza idrico.
ES.
HCl acido cloridrico
HBr acido bromidrico
H2S acido solfidrico
Nella nomenclatura jupac si scrive il nome del nonmetallo con il suffisso uro e il prefisso che numero
degli atomi di idrogeno dell’acido davanti alla parola idrogeno.
ES.
HBr bromuro di idrogeno
H2S solfuro di diidrogeno
IDRURI
Sono composti binari tra l’idrogeno e un non metallo (esclusi quelli del VII gruppo) o tra l’idrogeno e un
metallo.
Idruri ionici (o metallici) sono dati dall’idrogeno + metallo
Idruri covalenti sono dati dall’idrogeno + nonmetallo
Vecchia nomenclatura
Si scrive la dicitura idruro di…… e segue il nome dell’elemento.
ES.
NH3 idruro di azoto
AlH3 idruro di alluminio
NaH idruro di sodio
Jupac
Si scrive il prefisso che indica il numero degli atomi di idrogeno presenti seguito dalla dicitura idruro di
e il prefisso che indica il numero di atomi dell’altro elemento seguito dal nome.
NH3 triidruro di azoto
CaH2 diidruro di calcio
SALI
SALI DERIVATI DAGLI ACIDI OSSIGENATI
(NEUTRI)
Se la desinenza dell’acido di provenienza è ico il sale avrà la desinenza ato
ES.
Na2SO4 proviene dell’acido solforico sarà il solfato di sodio
Ca3(PO4)2 proviene dall’acido ortofosforico sarà l’ortofosfato di calcio
Se la desinenza dell’acido di provenienza è oso il sale avrà la desinenza ito.
ES.
NaSO3 Proviene all’acido solforoso è il solfito di sodio.
NaNO2 proviene dall’acido nitroso sarà il nitrito di sodio
Il nome adoperato dalla nomenclatura Jupac segue la regola generale di indicare il numero degli atomi
di ossigeno, il nome del non metallo e utilizzare la desinenza ATO e mettendo dopo tra le parentesi il
numero romano che indica la valenza del non metallo, seguito dal nome del metallo e dalla sua valenza in
numero romano e fra parentesi.
SALI DERIVATI DAGLI ACIDI OSSIGENATI
(ACIDI)
Si fa il nome come nel caso dei sali neutri.
Nel caso che il sale derivi da un acido bivalente davanti al nome del nonmetallo va messo il prefisso bi.
ES:
NaHSO4 bisolfato di sodio oppure anche solfato acido di sodio
NaHSO3 bisolfito di sodio oppure anche solfito acido di sodio
Ca(HCO3)2 bicarbonato di calcio oppure carbonato acido di calcio
Nel caso di sali di acidi trivalenti si indica il nome del nonmetallo con il suffisso ato seguito dal prefisso
che indica il numero di atomi di idrogeno tolti e dal nome del metallo.
ES.
Ca(H2PO4)2 fosfato monocalcico
Ca2HPO4
fosfato dicalcico
Ca3(PO4)2 fosfato tricalcico
Il nome adoperato dalla nomenclatura Jupac segue la regola generale di indicare prefisso indicante il
numero degli atomi di ossigeno seguito poi dal termine ossoidrogen e il nome del non metallo utilizzare
la desinenza ATO e mettendo dopo tra le parentesi il numero romano che indica la valenza del non
metallo, seguito dal nome del metallo e dalla sua valenza in numero romano e fra parentesi.
ES:
Ca(HSO4)2 tetraossoidrogensolfato (V) di calcio (II)
SALI DERIVANTI DA ACIDI NON OSSIGENATI (NEUTRI)
Nei sali derivati dagli idracidi il suffisso idrico dell’acido diventa uro seguito dal nome del nonmetallo.
ES:
NaCl deriva dall’acido cloridrico sarà il cloruro di sodio
Nella jupac si scrive il prefisso che indica il numero degli atomi delnonmetallo seguito dal nome
dell’elemento con il suffisso uro e dalla parola idrogeno preceduta dal prefisso indicante il numero di
idrogeni presenti nella formula.
ES.
Na2S solfuro di disodio
CaS2 disolfuro di calcio
Al2S3 trisolfuro di dialluminio
SALI DERIVANTI DA ACIDI NON OSSIGENATI (ACIDI)
Vecchia nomenclatura
Si fa il nome come nel caso dei sali neutri, solamente che davanti al nome del nonmetallo va messo il
prefisso bi.
Ca(HS)2 bisolfuro di calcio
NaHS
bisolfuro di sodio
Nomenclatura Jupac
Nella jupac si scrive il prefisso che indica il numero dei residui acidi seguito dalla parola idrogen e dal
nome dell’elemento con il suffisso uro e dalla parola idrogeno preceduta dal prefisso indicante il numero
di idrogeni presenti nella formula.
Ca(HS)2 diidrogensolfuro di calcio
NaHS
idrogensolfuro di sodio