Classe:
2A (TUR)
Materia:
Scienze integrate-Chimica
ANNO SCOLASTICO 2015 – 2016
Piano di lavoro individuale
Docente: De Dominici Maria
Situazione di partenza della classe
La situazione di partenza della classe, che ho quest’anno per la prima volta, è stata valutata mediante colloqui che hanno avuto una
doppia funzione: quella di valutare le conoscenze di base degli studenti, e quella di fare la loro conoscenza. La prima impressione è
stata buona, la classe appare nel complesso collaborativa, motivata e ben disposta allo studio della materia. Le prime valutazioni
appaiono abbastanza soddisfacenti.
Obiettivi educativi e didattici della disciplina (in riferimento alle linee-guida ministeriali)
Saper osservare descrivere, analizzare fenomeni appartenenti alla realtà naturale e artificiale e riconoscere, nelle sue varie forme, i
concetti di sistema e complessità.
Analizzare qualitativamente e quantitativamente fenomeni legati alle trasformazioni di energia a partire dall’esperienza.
Essere consapevole delle potenzialità delle tecnologie rispetto al contesto culturale e sociale in cui sono applicate.
All’interno di queste competenze generali vengono messe in particolare rilievo alcune finalità didattiche e formative:
attenzione al metodo scientifico inteso come insieme di ”strategie di indagine, di procedure sperimentali e di linguaggi specifici”;
la maturazione nei giovani di una “visione cinetica” sul mondo della scienza e della tecnologia, in particolare per quanto riguarda i
temi connessi alla “salvaguardia dell’ambiente”;
la necessità di operare in modo che le competenze di ambito scientifico- tecnologico divengano” strumenti per l’esercizio effettivo
dei diritti di cittadinanza”, consistenti nella capacità di operare scelte autonome e consapevoli nei diversi ambiti della vita
culturale, sociale e produttiva.
Competenze:
1. Osservare, descrivere e analizzare fenomeni appartenenti alla realtà naturale e artificiale e riconoscere nelle varie forme i concetti di sistema e
di complessità.
2. Analizzare qualitativamente e quantitativamente fenomeni legati alle trasformazioni di energia a partire dall’esperienza.
3. Essere consapevole delle potenzialità e dei limiti delle tecnologie nel contesto culturale e sociale in cui vengono applicate.
4. Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l’ausilio di rappresentazioni grafiche.
5. Individuare le strategie appropriate per la soluzione di problemi.
Moduli – Tempi di svolgimento
Argomenti (conoscenze – contenuti)
Abilità
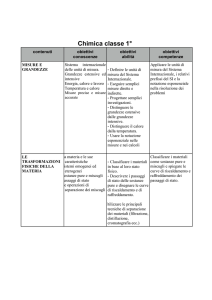
Introduzione alla chimica misure e grandezze.
Misura delle grandezze.
Il sistema internazionale delle unità di misura.
Alcune grandezze derivate: volume, forza, peso,
densità, energia, calore, pressione.
Significato della misura.
La notazione scientifica.
- Descrivere le fasi del metodo scientifico.
- Definire le grandezze fisiche.
- Definire le unità di misura del Sistema Internazionale.
- Distinguere le grandezze fondamentali dalle grandezze
derivate.
- Scrivere una misurazione con la notazione scientifica.
- Applicare le unità di misura del Sistema Internazionale.
- Applicare i prefissi dei multipli e dei sottomultipli alle unità
di misura del Sistema Internazionale.
- Distinguere le grandezze estensive dalle grandezze intensiv.e
- Definizione di volume .
- Distinguere la massa dal peso.
- Definire la densità.
- Convertire i kelvin in °C e viceversa.
- Distinguere il calore dalla temperatura.
- Convertire i joule in calorie e viceversa.
Trasformazioni fisiche della materia
Le sostanze pure e le miscele.
Stati di aggregazione e passaggi di stato.
Separazione dei componenti dei miscugli.
- Descrivere le proprietà dei solidi, dei liquidi e degli
aeriformi.
- Distinguere i gas dai vapori.
- Definire ogni termine indicante un cambiamento di stato.
- Definire le sostanze pure.
- Distinguere i miscugli omogenei da quelli eterogenei.
- Identificare il solvente e il soluto di una soluzione.
- Descrivere le curve di riscaldamento delle sostanze pure e
dei miscugli.
- Definire la sosta termica e il calore latente.
- - Spiegare il principio di funzionamento di ognuna delle
tecniche di separazione dei miscugli .
.
Comportamento dei gas e delle soluzioni
Le leggi dei gas.
Le soluzioni.
La tensione di vapore e le proprietà colligative.
.Risolvere semplici esercizi relativi alle trasformazioni dei
gas applicando le leggi di Boyle, di Charles e di GayLussac, l’equazione di stato dei gas.
Spiegare il fenomeno della dissoluzione a livello
particellare.
Riconoscere che nelle operazioni di mescolamento la
massa, a differenza del volume, si conserva.
Spiegare il concetto di concentrazione e applicare alcuni
modi per esprimerla.
Descrivere alcune proprietà fisiche di una soluzione
(temperature di ebollizione e di fusione, densità,
pressione osmotica) in relazione alle proprietà del
solvente e a quelle delle sostanze disciolte, ed eseguire
semplici problemi..
Trasformazioni chimiche della materia e leggi
che le governano.
Differenza tra trasformazioni fisiche e
trasformazioni chimiche.
Elementi e composti.
Elementi e tavola periodica.
Leggi della chimica e teoria atomica.
Atomi, molecole e formule chimiche.
La mole.
- Definire le reazioni chimiche
- Distinguere le trasformazioni chimiche della materia dalle
trasformazioni fisiche
- Identificare i reagenti e i prodotti di una reazione chimica
- Applicare la legge di conservazione della massa
- Spiegare la differenza tra elementi e composti
- Definire la legge delle proporzioni definite e costanti
- Applicare la legge delle proporzioni definite e costanti
- Enunciare i punti della teoria atomica di Dalton
- Definire la legge delle proporzioni multiple
- Applicare la legge delle proporzioni multiple alle reazioni
chimiche
-Calcolare la massa atomica e la massa molecolare, massa
molare.
-Usare la mole come unità di misura della quantità di
sostanza.
Struttura dell’atomo e tavola periodica.
Il modello di Thomson.
Le particelle fondamentali che costituiscono gli
atomi.
Il modello atomico di Rutherford.
Numero atomico , numero di massa e isotopi.
Modello di Bohr.
Modello atomico ad orbitali.
Costruzione della configurazione elettronica.
La Tavola periodica moderna.
- Enunciare le caratteristiche fisiche di protoni, neutroni ed
elettroni
- Descrivere i diversi modelli proposti della struttura
dell’atomo
- Distinguere il numero atomico dal numero di massa
- Scrivere con i simboli della chimica numero atomico e di
massa di un atomo
- Ricavare il numero di neutroni sapendo numero atomico e di
massa
- Definire gli isotopi
- Descrivere gli isotopi dell’idrogeno
- Descrivere la disposizione degli elettroni in livelli energetici
- Definire gli elettroni di valenza (esterni)
-Costruire la configurazione elettronica degli atomi.
- Ricavare il numero di elettroni di valenza (esterni) di un
atomo sapendo la sua posizione nella tavola periodica
- Spiegare il motivo per cui si forma un legame chimico
- Spiegare perché gli atomi tendono ad assumere la
configurazione elettronica dei gas nobili
-Descrivere le principali caratteristiche degli elementi di
ciascun gruppo della tavola periodica.
I legami chimici.
– Elettroni di valenza e regola dell’ottetto
– Il legame ionico
– Il legame covalente puro, polare, dativo.
– Sostanze polari e sostanze apolari
–Forze intermolecolari: il legame idrogeno.
-La geometria delle molecole.
- Definire il legame covalente
- Distinguere le molecole con legame covalente semplice,
doppio e triplo
- Distinguere le molecole con legame covalente puro dalle
molecole con legame covalente polare o dativo.
- Scrivere i legami covalenti con la simbologia della
chimica
- Spiegare come si forma un legame ionico
-Descrivere le proprietà del legame idrogeno dell’acqua.
Reazioni chimiche e nomenclatura dei composti. Generalità sulle reazioni chimiche.
Classificazioni delle reazioni chimiche.
Bilanciamento delle equazioni chimiche.
Composti chimici e reazioni di ossido-riduzione.
Nomenclatura dei composti chimici.
Saper classificare i diversi tipi di reazione chimica.
Scrivere e bilanciare correttamente una reazione chimica.
Calcolare il numero di ossidazione degli atomi di un
composto.
Saper eseguire semplici calcoli stechiometrici.
Utilizzare le formule dei composti per assegnare loro un
nome secondo le regole della nomenclatura tradizionale,
e IUPAC.
Acidi e basi in soluzione acquosa.
Generalità sugli acidi e sulle basi.
Definizione di acido-base di Arrhenius, Bronsted
e Lowry, di Lewis.
Il pH delle soluzioni.
Forza degli acidi e delle basi.
Indicatori di pH.
Differenziare le soluzioni acquose acide da quelle basiche.
Definire acidi e basi secondo la teoria di Arrhenius, di
Brønsted e Lowry e spiegare che cosa si intende per
coppia coniugata, di Lewis.
Scrivere l’equilibrio di autoionizzazione dell’acqua .
Definire la scala di pH e/o stabilire se una soluzione è
neutra, acida o basica in base a valori di pH
Valutare la forza di un acido o di una base conoscendo i
valori di Ka e di Kb
Spiegare che cosa è un sistema tampone .
La chimica del carbonio.
La chimica organica
-Descrivere come è possibile rappresentare sulla carta le
– Formule e nomi degli idrocarburi saturi
diverse strutture molecolari degli idrocarburi
evidenziando, in base al modello di legame covalente,
– Gli idrocarburi insaturi
analogie e differenze.
– Gli idrocarburi aromatici
-Spiegare che cosa si intende per isomeria e illustrare con
-I gruppi funzionali
esempi le diverse categorie di isomeri..
– Alcoli e fenoli, eteri, esteri
-Scrivere la formula e descrivere la struttura dei principali
– I composti del gruppo carbonilico e del gruppo gruppi funzionali e illustrare le proprietà chimiche e
fisiche delle corrispondenti classi di composti.
carbossilico, del gruppo amminico
Applicare le regole di nomenclatura IUPAC per assegnare
il nome a un composto organico e, viceversa, scriverne la
formula in base al nome.
Metodologia e strumenti didattici
Pur dando la preferenza alla lezione frontale, cercherò sempre, da un lato di stimolare l’interesse coinvolgendo gli alunni in osservazioni
della realtà quotidiana, che possano costituire spunto per immettersi in un singolo contenuto, con modelli noti con i quali far
comprendere meglio strutture o funzioni complesse, dall’altro di utilizzare curiosità o osservazioni spontanee degli alunni per
intraprendere anche percorsi laterali, rispetto alla linea conduttrice principale, ma non per questo meno utili se adeguatamente inseriti
nel processo formativo generale. Verranno utilizzati il testo in adozione, e gli appunti delle lezioni, inoltre, quando sarà possibile, si farà
ricorso all’uso di audiovisivi e multimediali, e all’uso di attività di laboratorio.
Attività di sostegno / recupero
Le attività di recupero saranno effettuate regolarmente: all’inizio della lezione, ricapitolando velocemente quanto detto in precedenza, e
chiarendo eventuali dubbi proposti dagli studenti, prima di ogni verifica, ed ogniqualvolta gli studenti ne faranno richiesta. Se sarà
necessario, il programma potrebbe essere bloccato per brevi periodi, per permettere agli studenti di recuperare le loro lacune,
proponendo eventualmente la costruzione di mappe concettuali di riepilogo. Se necessario, potrebbero essere istituiti sportelli didattici.
Modalità di verifica e criteri di valutazione
Le verifiche avranno lo scopo di:
verificare il raggiungimento delle competenze delle conoscenze delle abilità;
orientare l’azione didattica complessiva;
individuare interventi di recupero mirati nei confronti di alunni con particolare difficoltà.
Accanto alle tradizionali interrogazioni (che reputo molto importanti per valutare alcune capacità e per stimolare la produzione orale) e
alle verifiche scritte, terrò in considerazione, come elementi di valutazione, anche interventi brevi dal posto, che sono indice della
preparazione dell’alunno.
Le verifiche scritte valide per l’orale saranno di due tipi:
a stimolo chiuso e a risposta aperta: saranno formate da quesiti, possibilmente numerosi e con formulazione molto specifica, in
modo da prevedere una soluzione breve e con poche possibilità d’interpretazioni soggettive;
test a risposta chiusa, multipla e a completamento .
Per la valutazione verrà utilizzata la tabella allegata al POF, la gamma dei voti andrà dal 10 al 3.
Note. Probabilmente non sarà possibile trattare tutti gli argomenti indicati, dipenderà anche da come la classe sarà in grado di
assimilare i contenuti proposti, tuttavia, preferisco indicare più di quello che riuscirò a spiegare, perché, gli argomenti che non
compaiono nella programmazione non possono essere trattati.