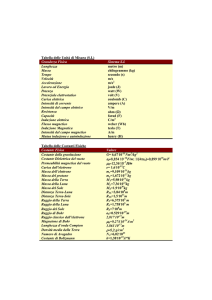
Fonti da studiare e da cui estrarre concetti
Dal libro “Le cinque più grandi idee della scienza”, grande idea n°1 pagg 37, 38, 39, 40
Effetto fotoelettrico dal libro
Affinamenti della teoria di Bohr pag 232-233-234
Spin, pagg. 234 – 238
Equazione di de Broglie
Equazione di Schrödinger
Orbitali atomici
Lettura seguente
Il modello di Bohr ricavato dall’idea e dalla formula di de Broglie
De Broglie introdusse il concetto di onde materiali. Così come le radiazioni luminose avevano un
duplice comportamento, ondulatorio e corpuscolare, anche gli elettroni e gli altri oggetti materiali,
secondo lo scienziato francese, dovevano comportarsi sia come corpuscolo sia come onda. La
formula che collega i due diversi aspetti della natura dell’elettrone è a pagina 243.
Se l’elettrone è un’onda di lunghezza data dalla formula di de Broglie, tale onda deve entrare un
numero intero di volte nell’orbita di circonferenza 2r, per poter essere stazionaria. In altre parole,
se il giro inizia con una cresta d’onda, deve terminare esattamente con la stessa fase di cresta,
altrimenti nel proseguire in avanti l’onda annullerebbe se stessa, trovandosi fuori fase o in contrasto
di fase nei giri successivi. Per dire che nella circonferenza può entrare solo un numero intero di
onde, basta la semplice formula:
2r = n
dove r è la distanza dell’orbita dal nucleo e è la distanza tra due creste.
Se al posto di sostituiamo il valore dato dall’equazione di de Broglie, otteniamo:
2r = n Error!
Da cui, dividendo tutto per 2, si ottiene r = Error!
Bohr non partì dalla formula di de Broglie, ma postulò direttamente la validità di quest’ultima,
equivalente a quella riportata a pag 230 del libro (mevr = nh/2) senza giustificare la ragione di
esistenza del numero intero (o numero quantico) n come abbiamo fatto qui e come poté essere fatto
dall’introduzione della teoria delle onde di materia di de Broglie nel 1925. Questa formula ci dice
già che non tutte le orbite saranno permesse, ma solo quelle che corrispondono a certe combinazioni
di raggio e velocità dell’elettrone. Per eliminare la velocità, dalla formula per trovare il raggio,
occorre utilizzare due leggi della fisica classica che forniscono la forza centripeta di un elettrone
(ora visto come particella orbitante) che ruota intorno al nucleo.
Per qualsiasi corpo ruotante (la Luna, un elettrone, ecc.) l’accelerazione centripeta è a = Error!.
Quindi, se la massa dell’elettrone è me , a tale accelerazione deve corrispondere la forza F = me·a =
me·Error!;
nel caso del sistema nucleo – elettrone, l’attrazione è sostenuta dalla forza di Coulomb tra nucleo ed
elettrone, F = Error!, dove e è la carica (negativa) dell’elettrone e (positiva) del protone.
Uguagliando le due diverse espressioni per la forza: Error! = me·Error! e semplificando
Error! = me·v2 , si ricava la velocità v = Error!.
Il valore di v così ottenuto si può sostituire ora nell’equazione precedente, ricavando:
r = Error!
2
Elevando tutto al quadrato si ha r = Error! , da cui, semplificando si ricavano i soli valori possibili
del raggio delle orbite di Bohr.
r(n) = n2 · Error!
Questo risultato coincide con quello riportato a pag 230 del libro, perché le costanti fisiche della
frazione, combinate tra loro, danno il valore 0,53·10-10 metri, coincidente col raggio dell’elettrone
dell’idrogeno nel suo stato fondamentale.
Per quanto riguarda l’energia, dobbiamo sommare l’energia potenziale elettrostatica, - Error! , e
2
quella cinetica, data da + Error! mev2= + Error! me·(Error!) = + Error! Error! .
La somma è pertanto Etot = - Error! + Error! Error! = - Error! Error! .
Sostituendo in questa formula il raggio dell’orbita si ricava
Etot = - Error! Error! = -Error! · Error!.
Quest’ultima formula coincide con quella del libro a pag. 231, se si calcola la frazione Error!che
risulta 21,79·10-19 J/atomo. Tale formula consentì a Bohr di calcolare l’energia dei livelli (n = 1, n =
2 ecc.) dell’atomo di idrogeno e quindi anche l’energia e la frequenza dei fotoni emessi nelle
transizioni elettroniche da un livello superiore n1 a un livello inferiore n2:
E (J) = 21,79·10-19·(Error! - Error!) = Error!= 3,289·10-15 s-1·(Error! - Error!)
Le frequenze così calcolate corrispondono esattamente a quelle presenti nello spettro a righe
dell’idrogeno atomico.
Quindi il modello di Bohr, o la teoria dell’elettrone come onda di de Broglie mescolate con altre
leggi della fisica classica, consentirono di “calcolare” esattamente le dimensioni dell’atomo di
idrogeno (circa 1,06 Å) e soprattutto le frequenze dello spettro di righe di questo elemento.
La semplice equazione di de Broglie, confermata da esperimenti di Davisson e Germer e di G.T.
Thomson (quest’ultimo figlio dello scienziato J.J. Thomson che aveva determinato il rapporto e/me
della particella elettrone) sempre nel 1925, costituì il punto di partenza per costruire la meccanica
quantistica ondulatoria di Schröedinger, la quale, oltre a permettere di spiegare come funzionano
altri atomi più complessi dell’idrogeno, compie meno mescolamenti con le leggi della fisica
classica.