Leggi di Gay-Lussac
Consideriamo una trasformazione che coinvolge un gas ideale a pressione costante (trasformazione
isobara). In altri appunti1 abbiamo visto che quando tariamo il nostro termometro a gas ideale e disegniamo
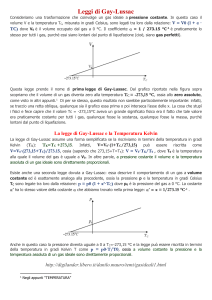
il grafico Temperatura-Volume (Grafico T-V), la retta di taratura intercetta l’asse delle T (cioè delle ascisse) al
valore T=-273,15 °C (vedi Figura1). Di per se stesso, questo risultato non sarebbe particolarmente
importante: infatti, se traccio una retta obliqua, qualunque sia il grafico essa prima o poi interseca l’asse delle
ascisse. La cosa che stupì i fisici e fece capire che il valore T = -273,15°C aveva un grande significato fisico
era il fatto che tale valore era praticamente costante per tutti i gas, qualunque fosse la sostanza, qualunque
fosse la massa, purché lontani dal punto di liquefazione.
Lo zero assoluto e la Temperatura Kelvin
Poiché tutti i gas ideali in una trasformazione isobara hanno lo zero del volume nel punto T=-273,15°C, la
cosa più semplice da fare è quella di spostare anche lo zero della temperatura al valore -273,15°C; in altre
parole, si definisce una seconda scala di temperatura che ha come valore zero non il punto di congelamento
dell’acqua, come la scala Celsius, ma il punto dove il volume di un gas ideale tenuto a pressione costante
raggiungerebbe il valore nullo. A questa scala fu dato il nome scala Kelvin o scala assoluta in onore al
grande fisico William Kelvin che nel 1848 per primo postulò su rigorose basi fisiche sia l’esistenza dello zero
assoluto che di una scala termometrica basata su di esso. Come secondo punto di calibrazione della scala
Kelvin fu dato il punto di congelamento dell’acqua, al quale fu assegnato il valore convenzionale di 273,15K; in
questo modo si faceva coincide l’intervallo T espresso in scala Kelvin con quello espresso in scala centigrada,
cioè si faceva in modo che una variazione di un certo numero di gradi Kelvin coincidesse con una variazione
dello stesso numero di gradi Celsius e viceversa.
Le leggi di Gay-Lussac
Il grafico T-V che ne viene fuori (vedi Figura1) permette di
trovare una rapida relazione che lega il volume di un gas
alla sua temperatura Kelvin: poiché tale grafico è una retta
passante per l’origine posso affermare che:
a pressione costante il volume e la temperatura
assoluta di un gas ideale sono proporzionali
VA/VB = TA/TB
(trasformazione isobara , T espressa in Kelvin)
prima legge di Gay-Lussac:
Figura 1
Come detto in classe, ottengo lo stesso identico valore di zero assoluto se modifico la pressione di un gas
variando la temperatura ma tenendo il volume costante (trasformazione isocora). In questo caso ottengo
un grafico Temperatura-Pressione come quello in Figura2
avente il valore dello zero assoluto uguale a quello della
trasformazione isobara (-273,15°C). Se uso la temperatura
Kelvin invece che quella Celsius faccio sì che la retta di
taratura passi per 0K e perciò posso affermare che:
a volume costante la pressione e la temperatura
assoluta di un gas ideale sono proporzionali
PA/PB = TA/TB
(trasformazione isocora , T espressa in Kelvin)
seconda legge di Gay-Lussac:
1
Negli appunti “TEMPERATURA”
Figura 2