Federica Testi, Silvia Papotti
Cl. 3^I
Chadwick
JAMES CHADWICK (1891 - 1974) James Chadwick naque nel Cheshire,
Inghilterra, il 20 ottobre 1891 da John Joseph Chadwick ed Anne Mary
Knowles.
Studiò alla High School di Manchester e successivamente all'università
della stessa città, per laurearsi alla "Honours School of Physics" nel 1911.
Passò i due anni successivi presso il laboratorio di fisica sotto la guida del professore Rutherford
occupandosi di vari studi relativi alla radioattività, ottenendo il diploma di dottorato nel 1913.
Nello stesso anno partì per Berlino dove lavorò nel Physikalisch Technische Reichsanstalt a
Charlottenburg sotto il professor H . Geiger.
Durante la I guerra mondiale venne internato nello Zivilgefangenenlager, a Ruhleben.
Al termine della guerra, nel 1919, ritornò in Inghilterra sia per accettare il Wollaston Studentship
all'università di Caius e di Gonville, a Cambridge, sia per riprendere gli studi sotto la guida di
Rutherford, che nel frattempo si era trasferito nel laboratorio di Cavendish, a Cambridge.
Rutherford era riuscito in quello stesso anno a provocare l'emissione di protoni da parte del
nucleo mediante bombardamento di atomi di azoto con particelle alfa, facendo sostanzialmente
la prima trasformazione nucleare artificiale.
A Cambridge, Chadwick aiutò Rutherford ad effettuare la trasmutazione di altri elementi leggeri
mediante bombardamento con particelle alfa e a compiere degli studi sulle proprietà e sulla
struttura dei nuclei atomici. Nel 1923 divenne assistente direttore di ricerca del Cadevish
Laboratory. Nel 1932, Chadwick dimostrò l'esistenza dei neutroni, particelle elementari prive di
carica elettrica.
Contrariamente ai nuclei dell'elio (raggi alfa), carichi, questa particella nel processo di
disintegrazione atomica non deve superare alcuna barriera elettrica ed è quindi capace di
penetrare in nuclei di elementi più pesanti.
Chadwick in questo modo spianò la strada verso la fissione dell'235U e verso la creazione della
bomba atomica.
Per questa importantissima scoperta ricevette la "Hughes Medal of the Royal Society" nel 1932 e
successivamente il premio Nobel per la fisica in 1935.
Rimase a
Cambridge fino al 1935, anno in cui fu scelto per sostituire Lione Jones alla cattedra di fisica
nell'università di Liverpool.
Dal 1943 al 1946 lavorò negli Stati Uniti per lo sviluppo della bomba atomica.
Tornato in Inghilterra, nel 1948, lasciò la fisica attiva e la cattedra a Liverpool.
Dal 1957 al 1962 fu membro dell'autorità dell'energia atomica del Regno Unito.
Molti
lavori di Chadwick sulla radioattvità e sui problemi ad essa correlati vennero da lui pubblicati in
collaborazione con Rutherford ed Ellis. E' inoltre coautore del libro "Radiations from Radioactive
substances" (1930).Oltre alla medaglia del Hughes (società reale) citata precedentemente, ha
ricevuto la Copley Medal nel 1950 e la medaglia del Franklin Institute, a Filadelfia nel 1951.
È membro onorario dell'istituto di fisica di diverse università straniere oltre ad aver ricevuto il
grado di dottore onorario dalle università di Reading, Dublino, Leeds, Oxford, Birmingham,
Montreal (McGill), Liverpool ed Edinburgh.
Nel 1925, sposò Aileen Stewart-Marrone a Liverpool dalla quale ebbe due figlie gemelle.
I suoi hobby includevano il giardinaggio e la pesca.
Sir James Chadwick morì il 24 luglio 1974.
Come già detto, nel 1932, egli, bombardando con particelle alfa un cristallo di berillo, scoprì una
nuova particella subatomica la cui massa è circa 1839 volte maggiore di quella dell’ elettrone,
cioè 1.6749*10 g, alla quale non è associata alcuna carica elettrica. Chadwick chiamò neutrone
questa nuova particella di materia.
La scoperta fu di notevole importanza, in quanto ammettendo che il nucleo degli atomi fosse
costituito oltre che da protoni, anche da neutroni, poteva essere finalmente chiarito il fatto
sperimentalmente accertato che quasi tutti gli elementi naturali( ossigeno, azoto, cloro,
carbonio, ecc.) sono formati da miscele di atomi che, pur manifestando tutti le stesse
caratteristiche chimiche, hanno però una massa leggermente diversa gli uni dagli altri. Si stabilì
allora di chiamare isotopi quegli atomi di uno stesso elemento che, pur contenendo nel nucleo lo
stesso numero di protoni, hanno una massa diversa perché contengono nel nucleo un diverso
numero di neutroni. Ovviamente due o più isotopi di uno stesso elemento devono essere collocati
nella stessa casella (isotopo = stesso posto) della tavola periodica di Mendeleev, in quanto,
avendo lo stesso numero di protoni nucleari, sono caratterizzati dallo stesso numero d’ ordine.
In seguito alla scoperta del neutrone, per indicare in modo più preciso l’ atomo di un dato
elemento, è stato necessario precisarne sia il numero di protoni sia il numero di neutroni
nucleari, e a tale scopo, accanto al numero atomico Z, è stato definito il numero di massa (
simbolo A) il quale è dato dalla somma del numero di protoni e del numero di neutroni contenuti
nel nucleo dell’ atomo di un elemento.
Per rappresentare un elemento X, con il suo numero atomico Z e il suo numero di massa A si
utilizza il simbolo AZX (molto frequentemente abbreviato in AX).
Es. 1: un atomo di ossigeno composto da 8 neutroni e 8 protoni e quindi con Z=8 e A=16 viene
rappresentato come:
16
8O .
Es. 2 : dato un atomo con un numero di massa 56 e con N=31 , gli elettroni saranno dati dalla
differenza di A-N quindi 56-31 = 25
La presenza di neutroni nel nucleo, grazie al valore della loro massa, è in grado di spiegare la
discordanza di cui si è parlato.
Inoltre, i neutroni, privi di carica elettrica e interposti tra i protoni aventi carica positiva, li
tengono separati, rendendone minima la reciproca repulsione.
Più recentemente si è scoperto che i neutroni e i protoni sono vincolati da una particolare forza
detta forza nucleare forte.
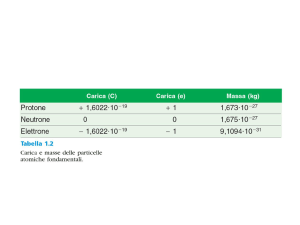
Caratteristiche delle particelle sub-atomiche
Nome
Simbolo
Massa in
grammi
Protone
P
1.673*10-24
Neutrone
n
1.675*10-24
elettrone
e- ,ß9.11*10-28
Massa in u
Carica in C
≈1
≈1
trascurabile
+1.602*10-19
0
-1. 602*10-19
Carica
relativa
+1
0
-1
Frederick Soddy
FREDERICK SODDY, chimico-fisico inglese (Eastbourne 1877-Brigton
1956).
Laureatosi a Oxford lavorò per due anni in Canada alla Mc Gill
University, dove conobbe E. Rutherford.
Tornato in patria, dopo essersi perfezionato a Londra sotto la guida di
W . Ramsay, divenne lecturer in chimica-fisica all’ Università di
Glasgow, professore di chimica ad Alberdeen e dal 1919 professore di
chimica- fisica e chimica organica a Oxford.
Dedicatosi allo studio della radioattività, sviluppò la teoria della
disintegrazione degli elementi radioattivi, enunciando la “legge dello spostamento” e
introducendo intorno il 1910 l’ idea, per quei tempi rivoluzionaria, che alcuni atomi potessero
essere chimicamente identici e avere masse differenti; chiamò questi isotopi(stesso posto).
Il motivo della diversità di massa degli isotopi fu però potuta chiarire solo alcuni anni più tardi
quando vennero approfonditi gli studi in campo di composizione nucleare.
In conclusione, gli isotopi di un elemento sono atomi che hanno uguale numero di protoni ma
diverso numero di neutroni.
Per esempio, considerando due atomi, ciascuno con due protoni e rispettivamente due e tre
neutroni sono entrambi isotopi dell’ elio che si indicheranno nella notazione semplificata con
5
He e 4He.
Hanno entrambi lo stesso comportamento chimico poiché, avendo lo stesso numero di protoni
hanno anche lo stesso numero di elettroni da cui dipendono le proprietà chimiche di un
elemento.
ISOTOPI DELL’OSSIGENO:
Simbolo
1H
2H
3H
Nome
Prozio
Deuterio
Trizio
Z
1
1
1
N
0
1
2
A
1
2
3
Percentuale di abbondanza relativa:
in natura si trova più di isotopo di un elemento, ma in diversa abbondanza. Per esempio, il
carbonio è fatto nel 98.892% di 12C e per 1.108% di 13C. la massa atomica relativa (o
semplicemente la massa atomica, A) del carbonio è la massa media di tutti i suoi isotopi naturali,
cioè:
massa atomica relativa =
+ Massa del primo isotopo x abbondanza relativa del primo isotopo
+ Massa del secondo isotopo x abbondanza relativa del secondo isotopo
+...
+ Massa dell’ultimo isotopo x abbondanza dell’ultimo isotopo
Questa formula ha senso perché si assume che la massa atomica relativa è semplicemente la
media di tutte le masse degli isotopi esistenti in natura.
Nota: la massa atomica relativa o massa atomica media è il valore di massa atomica che si trova
nella Tavola Periodica degli Elementi.
Teoria dello spostamento radioattivo (o legge di Soddy)
La teoria dello spostamento radioattivo spiega in che modo un elemento radioattivo può
trasformarsi in un altro elemento, di numero atomico minore o maggiore e afferma che ogni
trasformazione di un elemento in cui viene emessa una particella a abbassa di 4 il valore del suo
peso atomico e di 2 quello del numero atomico. La perdita di ogni particella a (un nucleo di He,
bivalente positivo) provoca lo spostamento dell’elemento di due posizioni indietro sulla stessa
riga della tavola periodica mentre la perdita di una particella b (equivalente a un elettrone)
provoca lo spostamento di una posizione a destra sulla stessa riga. La perdita simultanea di una
particella a e due particelle b lascia inalterata la posizione nella tavola periodica generando una
specie isotopica che manifesterà le stesse proprietà chimiche e proprietà spettroscopiche
distinguibili solo marginalmente attraverso spettrometri ad elevata risoluzione. La legge dello
spostamento si inquadra nella teoria atomica di Rutherford: se in un atomo la carica positiva del
nucleo è uguale al numero di elettroni e questo equivale al suo numero atomico, con l’emissione
di una particella a la carica nucleare diminuisce di due unità e viene a identificarsi con quella
dell’atomo che la precede di due posizioni nella tavola periodica mentre se perde un elettrone
la sua carica nucleare aumenta di una unità e finisce per identificarsi con la specie atomica che
la segue a destra di una posizione.
Tempo di dimezzamento e decadimento radioattivo
Soddy effettuò anche studi riguardanti le teorie di dimezzamento e decadimento radioattivo;
per esempio un po’ di uranio, lasciato a se stesso, gradualmente decadrà in varie particelle più
piccole. La velocità di decadimento si misura considerando quanto tempo occorrerebbe perché
decada metà dell’uranio (tempo di dimezzamento). Anche se è completamente casuale il
momento in cui un dato atomo decade, è possibile predire con buona approssimazione il tempo
di dimezzamento di un grande numero di atomi.
Quindi il tempo necessario ad un certo numero di atomi di materiale radioattivo per dimezzarsi è
detto tempo di dimezzamento ed è indicato con t ½.
Per 238U (uranio) il tempo di dimezzamento vale 4.468 miliardi di anni
Per 235U il tempo di dimezzamento vale 704 milioni di anni, ovvero 0.704 miliardi di anni
E’ evidente che un elemento impiega meno tempo per “dimezzarsi” se fa molti “decadimenti” e
ad ogni decadimento corrisponde l’emissione di “radioattività”
Es: “un chilo” di 235U sarà più radioattivo di “un chilo” di 238U
Spettrografo di massa
Lo spettrografo di massa, inventato fra il 1915 ed il 1925 da Francis William Aston, permise di
fare un censimento degli isotopi. Si accertò, in tal modo, che vi sono elementi (una ventina) con
un solo isotopo, altri con più isotopi fino ad un massimo di 10 (lo stagno); e che dal polonio in
poi, tutti gli isotopi sono radioattivi.
Uno dei primi spettrometri di massa, utilizzati da Aston nel 1919, permise lo studio degli isotopi
del Neon. In generale, in questi dispositivi si fa uso di un campo magnetico (talvolta anche di un
campo elettrico) per focalizzare e separare ioni aventi masse differenti. Nello schema di Aston
ad esempio, ioni aventi lo stesso rapporto carica/massa sono focalizzati in un solo punto,
nonostante uno spread nella velocità. I più recenti apparecchi per la spettrografia di massa,
detti spettrometri di massa o spettrografi di massa, danno una grande dispersione e sono in
grado apprezzare minime differenze di massa. La massa di uno dei membri del doppietto deve
essere però nota con grande precisione. Gli spettri di massa sono stati analizzati in dettaglio per
dedurre la composizione isotopica degli elementi e trarre da questa quelle informazioni
qualitative che costituiscono il primo passo dello studio delle forze nucleari.
Per gli studi sulla natura degli isotopi e per il grande contributo in campo scientifico, Frederick
Soddy meritò nel 1921 il premio nobel per la chimica.