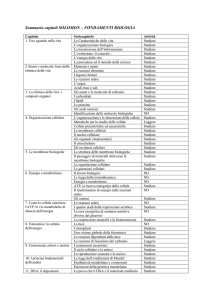
PROGRAMMA DI SCIENZE
A.S. 2015/2016 – Prof.ssa PICERNO Silvana
III A-Scientifico
BIOLOGIA
Flusso di energia, materia e informazione
1. L’ordine interno dei viventi
2. Le leggi fondamentali dell’energia
3. L’energia per compiere lavoro
4. Direzione e velocità delle reazioni chimiche cellulari
5. Il flusso di materia
6. Movimenti di soluti attraverso la membrana
7. Movimento di molecole grandi, microrganismi e detriti attraverso la membrana
8. Flusso di informazione
9. La sintesi proteica
10. La divisione cellulare
La trasmissione dei caratteri ereditari
1. L’eredità biologica
2. Mendel e la nascita della genetica
3. L’estensione della genetica mendeliana
4. La continuità della vita è assicurata da mitosi e meiosi
5. La mitosi
6. Meiosi
Le basi molecolari dell’ereditarietà: genetica ed evoluzione
Le basi molecolari dell’ereditarietà
1
1. I cromosomi portano l’informazione genetica
2. La ricerca del materiale genetico
3. La doppia elica del DNA: nasce la biologia molecolare
4. Il flusso dell’informazione genetica
5. Il gene si esprime attraverso la sintesi delle proteine
6. I geni eucarioti sono discontinui
7. La regolazione del flusso di informazioni geniche
8. Dimensioni e complessità del genoma
9. I cambiamenti accidentali del DNA: le mutazioni
10. Cambiamenti legittimi e illegittimi del DNA
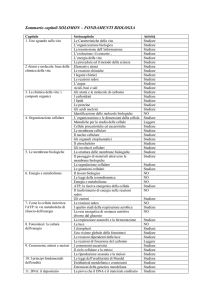
CHIMICA
I FLUIDI: GAS E LIQUIDI
I gas
La legge di Boyle
La legge di Charles
La legge di Gay-Lussac
L’equazione generale di stato dei gas
I gas reali
I liquidi
Le soluzioni
Le soluzioni acquose
La concentrazione
2
La tensione di vapore delle soluzioni
Le proprietà colligative: la dipendenza dalla concentrazione
Abbassamento della tensione di vapore
Innalzamento ebullioscopico
Abbassamento crioscopico
Pressione osmotica
IL GOVERNO DELLE TRASFORMAZIONI CHIMICHE
LE SOLUZIONI TITOLATE E L’ANALISI CHIMICA QUANTITATIVA
Concentrazione di una soluzione
Calcolo della molarità M e della normalità N di una soluzione
Relazione tra normalità N e molarità M
Regole pratiche per la determinazione della quantità di soluto contenuto in una soluzioni
L’ENERGIA
L’ENERGIA NELLE REAZIONI
Il sistema e l’ambiente
Le reazioni e la luce
Le reazioni e gli scambi di calore
Reazioni esotermiche e reazioni endotermiche
L’energia si conserva
LA SPONTANEITA’ DELLE REAZIONI
3
Le reazioni spontanee
La minima energia
L’entalpia
Il disordine
L’entropia
L’energia libera
LA DINAMICA CHIMICA
LA VELOCITA’ DELLE REAZIONI
Reazioni lente e reazioni veloci
La determinazione sperimentale della velocità
I fattori che influiscono sulla velocità di reazione
L’effetto natura dei reagenti
L’effetto temperatura
L’effetto concentrazione
L’effetto pressione
L’effetto superficie di contatto
L’effetto catalisi
La teoria delle collisioni
L’EQUILIBRIO CHIMICO
L’interpretazione cinetica dell’equilibrio
La costante di equilibrio
Il principio di “ Le Chatelier”
4
EQUILIBRI IN SOLUZIONE ACQUOSA
Elettroliti
Acidi
Teoria di Arrhenius
e
basi
Teoria Bronsted e Lowry
Acidi forti e deboli
Basi forti e deboli
Autoprotolisi dell’acqua
Costanti di dissociazione Calcolo del pH
Reazioni di neutralizzazioni
Idrolisi salina
Firma degli Alunni
L’Insegnante
(Prof.ssa PICERNO Silvana)
5