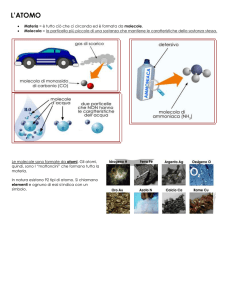
L’ATOMO: IL COMPONENTE FONDAMENTALE DELLA MATERIA
L’atomo è formato da protoni, elettroni e neutroni anche chiamate particelle subatomiche. Gli atomi
dei diversi elementi sono tutti formati da queste particelle ma differiscono tra loro per il numero di
quest’ultime.
LE PARTICELLE SUBATOMICHE
Le particelle subatomiche posseggono ben precisi valori di massa e di carica elettrica:
• Elettrone: simbolo e- è la particella più piccola presente nell’atomo, tanto da possedere una massa
quasi trascurabile ed è l’unità di carica elettrica negativa.
• Protone: simbolo p+, ha una massa più grande di quella dell’elettrone e possiede una carica
elettrica uguale a quella del protone ma positiva
• Neutrone: simbolo n, è la particella priva di carica avente una massa circa uguale a quella del
protone.
Un atomo contiene lo stesso numero di elettroni e protoni, essendo elettricamente neutro. Gli
elettroni invece sono dotati di grande energia cinetica, e girano intorno al nucleo senza mai
ricadervi. Numero atomico (Z): numero di protoni, e quindi di elettroni di un atomo. Numero di
massa (A): numero di protoni e neutroni presenti nel nucleo.
LA RADIOATTIVITA’ SPONTANEA
Becquerel scoprì la radioattività spontanea di alcuni elementi. La radioattività consiste nella
capacità di questi elementi di emettere spontaneamente radiazioni di tre tipi: α,β,γ. Le radiazioni α
sono particelle che recano con sé due cariche positive, esse sono le meno penetranti ma ionizzano
facilmente i gas. Le radiazioni β sono particelle che recano con sé una carica negativa. Sono infatti
costituite da elettroni molto veloci. Sono più penetranti delle particelle α, ma ionizzano i gas in
minor misura. Le radiazioni γ sono particelle prive di carica che hanno natura ondulatoria come la
luce ed hanno un potere penetrante assai elevato.
SCOPERTA DELLE PARTICELLE SUBATOMICHE
Studiando il comportamento di alcune radiazioni prima sconosciute si giunse alla scoperta degli
elettroni. All’interno di un tubo di vetro (tubo di Crookes) collegato con una pompa a vuoto sono
saldati due elettrodi metallici collegati ai due poli di un generatore di corrente continua tra i quali si
stabilisce una forte differenza di potenziale. All’interno del tubo la pressione del gas presente viene
pian piano ridotta fino a 10-6 atm quando sul vetro opposto al catodo si notò una fluorescenza. Si
ritenne che essa fu causata dall’arrivo di radiazioni emesse dal catodo stesso che si propagavano
perpendicolarmente rispetto alla sua superficie che vennero chiamati raggi catodici. I raggi catodici
hanno natura corpuscolare e carica elettrica negativa e hanno sempre identiche caratteristiche di
massa e carica. Si concluse che i raggi catodici sono formati da particelle con carica elettrica
negativa
chiamate
elettroni.
Alla scoperta del protone si giunse usando un tubo a raggi catodici ma con catodo forato. Dietro al
catodo si generavano delle radiazioni di movimento opposto rispetto a quello dei raggi catodici, di
carica positiva vennero chiamai raggi positivi o raggi canale. Le particelle che lo formavano
vennero
poi
in
seguito
chiamate
protoni.
La scoperta del neutrone avvenne solo nel 1932.
Il numero atomico si indica con Z ed identifica tutti gli elementi chimici:
I protoni e i neutroni convivono a strettissimo contatto nella parte centrale e piccolissima
dell’atomo, chiamata nucleo e, insieme formano la massa dell’atomo. Essi vengono perciò detti
nucleoni. Benché abbiano la stessa massa essi possono coesistere grazie alla forza nucleare.
Z= 1 (Idrogeno);
Z=2 (Elio);
Gli elettroni ed i protoni hanno carica uguale ma di segno contrario, quindi in un atomo neutro il
numero dei protoni è sempre uguale a quello degli elettroni.
Il numero di massa è uguale alla somma dei protoni e dei neutroni (nucleoni) e si indica
con A.
I neutroni, come i protoni, si trovano nel nucleo. Il numero dei neutroni può variare anche per
atomi che appartengono ad uno stesso elemento, esso si indica con N. Gli atomi di uno stesso
elemento che differiscono per il numero dei neutroni vengono chiamati isotopi. Ad esempio
l’idrogeno è formato da tre isotopi:
Il prozio che possiede un elettrone ed un protone.
Il deuterio che possiede un elettrone, un protone ed un neutrone.
Il trizio che possiede un elettrone, un protone e due neutroni.
I PRIMI MODELLI ATOMICI
• Nel 1904 Thomson propose il modello a panettone che ipotizzava che gli elettroni fossero
dispersi in una massa elettricamente positiva in modo da determinarne l’equilibrio delle cariche.
• Rutherford all’inizio del XX secolo condusse studi approfonditi sulla radioattività e in particolare
sugli effetti dell’impatto di particelle α++ su sottili lamini d’oro. Le particelle α positive passavano
quasi tutte attraverso la lamina, in qualche caso venivano deviate con angoli superiori a 90° e
praticamente nessuna veniva riflessa. Da questi studi egli ipotizzò che: poiché le particelle α++ per
lo più non incontravano alcun ostacolo sul proprio cammino, l’atomo doveva essere formato
prevalentemente da spazio vuoto; poiché le particelle α++ in qualche caso venivano riflesse, l’intera
carica positiva doveva essere raggruppata in un nucleo; gli elettroni si dovevano muovere su orbite
circolari poste a grandi distanze dal nucleo in modo da non scontrarsi con le particelle α++. Questo
modello fu definito modello planetario, e si avvicina di molto al nostro tuttavia necessitava ancora
di qualche puntualizzazione. Questo modello atomico non era, tuttavia, in grado di dare una valida
spiegazione agli esperimenti che avevano messo in evidenza la capacità degli elettroni di assorbire e
di emettere energia. Secondo le leggi della fisica classica, infatti, l’elettrone cedendo energia
doveva percorrere una traiettoria a spirale e cadere in pochi istanti sul nucleo.
Bohr partendo dal principio che non era corretto applicare all’atomo le leggi valide per corpi, che se
paragonati ad esso sono di dimensioni enormi, perfezionò la teoria di Rutherford.
Lo spettro elettromagnetico.
Per spiegare il comportamento degli elettroni e le radiazioni emesse dagli atomi Bohr si servì della
meccanica quantistica. Secondo questa teoria l’energia può essere emessa o assorbita secondo
quantità discrete chiamati quanti. Per meglio capire questi concetti è necessario un cenno sulle
proprietà delle onde elettromagnetiche.
L’energia radiante è costituita da forze elettriche e magnetiche che si propagano nello spazio con
moto ondulatorio, cioè come le onde.
a
Tutte le onde elettromagnetiche si propagano alla velocità della luce:
c = 3.1010 cm/sec. La distanza tra due picchi di un onda si chiama lunghezza d’onda e si indica con
(lambda).
Il numero di onde che passano in un secondo si chiama frequenza e si indica con (ni). Vale la
relazione =c; quindi se la frequenza è grande, la lunghezza d’onda è piccola e viceversa.
L’energia è direttamente proporzionale alla frequenza della radiazione, cioè:
E = h, dove h è una costante di proporzionalità, chiamata costante di Plank. Radiazioni che hanno
elevata frequenza hanno, quindi, anche elevata energia.
Nella figura è illustrato lo spettro delle varie radiazioni.
(cm)
10-9
10-7
10-5
10-3
Raggi
103
Microonde
Raggi
ultravioletti
violetto blu
(nm) 400
10
Onde radio, TV
Raggi x
Alta energia, alta
frequenza, piccola
lunghezza d’onda
10-1
verde
500
Raggi infrarossi
giallo
Bassa energia, bassa
frequenza, grande
lunghezza d’onda
arancione
rosso
600
700
800
L’atomo di Bohr
Bohr considera l’atomo formato da un nucleo centrale, nel quale risiede quasi tutta la massa, e dagli
elettroni che ruotano intorno al nucleo descrivendo orbite ben precise (stazionarie). Gli elettroni
possono acquistare o cedere energia per passare da un orbita all’altra, la quantità di energia
acquistata o ceduta è pari alla differenza di energia esistente tra le due orbite.
Secondo Bohr l’elettrone emette o assorbe energia soltanto se questa gli consente di passare da un
orbita stazionaria all’altra.
In base al modello atomico di Rutherford l’elettrone poteva acquistare o cedere una quantità di
energia qualsiasi, di conseguenza riscaldando una certa quantità di idrogeno si sarebbero dovute
ottenere radiazioni di qualsiasi lunghezza d’onda e registrando le radiazioni emesse si sarebbe
dovuto ottenere uno spettro continuo come quello che si ottiene da una lampada ad incandescenza o
dalla luce solare.
Secondo la teoria di Bohr, nel passare da un orbita all’altra, l’elettrone dovrebbe emettere una
determinata quantità di energia:
E21 =E2 – E1=h21
E31 =E3 – E1=h31
E32 =E3 – E2=h32
E3
E2
E1
Le frequenze delle radiazioni emesse variano al variare della quantità di energia. Nell’esempio
sopra riportato si dovrebbero avere tre radiazioni diverse, ognuna di esse con una determinata
frequenza e quindi con una ben determinata lunghezza d’onda.
Le ipotesi di Bohr si dimostrarono valide per l’idrogeno (1 solo elettrone), errate per atomi più
complessi. Infatti, prendendo in considerazione lo spettro di emissione dell’idrogeno, le frequenze
ottenute sperimentalmente da Bohr coincidevano con quelle calcolate teoricamente, mentre con
atomi più complessi il numero di radiazioni emesse era superiore a quello ipotizzato. Un altro
scienziato di nome Sommerfeld per spiegare la presenza di queste radiazioni in più ipotizzo
l’esistenza anche di orbite ellittiche.
DALL’ATOMO AGLI IONI: L’ENERGIA DI IONIZZAZIONE E L’AFFINITA’
ELETTRONICA
Gli atomi in particolari condizioni possono cedere o acquistare elettroni per raggiungere una
maggiore stabilità. Quando un atomo perde elettroni si trasforma in un ione positivo, mentre quando
ne acquista si trasforma in un ione negativo. Si definisce ione un atomo che non contiene protoni ed
elettroni in ugual numero, e che perciò possiede una o più cariche elettriche negative o positive. Si
definisce energia di ionizzazione Ei l’energia che occorre fornire a un atomo per strappargli un
elettrone. Si definisce affinità elettronica Eo l’energia che un atomo libera quando associa a sé un
elettrone. Esistono strati, o livelli energetici di energia, nettamente separati tra loro, entro i quali
trovano la loro collocazione gli elettroni componenti i rispettivi atomi.
Nello stesso periodo, altri scienziati stavano prendendo in considerazione una teoria completamente
diversa, nota come teoria ondulatoria.
Teoria atomica moderna
Molti studiosi tra cui Heisenberg, non si trovavano d’accordo con quelle teorie che consideravano
l’elettrone come un corpuscolo, essi ritenevano che, date le piccole dimensione e l’elevata velocità
con cui si muoveva, fosse più corretto considerarlo come una nuvola. Heisenberg formulò il
principio d’indeterminazione nel quale sosteneva che esistono coppie di grandezze che non possono
venire contemporaneamente misurate con la necessaria precisione; anzi, la precisione di una è
inversamente proporzionale alla misura della seconda. Applicato all’atomo, questo principio
esprime l’impossibilità di misurare congiuntamente posizione e velocità istantanea dell’elettrone.
Secondo la teoria atomica oggi accettata gli elettroni non descrivono delle orbite intorno al nucleo
ma si trovano sugli orbitali. L’orbitale viene definito come la zona dello spazio intorno al nucleo
dove si ha la maggiore probabilità di trovare l’elettrone. La teoria atomica moderna si base su un
equazione matematica nota come Equazione di Schrödinger. I numeri quantici sono soluzioni di
questa equazione e consentono di definire forma, dimensioni ed energia degli orbitali.
I numeri quantici sono:
n, numero quantico principale, indica il livello energetico e le dimensioni degli orbitali.
Insieme ad l determina l’energia dell’orbitale. Può assumere valori interi, in genere,
compresi tra 1 e 7.
l, numero quantico secondario o angolare, indica il sottolivello energetico e la forma degli
orbitali. Dipende dal valore di n. Può assumere tutti i valori compresi tra 0 e n-1.
m, numero quantico magnetico, indica l’orientamento nello spazio della nuvola elettronica
ed il numero degli orbitali. Dipende dal valore di l. Può assumere tutti i valori compresi tra
-1 e +l.
s, numero quantico magnetico di spin, indica il senso di rotazione dell’elettrone intorno al
proprio asse, può avvenire in senso orario o antiorario, assumendo rispettivamente i valori +
½ e - ½.
Struttura elettronica degli elementi
I numeri quantici e gli orbitali
I sottolivelli energetici ed i relativi orbitali vengono indicati da alcune lettere minuscole
dell’alfabeto: s, p, d, f .
Il sottolivello s è identificato dal valore l=0, possiede un solo orbitale e può contenere due elettroni.
Il sottolivello p è identificato dal valore l=1, possiede tre orbitali e può contenere sei elettroni.
Il sottolivello d è identificato dal valore l=2, possiede cinque orbitali e può contenere dieci elettroni.
Il sottolivello f è identificato dal valore l=3, possiede sette orbitali e può contenere quattordici
elettroni.
Il primo livello energetico possiede soltanto il sottolivello s, e quindi un solo orbitale.
Il secondo livello energetico possiede i sottolivelli s e p, per un totale di quattro orbitali.
Il terzo livello energetico possiede i sottolivelli s, p e d, per un totale di nove orbitali.
Il quarto livello energetico possiede i sottolivelli s, p, d e f, per un totale di sedici orbitali.
Ogni orbitale può contenere al massimo due elettroni che si disporranno con spin opposto. Quindi il
primo livello energetico può contenere al massimo due elettroni, il secondo otto, il terzo sedici, il
quarto trentadue. Gli elettroni occuperanno per primi gli orbitali di più bassa energia. L’energia
cresce con il livello energetico e con la complessità della forma degli orbitali. In uno stesso livello
energetico l’energia cresce nel seguente ordine: s < p < d < f, gli orbitali appartenenti allo stesso
sottolivello energetico hanno la stessa energia ( orbitali degeneri ). Quando gli elettroni vanno ad
occupare orbitali con uguale energia li riempiono prima parzialmente, disponendosi con lo stesso
spin, e poi li completano.
L’ordine di riempimento degli orbitali è il seguente:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p,7s, 5f, 6d, 7p.
A volte può essere utile scrivere la struttura elettronica rappresentando gli orbitali con dei quadratini
e gli elettroni con delle frecce orientate in modo da tenere conto dello spin.