Anatomia Patologica
Prof. Carbone
29/10/2007
h.12.30-14.30
CARCINOMA DELLA MAMMELLA (prognosi e terapia)
Tecniche
Nella valutazione prognostica del K mammario, la citofluorimetria è importante in quanto ci dà
un’idea della ploidia cellulare (contenuto di DNA per nucleo). Ha una sensibilità non superiore al
5%: quindi non riesce a rilevare mutazioni e altre alterazioni genetiche molecolari. Oltre a
informazioni sulla ploidia, fornisce anche dati sulla frazione di sintesi del DNA (cioè della
percentuale, nel tempo, di cellule che si trovano nella fase S del ciclo). Questi dati sono utili sia per
la prognosi del tumore, sia per la valutazione della sua sensibilità alla terapia antiblastica.
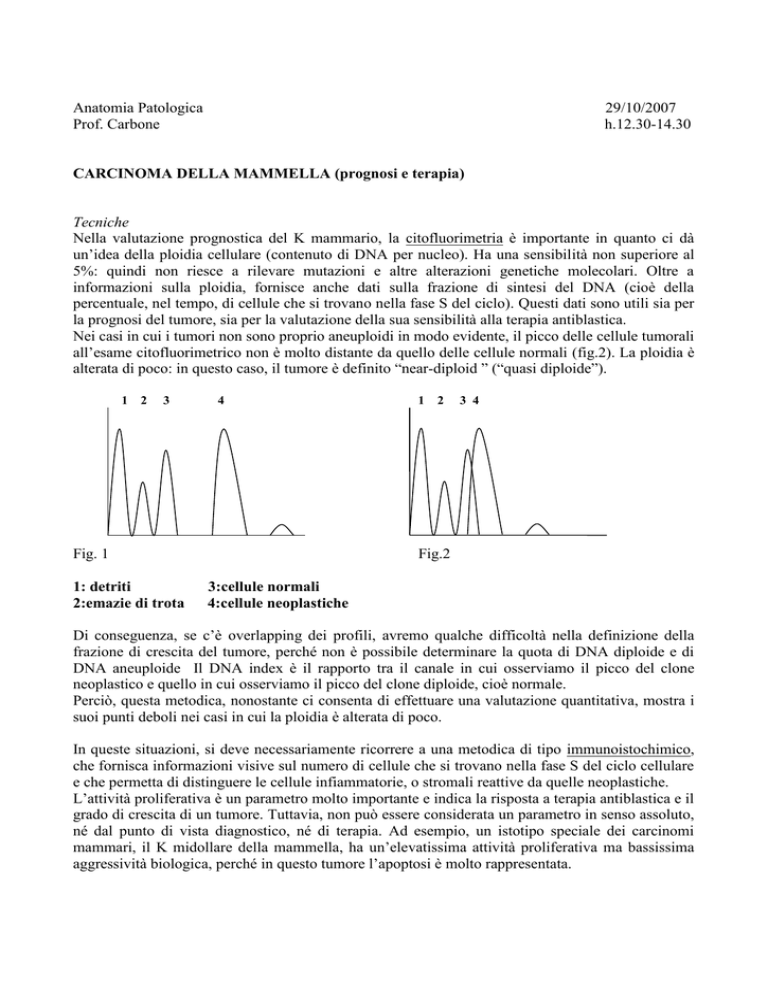
Nei casi in cui i tumori non sono proprio aneuploidi in modo evidente, il picco delle cellule tumorali
all’esame citofluorimetrico non è molto distante da quello delle cellule normali (fig.2). La ploidia è
alterata di poco: in questo caso, il tumore è definito “near-diploid ” (“quasi diploide”).
1
2
3
4
Fig. 1
1: detriti
2:emazie di trota
1
2
3 4
Fig.2
3:cellule normali
4:cellule neoplastiche
Di conseguenza, se c’è overlapping dei profili, avremo qualche difficoltà nella definizione della
frazione di crescita del tumore, perché non è possibile determinare la quota di DNA diploide e di
DNA aneuploide Il DNA index è il rapporto tra il canale in cui osserviamo il picco del clone
neoplastico e quello in cui osserviamo il picco del clone diploide, cioè normale.
Perciò, questa metodica, nonostante ci consenta di effettuare una valutazione quantitativa, mostra i
suoi punti deboli nei casi in cui la ploidia è alterata di poco.
In queste situazioni, si deve necessariamente ricorrere a una metodica di tipo immunoistochimico,
che fornisca informazioni visive sul numero di cellule che si trovano nella fase S del ciclo cellulare
e che permetta di distinguere le cellule infiammatorie, o stromali reattive da quelle neoplastiche.
L’attività proliferativa è un parametro molto importante e indica la risposta a terapia antiblastica e il
grado di crescita di un tumore. Tuttavia, non può essere considerata un parametro in senso assoluto,
né dal punto di vista diagnostico, né di terapia. Ad esempio, un istotipo speciale dei carcinomi
mammari, il K midollare della mammella, ha un’elevatissima attività proliferativa ma bassissima
aggressività biologica, perché in questo tumore l’apoptosi è molto rappresentata.
Oggi si insiste molto sulla caratterizzazione biopatologica del K mammario perché si tenta di
realizzare una terapia sempre più su misura per ogni singolo paziente, che massimizzi i benefici e
minimizzi gli effetti dannosi, colpendo in maniera selettiva il bersaglio da combattere.
Fattori prognostici e fattori predittivi
Oggi la distinzione tra fattori prognostici e fattori predittivi suona un po’ artificiosa, perché alcuni
elementi che determinano la risposta di un tumore alla terapia sono implicati anche nella prognosi
della malattia stessa.
Attualmente, i fattori predittivi di risposta alla terapia nel carcinoma della mammella sono
sostanzialmente due:
-ormonodipendenza: presenza del recettore degli estrogeni e del progesterone.
-Her-2/Neu (o c-erb2): antigene di membrana che rende la cellula neoplastica vulnerabile all’azione
di un anticorpo monoclonale diretto contro l’antigene stesso.
Per capire la differenza tra un fattore prognostico e un fattore predittivo di terapia, proviamo a
considerare il cancro della mammella in condizioni di trattamento o non trattamento per quel che
riguarda un parametro specifico come lo stato linfonodale: sappiamo che è un fattore caratterizzante
in maniera pesante il cancro della mammella (Fig.3).
%sopravvivenza
N-NEG
N-POS
Fig. 3
ER-NEG
ER-POS
Fig.4
Trattati
Non trattati
HER2Neu NEG
Fig.5
HER2Neu POS
Ora, i casi trattati vanno comunque meglio, ma in modo parallelo rispetto a quelli che non sono
trattati, sia in caso di negatività che positività dei linfonodi metastatici. Questo significa che il peso
specifico della positività dei linfonodi risente poco del trattamento contro il cancro della mammella,
perché c’è proporzionalità fra risposta e non risposta a una terapia considerata in modo generico.
Ciò significa che la positività o negatività dei linfonodi in cancro della mammella è un fattore
prognostico assai importante ma non un fattore predittivo di terapia.
Se consideriamo, invece, la presenza o meno dell’estrogeno-recettore (ER) (Fig.4) notiamo che i
due andamenti (casi trattati e non trattati), non sono affatto paralleli. In caso di assenza
dell’estrogeno-recettore, il trattamento rispetto al non trattamento influisce scarsamente sulla
sopravvivenza. Quando, però, il recettore è presente c’è una grande differenza di mortalità tra i
soggetti non trattati e quelli trattati. Quindi, l’estrogeno-recettore è considerato sia come fattore
prognostico, sia come fattore predittivo di risposta a terapia.
Lo stesso accade per Her-2/Neu (Fig.5): quando è presente, c’è una differenza significativa tra i casi
trattati e i non trattati; mentre lo stesso non accade quando tale antigene è assente.
Ormonodipendenza significa realizzarsi di particolari meccanismi fisiopatologici nell’ambito di
cellule e tessuti neoplastici che rendono la cellula e i tessuti sensibili a una esposizione di tipo
ormonale. Fisiologicamente, l’estrogeno è liposolubile, cosicché diffonde liberamente attraverso le
membrane citoplasmatiche; entra ed esce indifferentemente dalle cellule. In determinate cellule
riesce, però, a concentrarsi contro gradiente. La concentrazione così aumentata degli estrogeni
provoca a un certo punto l’innesco di quella che è l’estrogenodipendenza, cioè la suscettibilità
all’azione biologica degli estrogeni su tali tessuti. Per esempio, in questo tipo di distretti gli
estrogeni inducono la crescita cellulare e la sintesi di molecole cosiddette “post-recettoriali” molto
specifiche, la più importante delle quali è il recettore per il progesterone (PR).
Tali tessuti riescono a concentrare contro gradiente l’estrogeno nelle cellule grazie alla presenza di
recettori specifici per gli estrogeni. Legandosi a questi, l’estrogeno è intrappolato contro gradiente,
cosicché le concentrazioni aumentano a livelli tali da provocare le due principali azioni biologiche
precedentemente menzionate.
I tessuti esprimenti i recettori per gli estrogeni (e che risultano quindi estrogenosensibili) sono
prevalentemente l’endometrio e la ghiandola mammaria: in essi, i recettori per gli estrogeni non
sono presenti in grande quantità, ma sono dotati di notevole affinità e specificità.
La presenza di estrogeno-recettore e progesterone-recettore all’interno di un tessuto neoplastico
(dato che nel tessuto sano sono la norma), ci indica che le cellule tumorali sono potenzialmente
estrogeno dipendenti (cioè esiste un bersaglio che può essere attaccato con farmaci specifici). Ci
segnala anche che l’interazione fra il ligando e l’estrogeno recettore ha una buona possibilità di
stimolare un’azione biologica dell’estrogeno, perché è presente anche il progesterone recettore.
Perciò, la contemporanea presenza dei due recettori ci garantisce in qualche modo l’efficacia
dell’azione biologica dell’estrogeno, e quindi significa che il tumore può essere considerato
veramente ormonodipendente e manipolabile a livello endocrino.
La Tabella 1 illustra meglio il concetto sopra esposto
Antigeni
ER-/PRER+/PRER-/PR+
ER+/PR+
Percentuale di casi
27%
30%
2%
41%
Risposta all’ormonoterapia
10%
32%
34%
71%
Ma come mai solo il 71% dei tumori con entrambi i recettori ormonali risponde alla terapia? E
perché rispondono alla terapia anche alcuni tumori privi dei recettori? Esistono diverse spiegazioni
plausibili.
Per quanto riguarda il secondo quesito, possiamo anche ammettere che, in quel 10% responsivo
all’ormonoterapia, i recettori non fossero stati individuati per difetto tecnico e che, trovandosi al di
sotto di una soglia di possibilità di rilevazione, fossero stati classificati come negativi pur essendo
positivi magari per entrambi i recettori! E questa è la spiegazione più probabile. Altra eventualità: il
recettore era stato mascherato dal legame con estrogeni endogeni, perciò non era stato possibile il
riconoscimento con estradiolo triziato.
Riguardo al primo quesito (entrambi i recettori sono presenti ma i pazienti non rispondono), sussiste
un altro tipo di spiegazione. Nella cascata di signalling post-recettoriale della cellula normale, noi
assumiamo che tutti gli step siano conservati, e ammettiamo che tutti i meccanismi (trasporto dal
citoplasma al nucleo l’azione delle cicline, la sintesi del DNA, etc.) siano indenni. Nella cellula
neoplastica, invece, possono insorgere alterazioni profonde, genetiche e biochimiche; di
conseguenza, anche se i due recettori sono presenti, uno qualsiasi degli step successivi potrebbe non
essere più funzionante e verrebbe a cadere l’azione biologica finale dell’estrogeno e del
progesterone.
I recettori sono visibili mediante tecniche immunoistochimiche affidabili e standardizzate, sebbene
il punto debole della valutazione sia ancora l’interpretazione di tipo soggettivo. In ogni caso, si usa
un anticorpo diretto contro un antigene nucleare, che compare come un segnale marrone bruciato
nel nucleo. Ciò rende molto agevole la visualizzazione dell’estrogeno-recettore e del progesteronerecettore anche in campioni di tipo citologico. Infatti, la distribuzione degli antigeni (nucleari o
citoplasmatici) è determinante a seconda che si tratti di una sezione istologica o di un preparato
citologico Gli antigeni di tipo nucleare nelle indagini citologiche sono ben facilmente rilevabili ma
non si può dire altrettanto di quelli di membrana o citoplasmatici (v. oltre)
Her-2/Neu
L’Her-2/Neu è un oncogene molto particolare e con ruolo storico molto importante (Her = Human
Epidermal Receptor). Si tratta di una serie di recettori clonati da esperimenti sull’epidermide, e
sebbene oggi si sappia che queste molecole sono rappresentate maggiormente in altri tessuti, la
denominazione è rimasta invariata.
L’Her-2 è una proteina transmembrana e ha una caratteristica molto particolare: è un recettore di
membrana “orfano” (cioè non ha un suo ligando conosciuto) ma riveste una funzione
importantissima nella dimerizzazione o nella doppia dimerizzazione di altri recettori di membrana
adiacenti. In pratica, Her-2 riesce ad attirare a sé dei recettori di altri ligandi (di solito,
macromolecole del tipo fattori di crescita) e ad esaltarne significativamente l’attivazione grazie a
questa disposizione particolare. Perciò, anche se non ha un suo proprio ligando, possiede una
funzione molto importante nel controllo della proliferazione cellulare, perché i ligandi dei recettori
da esso attivati sono fattori di crescita.
E’ importante studiare l’espressione di questa molecola sulla membrana del cancro della mammella,
perché, se è presente sulla porzione esterna della membrana in quantità sufficiente, può essere
raggiunta da un anticorpo monoclonale che è stato sintetizzato contro questa molecola. In seguito al
legame con l’anticorpo di sintesi, l’Her-2/Neu non funziona più, non dimerizza con gli altri
recettori, e la proliferazione cellulare è bloccata; se poi subentra anche un intervento di tipo
infiammatorio, si assiste a una lisi cellulare. E’ allora importante selezionare i casi in cui la densità
sulla membrana di questa molecola è talmente abbondante da permettere una terapia anticorpale.
Il nome commerciale del suddetto anticorpo è Herceptin (principio attivo: Trastuzumab).
Per studiare la suscettibilità a Trastuzumab non è sufficiente l’immunoistochimica (che si limita a
studiare l’espressione della molecola sulla membrana). Infatti sappiamo che l’espressione
aumentata è conseguenza di una profonda alterazione genetica: cioè, nel suo DNA c’è una
amplificazione del gene che determina la iperespressione sulla membrana di questa molecola. E’
possibile valutare il numero di copie del gene di Her-2/Neu presente nel nucleo delle cellule
neoplastiche mediante tecniche di biologia molecolare come FISH o PCR.
Si può considerare anche uno step intermedio: studiare quanto mRNA è presente nelle cellule
neoplastiche. È un metodo avanzato e difficile da realizzare data la fragilità dell’mRNA nel
momento in cui viene estratto ed esaminato. Le RNAasi ne rendono difficile lo studio.
In pratica si segue un algoritmo diagnostico abbastanza preciso: si fa prima lo studio
immunoistochimico, poi l’amplificazione del gene nel DNA con la FISH (quest’ultima è costosa e
indaginosa, relativamente difficile e non accessibile a tutti i laboratori)
Algoritmo diagnostico
Tessuto tumorale
Immunoistochimica
2+
3+
0 o 1+: non amplificazione sicura
2+: risultato borderline
3+: amplificazione sicura
FISH
(+)
(-)
FISH
(-)
(+)
Terapia con
Herceptin
Con la FISH si denatura il DNA, si espongono delle sequenze specifiche che possono legarsi a
“probes” (sonde) marcate e quindi visibili. E’ la metodica di elezione per il riconoscimento della
presenza del gene, ma anche dello stato di amplificazione. Solo se c’è amplificazione (cioè numero
elevato di copie di gene per cromosoma) è possibile avere un’iperespressione sulla membrana
dell’Her-2 nelle cellule neoplastiche, Non si può, invece, parlare di amplificazione se sono
aumentati contemporaneamente sia il n° di copie di un dato gene, sia il n° di cromosomi in assoluto;
in quel caso si parlerà di poliploidismo. Con la FISH, quindi, noi possiamo allo stesso tempo
studiare il numero di copie di un gene e il numero di cromosomi che portano quel gene nel nucleo
cellula neoplastica.
Oltre alla FISH (Fluorescent In Situ Hybridization), esistono anche la CISH (Chromogenic In Situ
Hybridization) e la SISH (Silver In Situ Hybridization).
Tuttavia, la FISH, resta la tecnica d’elezione, perché ci consente in modo veloce e agile con
semplice cambiamento di filtri (diversa della luce UV) di giocare con più di un fluorocromo, ed è
inoltre l’unica tecnica che ci permette di fare diagnostica di poliploidismo e di studiare il numero di
copie di gene. Nella CISH, invece, in cui il fluorocromo è sostituito da un cromogeno visibile al
microscopio ottico, non possiamo effettuare tali studi particolari.
Per analizzare l’amplificazione dell’Her-2/Neu con la FISH, si costituisce una sonda che riconosca
il gene specifico e un’altra diretta contro una sequenza caratteristica del cromosoma 17 (è il
cromosoma che ospita l’Her-2/Neu). Valutando intensità e numero dei due segnali capiremo non
solo se l’Her-2/Neu è presente, ma anche se è amplificato, tramite il rapporto fra Her-2 e
cromosoma 17
Il probe del cromosoma 17 è il centromero oppure la gastrina, che non sono quasi mai amplificati;
(se infatti fossero amplificate anche le sequenze che usiamo come punto di riferimento avremmo un
rapporto di 1:1 fra Her-2 e cromosomi: non risulterebbe evidente l’amplificazione di Her-2/Neu).
Nell’esempio: rosso = probe per Her-2, verde = probe per cromosoma 17.
Si contano gli spot rossi e verdi per nucleo e si calcola il rapporto numero di rossi / numero di verdi.
Normalmente questo rapporto è 1. Se aumenta fino ad essere è uguale o superiore a 2, c’è
amplificazione di copie di Her-2.
Un altro approccio interessante, che ci dà un risultato numerico con l’ausilio delle operazioni
biochimiche eseguite da una macchina è la rtPCR (Real Time Polymerase Chain Reaction); da non
confondere con la “Reverse Transcriptase PCR”.
Il principio è molto simile a quello della FISH; in più, ha la potenza dell’amplificazione delle
sequenze genetiche a partire da quantità di DNA molto piccole, purché si approntino un primer e
sequenze che riconoscono l’Her-2. Allo stesso tempo, possiamo avere iniziatori che amplificano
sequenze specifiche del cromosoma 17, come quelle della gastrina o del centromero. Dopo un dato
numero di cicli di amplificazione avremo una certa quantità di geni per Her-2 e gastrina: calcolando
il rapporto fra queste due masse potremo stabilire se c’è amplificazione di Her-2/Neu o no.
La PCR si effettua facendo denaturare il DNA del campione a una data temperatura e, a partire da
primers di sequenze specifiche, nucleotidi e DNA polimerasi, si ottengono numerose copie di geni
nel corso di una serie di cicli. È possibile analizzare sequenze specifiche che variano in dimensione
a seconda della mappa di restrizione enzimatica. Essi riconoscono sequenze specifiche del DNA e
tagliano il DNA nei punti riconosciuti. I frammenti hanno una lunghezza variabile a seconda delle
sequenze rappresentate; perciò, se li facciamo correre su un gel capiamo se c’è stata alterazione
nella sequenza o no.
I campioni possono essere ricavati da:
-Prelievi endoscopici minuscoli
-Ago biopsie
-Sezioni da materiale fissato in formalina o paraffina
HER2Neu
gastrina
DNA
(calibrazione)
Gene non amplificato
Gene amplificato
24 28
Fig.6
cicli
24
32
Fig 7.
Nella Fig.6 è rappresentato il quadro di lettura alla PCR dell’Her-2/Neu. Nella Fig.7, quello della
gastrina. L’amplificazione dell’Her-2/Neu comincia ad essere rilevata attorno al 28° ciclo di PCR;
quella dellla gastrina intorno al 32°. Ciò significa che al ciclo 0 le sequenze di Her-2/Neu erano in
numero di copie maggiore rispetto a quelle della gastrina, ma la differenza si nota solo intorno al
20° ciclo. C’è più Her-2/Neu rispetto alla gastrina: perciò c’è amplificazione di Her-2/Neu.
Rispetto alla FISH, quindi, la PCR dà anche un risultato quantitativo.
Consideriamo il campione di tipo citologico (FNABs). In esso si vedono bene gli antigeni nucleari
(ER, PR), ma non quelli di membrana! Se un antigene è esclusivamente sulla membrana il rischio
che si corre è che si generi un rinforzo continuo del segnale, il cosiddetto “sandwich effect” (il
segnale di membrana o citoplasmatico si sovrappone a quello nucleare e copre anche la superficie di
contatto con il vetrino. Questo ci dà un bias e provoca confusione di risultato.
Perciò conviene usare la rtPCR rispetto a una FISH o a un esame immunoistochimico, quando si
hanno campioni alterati per errata fissazione (incongrua o prolungata) o alterata processazione
(fenomeni di coartazione citoplasmatica per shrinking). La rtPCR, infatti, saltando tutte le
problematiche dedicate alla morfologia e riconoscimento di eventuali segnali sul preparato, può
risultare veramente utile.
Algoritmo diagnostico modificato
Tessuto tumorale
Immunoistochimica
2+
3+
FISH
(+)
RT-PCR
Terapia con
(-)
(+)
(-)
Di conseguenza, è possibile
modificare l’algoritmo
diagnostico per amplificazione
di Her-2/Neu inserendo la
rtPCR al posto della FISH
(dopo il risultato 2+) oppure
usare la rtPCR quando la FISH
sia negativa o viceversa!
Herceptin
Pathology Navigation System (PNS).
Nelle persone che seguono un certo tipo di algoritmo diagnostico e indagine devono esserci diverse
expertise: diagnosi istologica e approfondimento diagnostico devono coincidere e la persona che
ricopre questo ruolo centrale di diagnostica microscopica deve essere colei che attribuisce il
significato di una lesione speciale ad una lesione microscopica. L’anatomia patologica ha una
affidabilità diagnostica importante proprio per il sovrapporsi di questi livelli.
Si compone di
Macrodissection
Microdissection
Molecular Analysis
Laser Capture Microdissection: possiamo catturare micro-aree istologiche; quindi al microscopio
eseguiamo una diagnosi e un sub-campionamento per isolare nel campo istologico un elemento di
interesse, che è una lesione su cui poi potremo eseguire studi molecolari anche molto sofisticati. E’
usata soprattutto in campo oncologico.
Si sfrutta uno strumento che abbassa un filtro adesivo su una zona circondata in precedenza da una
luce laser che la ritaglia dal contesto. Quando viene sollevato il filtro adesivo, questo si porta dietro
la zona ritagliata; a sua volta trasferita in una struttura di analisi molecolare ( PCR o altro). Così si
unisce capacità diagnostica e capacità di selezione, e si cerca di progredire sulla conoscenza di
quella lesione in maniera indipendente dal contesto. Infatti i limiti più grandi delle tecniche di
laboratorio derivano proprio dalla contaminazione del campione.
Applicazione utile: si possono ritagliare le ITC = Isolated Tumor Cells, cellule in transito nei seni
marginali dei linfonodi; isolarle e studiarne le caratteristiche immunofenotipiche o genetiche.
Queste cellule, che hanno l’aspetto di essere le prime a distaccarsi dal tumore primitivo per
metastatizzare, possono così essere isolate dappertutto per valutare che cosa determina il
meccanismo di annidamento nel midollo osseo, e così via.
Marcatori prognostici in corso di validazione nel carcinoma della mammella
Sono marcatori che hanno in sé un germe di razionalità e che risultano utili anche nel carcinoma
della mammella:
o P53
o BCL-2
p53
E’ un famosissimo oncosoppressore. La sua alterazione rimuove dei meccanismi di controllo sulla
divisione cellulare innescando una divisione cellulare incontrollata. Si studia quando è iperespresso,
quando è presente in forma mutata, o comunque quando non espleta più la sua funzione
soppressoria. Una cellula che presenti un’alterazione di un gene così importante ha una
profondissima modificazione genetica.
BCL-2
È un po’ diverso: è antiapoptogeno. Inibisce i meccanismi apoptotici fino a quando la cellula deve
terminare il suo ciclo vitale. Ma è un meccanismo debole, è iperespresso nelle patologie come le
malattie emolinfoproliferative poco aggressive (LLC, LNH a piccoli linfociti). Non conferisce di
per sé aggressività: non fa altro che far “dimenticare” alle cellule che devono morire e queste si
accumulano. È un parametro che ci può indicare una alterazione della trasformazione cellulare
piuttosto blanda.
Perciò, p53 e BCL-2 sono agli antipodi: se la p53 mutata indica una profonda alterazione genetica,
BCL-2 non fa che inibire l’apoptosi. Questi due parametri correlano in qualche modo con una certa
significatività: una diminuita BCL-2 si associa a un grado nucleare elevato, a negatività per
estrogeno recettore, a una p53 particolarmente espressa e a positività di Her-2/Neu.
E in campo oncologico possiamo considerare i tumori ricchi di BCL-2 meno aggressivi di quelli
con grandi alterazioni della p53. Viceversa, una diminuita espressione di BCL-2 è associata a
maggiori alterazioni di p53 e a un peggiore quadro clinico.
Ringraziamenti a:
-Luca Valerio, la cui consulenza è stata indispensabile per tagliare i tempi biblici di questa sbob
-Dr.Marco “gallo” Moscarda, la cui consulenza è stata fondamentale per la parte di biologia
molecolare
-Silvia per l’amicizia e il sostegno morale che mi offre sempre
-il gruppo badge per l’impagabile aiuto nei momenti in cui il dono dell’ubiquità farebbe davvero
comodo
-Cristina, Elena, Federica e Simona: perché compagne di avventura dal primo anno in questa
sgangherata facoltà e perché finiamo sempre a parlare delle cose più strane
-Piero per le crespelle (ehehehe ) e per il camice che devo ancora restituirti
-Vitale per la disponibilità e la gentilezza
-Gabriella per il caffè (ehehehehe ) e per l’invito a Romics che ho dovuto disertare causa
impegni di reparto
-Francesco Di Nardo, che in una sua sbob mi ha portato agli onori degli altari
-e sicuramente quelli che ho dimenticato di scrivere per la fretta, ma non perché non fossero vicini
al mio cuore.
ILARIA









![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)


