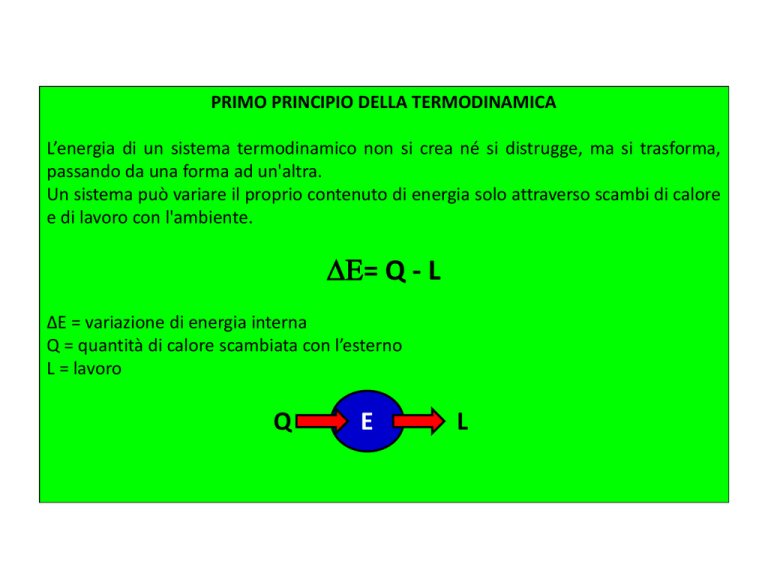
PRIMO PRINCIPIO DELLA TERMODINAMICA
L’energia di un sistema termodinamico non si crea né si distrugge, ma si trasforma,
passando da una forma ad un'altra.
Un sistema può variare il proprio contenuto di energia solo attraverso scambi di calore
e di lavoro con l'ambiente.
DE= Q - L
∆E = variazione di energia interna
Q = quantità di calore scambiata con l’esterno
L = lavoro
Q
E
L
Il lavoro, nei sistemi come quelli biologici che operano a pressione costante, può
essere calcolato come il prodotto della pressione per la variazione di volume
L = P(V2-V1)
Quindi la variazione tra energia finale ed iniziale del sistema è:
DE= E2 - E1 = Qp- P(V2-V1)
dove Q P= calore scambiato a pressione costante
Quindi
Q p= E2 - E1 + P · V2 - P · V1
cioè
Qp = (E2 + P · V2) - (E1 + P · V1)
E + P · V viene chiamata entalpia o contenuto termico totale del sistema (H)
Quindi
Q p = H2-H1 = DH
La variazione di entalpia tra stato finale ed iniziale corrisponde al calore generato o
assorbito dal sistema. In altre parole durante una trasformazione fatta avvenire a
pressione costante la variazione di entalpia del sistema corrisponde al calore
scambiato.
Processi esotermici: il sistema cede calore all’ambiente
Processi endotermici: il sistema guadagna calore
SECONDO PRINCIPIO DELLA TERMODINAMICA
L'entropia di un sistema isolato lontano dall'equilibrio termico tende ad aumentare nel
tempo, fino al raggiungimento dell’equilibrio. In altre parole, qualsiasi sistema evolve
spontaneamente verso lo stato di massimo disordine.
Entropia (S)
misura del disordine presente in un sistema, incluso, come caso limite, l'universo.
La variazione di entropia in una trasformazione reversibile è
DS = Q rev/T
Dove Qrev è il calore scambiato nella reazione e T è la temperatura assoluta
In una reazione di tipo chimico la variazione di entropia è:
DS = S prodotti- S reagenti
Nelle reazioni che avvengono con un aumento del disordine, l'entropia dei prodotti è
maggiore dell'entropia dei reagenti, per cui: ∆S > 0.
Nelle reazioni che avvengono con diminuzione del disordine, l'entropia dei prodotti è
minore dell'entropia dei reagenti, per cui: ∆S < 0.
Tenendo conto della definizione di entropia, il secondo principio della termodinamica può
essere enunciato nel seguente modo:
nei processi spontanei di un sistema isolato l'entropia S deve aumentare, cioè ∆S deve
essere maggiore di zero .
Esempi di stati a bassa entropia e ad
alta entropia
Le variazioni di energia e di entropia saranno importanti
per determinare la direzione dei processi
termodinamicamente favoriti.
Però la formulazione del secondo principio non è utile in
biologia perché non esistono sistemi isolati.
I sistemi viventi possono scambiare energia e materia con
l’ambiente esterno.
Una funzione che racchiuda sia energia che entropia è
l’energia libera di Gibbs (G)
che tiene conto sia del termine entalpico (variazione di
energia libera a P costante) sia di quello entropico (che
misura l’importanza del grado di disordine)
ENERGIA LIBERA
Il cambiamento di energia libera per una trasformazione che avviene a T e P costanti
corrisponde a:
DG = DH – T · DS
L’energia libera è un indicatore della spontaneità delle reazioni
I processi che avvengono a T e P costanti (come quelli biochimici) sono spontanei quando
la variazione di energia libera è minore o uguale a 0 (DG<0)
I processi spontanei sono definiti processi esoergonici
I processi non spontanei sono definiti processi endoergonici e sono possibili solo se
accoppiati a reazioni esoergoniche, che forniscono energia.
Se i termini DH e DS si equivalgono il DG è uguale a 0 e la trasformazione non è favorita
né in un senso né nell’altro = il sistema è all’equilibrio.
Per ogni trasformazione chimica e fisica è la competizione tra il termine entalpico e
quello entropico che determina la direzione favorita.
I processi termodinamicamente favoriti non sono necessariamente
rapidi
Un catalizzatore (enzimi) può aumentare la velocità di alcune reazioni
ma la direzione favorita è sempre dettata dal DG e non dipende dal
fatto che sia catalizzata o no
L’entropia in un sistema aperto può diminuire:
un organismo che ingerisce cibo sottoforma di piccole molecole
disorganizzate e da esso costruisce macromolecole complesse e molto
organizzate come le proteine e gli acidi nucleici.
Si spende però molta energia.
Quindi un organismo per superare l’entropia consuma energia , quindi
se queste trasformazioni devono avvenire l’energia deve essere
negativa
LA VITA E’ UN PROCESSO IRREVERSIBILE
ENERGIA LIBERA e IL LAVORO UTILE
DG misura la massima quantità di lavoro utile che può essere ottenuto in un
processo chimico (es lavoro implicato nella contrazione muscolare e motilità
cellulare, nel trasporto di ioni e molecole…..)
…….e indica che una parte di DH è sempre dissipato sottoforma di calore (T · DS dove
DS =Q rev/T) e quindi non disponibile per altre cose.
In una reazione redox:
DG=-nFE
Cioè il lavoro effettuato per spostare nmoli di elettroni contro un potenziale negativo
(-Evolt) , F è il numero di coulomb per mole di elettroni cioè 96485 C/mole.
Se la reazione viene condotta in condizioni standard (1M ):
DG°=-nFE°
ENERGIA LIBERA e la CONCENTRAZIONE
DG:
• Il valore assoluto indica quanto il processo sia lontano dall’equilibrio e di
quanto lavoro utile sia ottenibile da esso.
•Il segno della variazione dell’energia libera indica la direzione del processo
termodinamicamente favorita
…..in che modo l’energia libera di un sistema dipende dalle quantità dei vari
componenti della soluzione?
IL POTENZIALE CHIMICO
G=aGA + bGB + cGC +….
Dove GA ecc rappresentano le energie libere molari parziali o potenziali
chimici cioè rappresentano il contributo per mole dato da ciascun
componente all’energia libera totale del sistema.
Per soluzioni diluite ( aGA ) il potenziale chimico dipende soltanto dalla concentrazione
della sostanza in questione e la relazione è logaritmica:
A concentrazioni molto basse :
GA=G°A+RTln[A]
dove [A] è la concentrazione molare del componente A
GB=G°B+RTln[B]
……..
Per concentrazioni 1M GA=G°A cioè G°A ecc sono i valori di riferimento o valori in
condizioni standard
T= Temperatura assoluta e R (8.314 J/(mol.K)è la costante dei gas.
L’equazione sopra riportata è molto importante perché ci permette di prevedere la
direzione favorita di una trasformazione reale in condizioni definite
Variazione di ENERGIA LIBERA
L’ATP e i relativi composti mono e difosfati sono il passepartout che la cellula può
utilizzare per compiere i processi vitali.
In una reazione generica:
aA+bB
cC+dD
La reazione procede con rapporti stechiometrici ben definiti che sono in accordo con la
legge di conservazione della massa ed esemplificati dai coefficienti stechiometrici
(a,b,c,d)
Q = Quoziente della reazione =[ C ]c [ D ]d/ [ A ]a [ B ]b
L’equilibrio si raggiunge quando la velocità con cui reagiscono A e B è uguale alla
velocità con cui reagiscono C e D e la reazione si arresta. Allora:
Q=K costante di equilibrio
In questo caso non vi è più energia ad essa associata per compiere un lavoro.
Reazioni prossime all’equilibrio: valori di Q pressochè uguali a quelli di K
Reazioni irreversibili: valori di Q decisamente diversi da quelli di K
Tutti i processi che
avvengono negli organismi
sono legati alla variazione
di energia che può essere
acquistata o ceduta da una
determinata specie.
Lavoisier già nel 1788
arrivò alla conclusione che
il cibo viene lentamente
bruciato nel nostro corpo
per produrre energia e
uno
degli
effetti
fenomenologici di tale
evento è la produzione di
calore dal corpo stesso.
E’ possibile stabilire quanto più una reazione è lontana dall’equilibrio? e
di conseguenza quant’è l’energia associata alla reazione?
Sì calcolando la variazione di energia libera di Gibbs (∆G):
La variazione di energia libera deve essere uguale all’energia libera dei prodotti
meno quella dei reagenti.
Il ∆G dipende dalla concentrazione dei reagenti e dei prodotti:
∆G = cGC + dGD-aGA - bGB
La forza che promuove la reazione corrisponde all’energia libera totale dei prodotti
meno quella dei reagenti.
Si sostituisce a ognuno la sua eq. (GA=G°A+RTln[A] ) e otteniamo:
∆ G=∆G°+RTln ([C]c [D ]d/ [A ]a [B ]b)
Se la reazione è giunta all’equilibrio [C]c [D ]d/ [A ]a [B ]b=Keq e quindi ∆ G=0
-∆G°=RTlnK
(° significa che la reazione avviene in condizioni particolari cioè standard in conc
1M)
Il ∆G° ha un valore predittivo soltanto nelle condizioni standard cioè a
predire il verso della reazione
∆G° = ∆G
Ma non serve in condizioni fisiologiche perché non è modificato dai
cambiamenti della concentrazione del prodotto e del substrato
L’accoppiamento di reazioni o processi endoergonici a reazioni o
processi esoergonici altamente favoriti viene utilizzato per spingere
queste reazioni.
Composti come fosfoanidridi, enol fosfati, alcuni tioesteri e i composti
contenenti legami N-P sono considerati come trasportatori di energia
libera della cellula.
L’ATP e i relativi composti mono e difosfati sono il
passepartout che la cellula può utilizzare per compiere i
processi vitali.
L’ATP
La molecola di ATP, adenosina trifosfato, è
costituita dall’adenosina (adenina + ribosio) cui
sono legati 3 gruppi fosfato .
ADP (adenosina difosfato) e AMP (adenosina
monofosfato) contengono rispettivamente 2 e
1 gruppo fosfato
Le reazioni di idrolisi dell’ATP sono molto rilevanti per il metabolismo cellulare. Queste
reazioni fortemente esoergoniche sono accoppiate a numerosi processi biochimici
endoergonici e li rendono possibili.
Reazioni di idrolisi di
una serie di composti
del fosfato.
GLI ENZIMI
Gli enzimi sono proteine che catalizzano le reazioni chimiche che avvengono negli
organismi viventi
Sebbene gli enzimi agiscano con modalità differenti da reazione a reazione, la
catalisi procede sempre attraverso la formazione di un complesso enzimasubstrato.
La reazione più semplice può essere schematizzata come segue:
E + S <=>ES <=>EP <=> E + P
L'enzima si lega al substrato S formando il
complesso enzima-substrato (ES).
ES si converte nel complesso enzimaprodotto (EP) che si scinde in prodotto ed
enzima libero, disponibile per una nuova
reazione.
GLI ENZIMI
Gli enzimi accelerano le reazioni abbassando l’energia di attivazione.
La velocità di una reazione enzimatica può essere fino a 1014 volte superiore alla
velocità della stessa reazione non catalizzata.
GLI ENZIMI
La specificità della catalisi enzimatica è
esemplificata dal modello chiave-serratura
(Fischer 1894).
Enzima e substrato possiedono una forma
esattamente complementare che permette un
incastro perfetto.
Per spiegare la stabilizzazione dello stato di
transizione del complesso enzima-substrato è
stato proposto il modello dell’adattamento
indotto (Koshland, 1958).
La relativa flessibilità della struttura della
proteina permette il rimodellamento del sito
catalitico (o sito attivo dell’enzima) in base alla
presenza o meno del substrato e permette
all’enzima di completare correttamente la sua
attività catalitica.
GLI ENZIMI
In base al tipo di reazione catalizzata gli enzimi sono classificati in sei differenti
classi
Classe
Tipo di reazione
Ossidoreduttasi
Reazioni di ossidoriduzione. La classe include le ossidasi
(ossidazione diretta con ossigeno), le deidrogenasi (rimozione
di idrogeno), ecc.
Transferasi
Trasferimento di un gruppo funzionale da un donatore ad un
accettore
Idrolasi
Reazioni di idrolisi, cioè rottura di legami con l’ausilio di
molecole di acqua (proteasi, esterasi, ecc.)
Liasi
Addizioni di gruppi al doppio legame o eliminazioni con
formazione di doppi legami
Isomerasi
Isomerizzazioni all'interno di una molecola (trasferimenti di
gruppi all’interno della molecola)
Ligasi
Formazione di un legame covalente tra due molecole (C-C, C-S,
C-O, C-N)
GLI ENZIMI
La velocità con cui gli enzimi operano dipende da molti fattori quali:
•Concentrazione dell’enzima
•Concentrazione del substrato
•Temperatura
•pH
•Presenza di inibitori
•Presenza di cofattori
Concentrazione dell’enzima
In condizioni normali la velocità iniziale della reazione (V0) è direttamente
proporzionale alla concentrazione dell’enzima presente
Concentrazione del substrato
La velocità della reazione aumenta in maniera
lineare all’aumentare della concentrazione del
substrato fino alla saturazione di tutti i siti attivi. Il
limite a cui tende V0 per concentrazioni saturanti di
substrato rappresenta la massima velocità della
reazione (Vmax). Ulteriori aumenti di concentrazione
del substrato non influenzano più la velocità.
GLI ENZIMI
L’equazione di Michaelis-Menten descrive matematicamente la relazione tra velocità
enzimatica e concentrazione di substrato
V =(Vmax · [S]) / (Km + [S])
Km (costante di Michaelis e Menten) rappresenta la concentrazione di substrato
necessaria per raggiungere metà della Vmax.
A basse concentrazioni di substrato, considerando [S] è trascurabile, si ha
V =(Vmax · [S]) / Km
cioè la velocità è direttamente proporzionale alla concentrazione del substrato.
Ad alte concentrazioni di substrato, Km diventa trascurabile e si ha
V =Vmax
cioè la velocità è la massima, indipendentemente dalla concentrazione del substrato.
I valori di Km (indipendenti dalla concentrazione dell’enzima
e del substrato) variano moltissimo da enzima ad enzima ed
esprimono l’affinità che l’enzima ha per il substrato.
Dal grafico è evidente che se Km è bassa, è necessaria una
bassa [S] per saturare metà delle molecole di enzima (segno
di alta affinità dell’enzima per il substrato), mentre se Km è
alta, occorre una maggiore [S] per saturare metà delle
molecole di enzima (l’enzima presenta bassa affinità per il
substrato.)
GLI ENZIMI
Per un calcolo più accurato della Vmax e della Km è opportuno trasformare
matematicamente l’equazione di Michealis-Menten facendo il reciproco di entrambi i
lati dell’equazione
V =(Vmax · [S]) / (Km + [S])
1/V = Km / Vmax · 1/[S] + 1/Vmax
Questa relazione lineare, o grafico dei dopi reciproci, è nota come equazione di
Lineweaver-Burk
GLI ENZIMI
La velocità di una reazione enzimatica è influenzata dalla temperatura
Inizialmente la velocità cresce al
temperatura, raggiunge un
corrispondenza di una certa
definita ottimale e si riduce
aumenti di temperatura per
denaturazione dell’enzima.
La variazione del pH influenza la velocità delle
reazioni enzimatiche, dal momento che i
cambiamenti di pH modificano il numero di cariche
presenti sia sul substrato che sull’enzima. Anche in
questo caso, la curva presenta un andamento a
campana e l’attività enzimatica manifesta un
massimo in corrispondenza di un valore definito pH
ottimale in cui l’interazione del substrato con il sito
attivo è favorita.
crescere della
massimo in
temperatura
per ulteriori
effetto della
GLI ENZIMI
Presenza di inibitori
La velocità di una reazione catalizzata è influenzata dalla presenza di inibitori,
molecole specifiche o ioni che possono competere con le molecole di substrato
nel legarsi con l’enzima ed inibirne l’attività.
L’inibizione può essere reversibile quando l’enzima può recuperare la sua attività
biologica, in questo caso il tipo di inibitore può essere:
•competitivo
•non competitivo
L’inibizione é irreversibile quando l’enzima perde la sua attività biologica. In
questo caso la molecola di inibitore si lega con un legame covalente ad un residuo
di un amminoacido presente nel sito attivo, modificando in modo irreversibile la
forma del sito attivo e la conformazione della molecola enzimatica.
Nell‘inibizione competitiva:
GLI ENZIMI
Presenza di inibitori
Inibizione competitiva: gli inibitori sono, da un punto di vista chimico, molto
simili alle molecole di substrato e si legano agli stessi siti attivi. Può essere
completamente rimossa aumentando notevolmente la concentrazione di
substrato. Quindi, poiché per ottenere la stessa velocità di reazione che in
assenza di inibitore è necessario aumentare la concentrazione di substrato, Vmax
rimane invariata (infatti a concentrazione elevata di substrato tutta l’inibizione
viene rimossa) mentre Km aumenta
Inibizione non competitiva: gli inibitori si legano a siti dell’enzima diversi da quelli
che legano il substrato e, pertanto, possono legarsi sia all’enzima che al
complesso ES. Il legame dell’inibitore deforma la conformazione spaziale
dell’enzima e del sito attivo, riducendo di conseguenza la capacità catalitica.
Quindi, a qualsiasi concentrazione di substrato Vmax diminuisce mentre Km rimane
costante,
ENZIMI REGOLATORI
Nel metabolismo cellulare, gruppi di enzimi catalizzano reazioni sequenziali di un
processo metabolico, dove il prodotto di una reazione diventa il substrato della
reazione successiva.
La maggior parte degli enzimi di una data via metabolica segue la cinetica di
Michaelis-Menten. Ciascuna via, però, include uno o più enzimi regolatori che
influenzano marcatamente la velocità dell’intera sequenza di reazioni.
L’attività catalitica degli enzimi regolatori, e quindi la velocità dell’intera sequenza
metabolica, aumenta o diminuisce in risposta a determinati segnali, permettendo
alla cellula di adeguarsi alle richieste di energia e di biomolecole necessarie.
La modulazione degli enzimi regolatori può avvenire in diversi modi:
•Legame reversibile di metaboliti e cofattori (modulatori allosterici)
•Modificazione covalente reversibile (trasferimento di un gruppo funzionale su un
residuo amminoacidico, ad es. fosforilazione)
•Legame con specifiche proteine regolatrici
•Scissione proteolitica (irreversibile) di segmenti proteici
•Sintesi di precursori inattivi (proenzimi): gli enzimi possono essere sintetizzati in
forma inattiva (proenzimi) e quindi attivati nel momento e nel sito cellulare
appropriato.
ENZIMI REGOLATORI
Enzimi allosterici
La regolazione è mediata da uno o più modulatori allosterici o effettori (metaboliti o
piccoli cofattori) che si legano in siti diversi dal sito attivo attivando o inibendo la
reazione enzimatica
• Sono in genere più grandi e più complessi degli enzimi non regolatori. La maggior
parte possiede due o più subunità
• Oltre ai siti attivi o catalitici, possiedono uno o più siti regolatori, o allosterici, specifici
per il legame con il modulatore
• Il legame con il modulatore produce una modificazione conformazionale che converte
l’enzima in una forma differentemente attiva
Spesso il modulatore allosterico è lo stesso substrato. In questo caso gli enzimi
regolatori sono detti omotropici. Quando il modulatore è una molecola diversa dal
substrato l’enzima è detto eterotropico.
Gli enzimi allosterici non seguono il comportamento
descritto dalla cinetica di Michaelis-Menten
Gli enzimi allosterici mostrano curve di saturazione
con il substrato quando la [S] è sufficientemente
elevata, però per alcuni di essi la curva di Vo in
funzione di [S] ha una forma sigmoide, invece che la
forma iperbolica tipica degli enzimi non regolatori.
ENZIMI REGOLATORI
Inibizione a feedback
Il prodotto finale, a valle di una sequenza multienzimatica, va ad inibire l’enzima
che catalizza la prima reazione della sequenza.
In alcuni sistemi multi enzimatici, gli enzimi regolatori sono specificamente inibiti
dai prodotti terminali della via metabolica, se la concentrazione di questi ultimi è
più elevata rispetto al fabbisogno cellulare.
Quando la velocità dell’enzima regolatore diminuisce, gli enzimi successivi
funzioneranno a velocità ridotte, perchè la concentrazione dei loro substrati è
drasticamente diminuita. Quindi la velocità di formazione del prodotto finale
della via metabolica sarà conforme alle necessità cellulari.
Questo tipo di regolazione è detto inibizione retroattiva (a feedback). L’aumento
della concentrazione del prodotto terminale rallenta la velocità dell’intero
processo.
UNITA’ ENZIMATICHE
Unità internazionale
Quantità di enzima che catalizza la formazione di una micromole di prodotto in
un minuto
Kcat o numero di turnover
Numero di molecole di substrato convertite in prodotto nell'unità di tempo da
una molecola di enzima quando è saturata con il substrato
GLI ENZIMI
Cofattori o attivatori
Molti enzimi richiedono la presenza di gruppi non proteici per svolgere la loro azione
catalitica. Questi gruppi sono detti cofattori e rientrano in 3 gruppi principali:
• Coenzimi: molecole organiche che possono essere separate dall’enzima.
• Gruppi prostetici: sono legati all’enzima da cui non si distaccano né durante il corso
della reazione, né ad enzima inattivo.
• Ioni organici (K+, Na+, Mg2+, Zn2+, Ca2+, Fe3+, ecc).
COENZIMI
Trasportatori di equivalenti riducenti
Coenzimi nicotinammidici: NAD/NADP
Coenzimi flavinici: FAD/FMN
Trasportatori di acili
Acido lipoico (elettroni)
Coenzima A
4’-fosfopanteteina
Trasportatori di unità monocarboniose
S-Adenosilmetionina
Tetraidrofolato
Biotina
Trasportatori di gruppi funzionali
Piridossal fosfato
Tiamina pirofosfato
Acido lipoico
Coenzima A
4’-fosfopanteteina
Biotina
Tetraidrofolato
S-adenosilmetionina
I COENZIMI NICOTINAMMIDICI
NAD (nicotinammide adenina dinucleotide) e NADP, dinucleotidi contenenti AMP, sono
i coenzimi delle deidrogenasi (enzimi che catalizzano reazioni di ossidoriduzione)
Il NADP differisce dal NAD per la presenza di un gruppo fosfato sul carbonio 2 del
riboso che porta l’adenina
L’enzima deidrogenasi trasferisce un anione idrogeno e elettroni (H:-) da un substrato
al NAD+ or NADP+
NAD(P)+ + 2e- + 2H+ → NAD(P)H + H+
I COENZIMI FLAVINICI
FAD (flavin adenina dinucleotide) e FMN (flavin mono-nucleotide ) sono derivati dalla
riboflavina (Vit B2) e sono coinvolti nelle reazioni di ossidoriduzione catalizzate dalle
deidrogenasi
COENZIMI TRASPORTATORI DI ACILI
Il coenzima A è costituito dalla cisteina, dall’acido pantotenico e dall’adenosina.
Quando il coenzima A trasporta un gruppo acetilico viene definita acetil-CoA.
Interviene in fondamentali in vie metaboliche quali l'ossidazione degli acidi grassi e il
ciclo di Krebs.
S-adenosilmetionina trasporta unità
monocarboniose nel loro stato più ridotto
(gruppi metilici).
Cofattore delle
metiltransferasi, che
trasferiscono un metile da SAM a vari
substrati biologici come acidi nucleici,
proteine e lipidi.
metionina
COENZIMI TRASPORTATORI DI UNITÀ MONOCARBONIOSE
adenosina
La biotina è un trasportatore di unità monocarboniose nel loro stato più ossidato
(CO2). E’ il cofattore delle carbossilasi
COENZIMI TRASPORTATORI DI GRUPPI FUNZIONALI
Il Piridossal fosfato (PLP), forma coenzimatica della Vit.B6 (piridossina), agisce da
trasportatore di gruppi –NH2 a livello del sito attivo delle amminotransferasi. Oscilla tra
una forma aldeidica (accettore di –NH2) e una forma amminata (donatore di -NH2)
La tiamina pirofosfato è un
trasportatore
di
frammenti
bicarboniosi
contenenti
un
gruppo chetonico
LA GLICOLISI
Via metabolica caratterizzata da 10 passaggi che convertono una molecola di glucosio
in due molecole di piruvato con la contemporanea produzione di due molecole di ATP
e due di NADH
La glicolisi avviene nel citosol
Le 10 reazioni possono essere distinte in due
diverse fasi:
Fase di investimento energetico
GLUCOSIO
-FASE DI INVESTIMENTO ENERGETICO: gli
zuccheri fosfati vengono sintetizzati a spese
dell’ATP ed il substrato a sei atomi di carbonio
viene scisso in 2 zuccheri a tre atomi di carbonio
-FASE DI PRODUZIONE ENERGETICA: i triosi
fosfati sono convertiti in composti ad alta
energia che trasferiscono il fosfato all’ADP
sintetizzando ATP
2 ADP
Fase di
produzione
energetica
4 ADP
2 NAD+
2 ATP
4 ATP
4 NADH
2 piruvato
Bilancio netto
Glucosio 2 Piruvato
2 ADP
2 ATP
2 NAD+ 2 NADH
FASE DI INVESTIMENTO ENERGETICO
1) fosforilazione ATP-dipendente del
glucosio catalizzata dall’esochinasi
2) isomerizzazione del glucosio-6-P in
fruttosio-6-P da parte dell’enzima
fosfoglucomutasi (noto anche come
fosfoesosoisomerasi)
3) fosforilazione ATP-dipendente del
fruttosio-6-P in fruttosio-1,6-bisP da
parte dell’enzima fosfofruttochinasi,
reazione praticamente irreversibile in
vivo.
4) scissione del fruttosio-1,6-bisP in 2
intermedi a 3 atomi di carbonio
catalizzata dall’enzima aldolasi, la
gliceraldeide-3-fosfato (GAP) ed il
diidrossiacetonfosfato (DHAP)
5) isomerizzazione del DHAP in GAP da
parte della trioso fosfato isomerasi
FASE DI RESA ENERGETICA
1) ossidazione NAD-dipendente e fosforilazione
della gliceraldeide-3-P in 1,3-bisP glicerato
catalizzata dalla gliceraldeide-3-P deidrogenasi,
reazione in cui si ha la formazione di NADH e la
contemporanea ossidazione del carbonio
carbonilico a gruppo carbossilico
2) fosforilazione a livello di substrato con sintesi
di ATP e formazione dell’1-3-bisP glicerato in 3fosfoglicerato operata dalla fosfoglicerato chinasi
3) isomerizzazione del 3-fosfoglicerato in 2fosfoglicerato da parte della fosfoglicerato mutasi
4) disidratazione
del
2-fosfoglicerato
in
fosfoenolpiruvato catalizzata dall’enzima enolasi
5) fosforilazione al livello del substrato con sintesi
di ATP e formazione del piruvato da parte della
piruvato chinasi
2) ISOMERIZZAZIONE DEL GLUCOSIO-6-P IN FRUTTOSIO-6-P
DA PARTE DELL’ENZIMA FOSFOGLUCOMUTASI (DG°’ = +1,7
kJ/mol)
PIRUVATO DEIDROGENASI
il piruvato
che è
deriva
dallanoto
ossidazione
carboidrati e’ una delle fonti di la
acetilL’enzima
anche
come dei
FOSFOESOSOISOMERASI
CoA, molecola che entra nel ciclo di Krebs per essere completamente ossidata.
reazione (isomeraizzazione di un aldoso in un chetoso è
La conversione del piruvato in acetil-CoA e’ una decarbossilazione ossidativa
reversibile
alle normali
cellulari dei due
operata
da un complesso
noto comeconcentrazioni
piruvato deidrogenasi
fosfati
La esosi
reazione
e’ molto complessa e prevede non solo la decarbossilazione del
piruvato e l’attivazione metabolica dei due atomi di carbonio restanti, ma anche la
produzione di equivalenti riducenti sotto froma di NADH.
la reazione e’ fortemente esoergonica e praticamente irreversibile.
il complesso della piruvato deidrogenasi e’ costituito da tre enzimi:
• piruvato decarbossilasi
• diidrolipoammide transacetilasi
• lipoammide deidrogenasi
Per la sua attivita’ catalitica questo complesso enzimatico necessita di 5 coenzimi:
tiamina pirofosfato, acido lipoico, FAD, CoA e NAD.
Il ciclo di Krebs
Chiamato anche ciclo degli acidi tricarbossilici o ciclo dell’acido citrico
E’ costituito da una serie di 8 reazioni
Si compie nella matrice mitocondriale
E’ una via metabolica anfibolica (partecipa sia a processi catabolici che anabolici).
Il ciclo è deputato alla demolizione di acetilCoA in CO2.
Anello di congiunzione delle vie metaboliche
responsabili della degradazione di carboidrati,
lipidi e proteine in CO2 e H2O con formazione
di energia chimica.
Quattro delle reazioni che lo compongono sono
catalizzate da ossido-reduttasi e producono:
3 NADH + H+ e 1 FADH2
Il ciclo di Krebs fornisce inoltre anche molti precursori per la produzione di alcuni
amminoacidi quali α-chetoglutarato e ossalacetato
Via dei pentoso fosfati
Pathway metabolico alternativo alla glicolisi
e al ciclo di Krebs, che porta all'ossidazione
del glucosio, alla produzione di NADPH e di
intermedi metabolici di grande importanza
per la cellula (ribosio e gliceraldeide 3P).
La via si compone di due fasi distinte, la fase
ossidativa e la fase non ossidativa.
Fase ossidativa
Realizza l’ossidazione completa a CO2 di uno
degli atomi di carbonio del glucosio 6fosfato (decarbossilazione) con formazione
di due molecole di NADPH + H+ e una
molecola di pentoso (ribulosio 5 fosfato ).
Via dei pentoso fosfati - Fase ossidativa
Il glucosio-6-P è ossidato a glucosio-6-P, in una reazione (reversibile) catalizzata dalla
glucosio-6-P deidrogenasi. L’enzima è regolato dal rapporto NADPH/NADP+ ed è
inattivato dalla luce.
Il 6-fosfogluconolattone è idrolizzato a gluconato-6-P dall’enzima gluconato-6-P
lattonasi in una reazione irreversibile che richiede Mg2+.
Il gluconato-6-P è poi decarbossilato a ribulosio-5-P
dalla Gluconato-6-P
deidrogenasi, una reazione
reazione ossidativa irreverssibile, NADP dipendente.
A questo punto le funzioni della via sono state espletate
nella fase ossidativa con la produzione di ribulosio-5fosfato e NADPH
Via dei pentoso fosfati - Fase non ossidativa
Riarrangia il ribulosio 5 fosfato in modo che da tre pentosi si ottengano due esosi
(fruttosio 6 fosfato) ed un trioso (gliceraldeide 3 fosfato).
Una molecola di ribulosio 5-fosfato è isomerizzato a ribosio 5-fosfato (utilizzabile per la
sintesi di nucleosidi e nucleotidi) e altre due sono epimerizzate a xilulosio 5-fosfato.
L’enzima transchetolasi trasferisce un frammento a due atomi di C dallo xilulosio-5-P al
ribosio-5-P con produzione della gliceraldeide-3-P e del sedoeptulosio-7-P. L’enzima
come per la piruvato deidrogenasi necessita di TPP
Via dei pentoso fosfati - Fase non ossidativa
I due prodotti a 7 e 3 atomi di C reagiscono per azione della transaldolasi, che
trasferisce un gruppo a tre atomi di C con il chetone del sedoeptulosio alla
gliceraldeide per dare eritrosio-4-P e fruttosio-6-P.
Nella reazione finale della via la transchetolasi, agisce di nuovo sullo xilulosio-5-P
trasferendo un frammento bicarbonioso all’eritrosio-4-P generando una molecola di
gliceraldeide-3-P ed una di fruttosio-6-P.
In pratica in questa fase del ciclo da tre pentosi
(contenenti in totale 15 atomi di C) sono stati
prodotti due molecole di esosi (fruttosio-6-P) e una
di trioso (gliceraldeide-3-P), secondo lo schema:
C5 + C5 --> C7 + C3 --> C6 + C4 ; C5 + C4 --> C6 + C3.
LE MEMBRANE BIOLOGICHE
Le membrane delimitano il confine tra la cellula e l’ambiente esterno e tra
specifici spazi all’interno della cellula.
Sono strutture idrofobiche che costituiscono una barriera alla diffusione di ioni e
molecole, che può avvenire solo attraverso specifiche strutture proteiche.
Le membrane rappresentano inoltre la sede di importanti reazioni energetiche,
quali il trasporto di elettroni fotosintetico (membrane tilacoidali) e respiratorio
(membrane mitocondriali).
Le membrane biologiche sono costituite da un doppio strato lipidico nel quale
sono integrate proteine specifiche, distinte in proteine di membrana integrali
(inserite nel doppio strato lipidico) e proteine periferiche, spesso associate alle
proteine integrali.












