Proteine e trasduzione del segnale
PROTEINE
Struttura
Intelaiatura citoscheletrica, strutture cellulari, impalcatura di sostegno extracellulare
Funzione
Catalisi enzimatica, riconoscimento, trasporto, deposito, movimento, difesa
La struttura delle proteine ne determina la funzione. Strutture primaria, secondaria, terziaria,
quaternaria.
Presenza di DOMINI -> motivi particolari
L’omologia delle sequenze suggerisce relazioni funzionali ed evolutive tra le proteine
Chaperonine -> catturano alcune proteine appena formate e le isolano dall’ambiente esterno; gli
permettono di raggiungere la configurazione finale e le rilasciano nel distretto idoneo.
Proteine denaturate al calore, con acidi o basi perdono la loro struttura terziaria e secondaria e
quindi la funzione biologica --> è un cambiamento reversibile perché sono implicati solo legami
deboli che si riformano spontaneamente.
Modificazione degli aa post sintesi --> maggiore varietà delle proteine
- metilazione
- aggiunta di gruppi –OH
PROTEINE CONIUGATE
Glicoproteine: enzimi, Ab, molecole di riconoscimento e recettori, supporti extracellulari
Il gruppo glucidico permette di formare legami idrogeno che stabilizzano le proteine, ne
aumentano la solubilità e conferiscono resistenza all’attacco enzimatico; forniscono gruppi
specifici, riconoscibili dai ligandi.
Lipoproteine: nelle membrane cellulari, soprattutto nella membrana plasmatica, dove il gruppo
lipidico funge da ancora per la proteina.
Metallo proteine: la loro presenza è necessaria per l’attività degli enzimi.
La degradazione delle proteine può avvenire, ad esempio, attraverso la via mediata
dall’ubiquitina (Ub) che riconosce delle proteine target che devono essere degradate, le marchia
spendendo energia in modo che vengano riconosciute da un secondo sistema enzimatico in grado
di degradarle.
Degradazione = rottura dei legami peptidici, irreversibile
Proteine conformate in modo aberrante sono implicate nello sviluppo di patologie:
una placca amiloide nella malattia di Alzheimer è un agglomerato di filamenti proteici che non
riesce ad assumere una conformazione funzionale -> diventa insolubile e ostruisce la cellula.
Funzioni proteiche:
la funzione proteica generalmente richiede dei cambiamenti conformazionali
le proteine sono destinate a legare un range di molecole (ligandi)
- il legame è caratterizzato da due proprietà: affinità e specificità
gli Ab posseggono precise specificità di legame
gli enzimi sono catalizzatori molto efficienti e specifici
- il sito attivo di un enzima si lega al substrato
Modello chiave-serratura: l’enzima ha già una forma complementare al substrato
Modello ad adattamento indotto: enzima e substrato non sono perfettamente
complementari ma quando si incontrano si adattano a vicenda
Sito attivo aperto o chiudo per regolazione dell’attività
Cinetica della reazione enzimatica
-> Curva di saturazione dell’enzima
-> V max
-> Km
Regolazione della funzione proteica (enzimi sempre presenti nella cellula)
Transizioni allosteriche
- Rilascio di subunità catalitiche, stato attivo <-> stato inattivo
- Legame cooperativo del ligando
Fosforilazione <-> defosforilazione
Attivazione proteolitica -> zimogeni (attivazione per taglio proteolitico)
Compartimentalizzazione
Regolazione allosterica
-> Inibizione a feed-back da prodotto finale
-> Attivazione o inibizione allosterica (con sito allosterico sull’enzima)
-> Rilascio allosterico di subunità catalitiche in presenza di cAMP
Proteine di membrana
Ciascuna membrana cellulare ha un set specifico di proteine che permette alla membrana
stessa di svolgere le proprie specifiche attività
Le proteine di membrana sono sia integrali sia periferiche
Le proteine integrali di transmembrana contengono una o più -eliche transmembrana
Altre proteine integrali sono ancorate alla membrana attraverso catene idrocarburiche
legate covalentemente
Le proteine periferiche rimangono legate alla membrana grazie all’associazione con le
proteine di membrana
Funzioni: trasporto, linkers, recettori, enzimi
Membrana plasmatica
Funzioni:
o Assicurare la corretta composizione intracellulare
o Ricezione dei segnali extracellulari
o Adesione alla matrice extracellulare e alle cellule adiacenti
-> doppio strato fosfolipidico
-> proteine immerse
-> attraversano completamente la membrana (transmembrana) o ne hanno immersa
un’ancora molto profonda (integrali); sono glicoproteine
-> non sono direttamente ancorate alla membrana (periferiche)
La componente proteica delle membrane varia a seconda della funzione della cellula: maggiori
sono le funzioni che deve svolgere e maggiore è la concentrazione di proteine presenti.
Fosfolipidi
Coda idrofobica
glicerolo che fa da ponte
Testa idrofilia -> gruppo fosfato + alcol
- Struttura micellare
- A doppio strato molecolare
I due strati della membrana hanno una diversa disposizione dei tipi di fosfolipidi ---> rafts --->
zone specifiche ---> specifici fosfolipidi e specifiche proteine -> trasmettono i segnali all’interno
della cellula -> microdomini del foglietto esoplasmatico costituiti da colesterolo e sfingolipidi
Colesterolo: si intercala tra le code dei fosfolipidi e contribuisce a stabilizzare le membrane; se è
presente in quantità eccessive irrigidisce la struttura e quindi deve essere altamente regolato.
Proteine di transmembrana
In ogni porzione gli aa che le costituiscono devono essere in grado di interagire con l’ambiente in
cui si trovano (polare o non polare); in caso di mutazioni anche piccole la proteina potrebbe
risultare per questo completamente alterata.
Proteine integrali
Posseggono una cosa capace di inserirsi nel doppio strato che la ancora alla membrana.
Spostamenti di fosfolipidi nel doppio strato:
- diffusione laterale -> rapida, avviene spesso e facilmente
- diffusione da un foglietto all’altro -> molto lenta, avviene difficilmente e con grande dispendio
di energia
Passaggio attraverso la membrana
Passano liberamente i gas, le piccole molecole non cariche, l’acqua (in tempi molto lunghi). Tutto
ciò che è carico o di grosse dimensioni da solo non passa.
Trasporto
Passivo
senza consumo di energia
secondo gradiente di concentrazione o elettrochimico
- diffusione semplice -> la molecola è in grado di passare il doppio strato fosfolipidico
- diffusione facilitata -> avviene secondo gradiente ma richiede un carrier
Attivo
Fornita da ATP (pompe)
richiede energia
Fornita da gradiente ---->
trasportano + di una proteina,
quella secondo gradiente rilascia E
utilizzata per trasporto contro
gradiente
avviene contro gradiente
Proteine di trasporto
Pompe: usano l’E ricavata dall’idrolisi dell’ATP per spostare ioni contro il gradiente di
concentrazione
Canali: trasportano H2O o specifici tipi di ioni secondo il gradiente di concentrazione. Le proteine
che li compongono formano canali che attraversano la membrana. Sono di solito regolati da
stimoli specifici.
Trasportatori: legano ioni o molecole specifiche. Il legame con la molecola trasportata provoca un
cambiamento conformazionale -> passaggio
Uniporter -> diffusione facilitata
Symporter + Antiporter -> trasporto attivo
symporter
antiporter
Pompe ATPasi
-> P
almeno due subunità (o quattro)
-> attiva, trasporto
-> regolazione
es. Na+/K+
-> F, V
molte subunità
trasportano protoni (H+)
F localizzate nei mitocondri: fanno entrare secondo gradiente gli H + e usano l’energia così
ricavata per generare ATP
V localizzate nelle vescicole (lisosomi ed endosomi): abbassano il pH pompando H + all’interno
delle vescicole
-> ABC
trasportano molte sostanze
buttano fuori una serie di sostanze dannose alle cellule (compresi i chemioterapici)
Pompa Na+/K+
Mantiene la ddp a cavallo della membrana
Nel citoplasma ci deve essere un’elevata concentrazione di K+ e una bassa concentrazione di Na+
Necessita di ATP -> ad ogni trasporto butta all’esterno 3 Na+ e all’interno 2 K+ per ogni ATP
Meccanismo: sito per l’ATP più tre siti ad alta affinità per Na+ e due siti con bassa affinità per K+
in condizioni di riposo. L’ATP fosforica la proteina e ne modifica la struttura. Essa si capovolge (o
apre canali) e si ritrova con i siti di legame all’esterno della cellula. L’affinità dei siti cambia
permettendo di rilasciare Na+ e catturare K+. Il gruppo fosfato viene staccato, la proteina si
ribalta nuovamente, il K+ viene liberato e si ritorna alla situazione di partenza.
Pompa Ca++
Mantiene bassa la concentrazione di calcio nel citoplasma perché questi ioni sono dei secondi
messaggeri e si trovano racchiusi all’interno del REL
La proteina ha due siti ad alta affinità per il Ca++ rivolti verso il citoplasma, gli ioni si legano,
l’ATP fosforica, la pompa si ribalta, si libera Ca++, si stacca il gruppo fosfato, la proteina si rigira.
Pompa F
Trasporta 3 H+ attraverso un canale (secondo gradiente) -> sviluppa energia che viene
recuperata sottoforma di ATP.
Pompa ABC
Presenta due regioni idrofobiche transmembrana e due regioni idrofiliche citoplasmatiche che
legano l’ATP.
Sono localizzate:
- nei batteri -> nella membrana plasmatici dove trasportano aa, zuccheri e peptici
- negli eucarioti
nel reticolo endoplasmatico dove trasportano peptici per la presentazione
antigenica
nella membrana plasmatici dove trasportano piccole molecole, fosfolipidi e
farmaci con struttura simile ai lipidi
Meccanismi possibili:
prende la sostanza presente sul versante citoplasmatico, la lega, si rovescia e libera la
sostanza
apre un canale che permette il passaggio della sostanza senza il ribaltamento
Sono presenti in grande quantità nel fegato -> la sostanza tossica arriva al fegato, viene
detossificata ed escreta con la bile
MDR
Canali -> fori nella membrana
All’esterno del canale c’è la presenza di aa non polari ma nel centro del canale aa polari per
permettere il passaggio di sostanze polari (grazie a ripiegamenti della catena). Normalmente il
canale è chiuso
-> ripiegamento della catena a formare un tappo che chiude il canale; per aprirlo avvengono
delle modificazioni della catena
-> regolazione tramite il voltaggio: fila di aa carichi + che tendono a stare verso la parte della
proteina che guarda verso il citoplasma -> tengono chiuso il canale. Depolarizzazione -> si
spostano verso l’esterno e aprono il canale
-> regolazione con neurotrasmettitore che, legandosi al sito di legame, apre il canale
Aquaporine -> canali selettivi che permettono solo il passaggio dell’acqua; sono presenti nelle
zone dove c’è necessità di un grosso riassorbimento (rene, polmone, ghiandole salivari e lacrimali,
SNC)
Il glucosio passa dalle cellule epiteliali al sangue grazie a degli uniporter, all’apertura di questi
canali.
Saturazione
Diffusione semplice
Diffusione facilitata
Nell’assorbimento intestinale, invece, il glucosio passa attraverso symporter
Sangue
Cellule epiteliali
GLU
Lume intestinale
GLU
uniporter
Na+
GLU
Na+
ATP
2 Na+
2 Na+
ADP + Pi
K+
K+
Na+/K+ ATPasi
Symporter
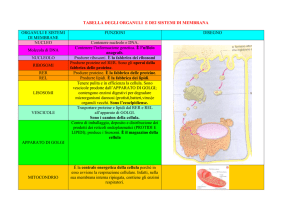
CITOSCHELETRO E FORME DI GIUNZIONE INTERCELLULARE
Proteine coinvolte
Actina
- una delle proteine più abbondanti della cellula
- monomero G-actina, polimero F-actina
- ogni monomero contiene uno ione Mg2+ complessato con ATP o ADP
- la G-actina polimerizza a formare F-actina in presenza di ioni divalenti, ma questo fenomeno è
reversibile
- durante la polimerizzazione l’ATP viene idrolizzato, ma questo influenza solo la velocità di
reazione
La G-actina viene assemblata in lunghi polimeri elicoidali di F-actina. Le subunità di G-actina
sono orientate tutte allo stesso modo. Si definisce estremità - quella in cui il sito per l’ATP è a
contatto con il citosol. Costituisce filamenti. Le proteine cross- linking si mettono a ponte tra i
filamenti di actina -> struttura stabile ma reversibile adatta a costituire il citoscheletro. Il network
di actina può essere in connessione con le proteine plasmatiche.
Miosina
Hanno testa, collo e coda. La testa aiuta nel movimento interagendo con i filamenti di actina; la
cosa ancora la miosina.
L’ATP si associa alla testa e provoca il distaccamento dal filamento di actina -> la testa si sposta e
si aggancia in un altro punto -> l’ATP viene idrolizzato -> il distaccamento del gruppo fosfato
provoca un movimento nella testa -> l’ADP viene rilasciato e si torna alla situazione di partenza
Microtubuli
- polimeri di subunità globulari (tubulina) con forma tubulare
- eterodimero di e tubulina; ognuna delle due subunità lega una molecola di GTP
- lega GTP in maniera irreversibile, idrolizza GTP in GDP
- GTP si trova all’interno del dimero, GTP si trova in superficie per consentire lo scambio tra
GDP e GTP
Costituiscono ciglia e flagelli (due) e cetrioli (tre). Quest’ultimi vanno a costituire il centro di
controllo dei microtubuli -> organizzano la gestione dei microtubuli all’interno della cellula. Sono
importanti anche nella formazione del fuso mitotico.
Assemblaggio e disassemblaggio avvengono preferenzialmente all’estremità +. Prima viene
assemblato il protofilamento
I microtubuli servono anche per i movimenti di vescicole ed organelli.
Chinesine e dineine
- fanno da ponte tra il microtubuli e la vescicola che viene trasportata
- le chinesine muovono verso l’estremità + dei microtubuli (trasposto anterogrado), le dineine
verso l’estremità ogni tipo di vescicola è trasportata da una chinesina specifica, specificità
determinata dalla coda della chinesina
- le dineine si legano ai loro carichi mediante proteine adattatrici
chinesine -> meccanismo attacco-stacco
Microtubuli e mitosi
-> ottenere una corretta separazione dei cromosomi:
i microtubuli si attaccano al cinetocore del cromosoma
Cinetocore = proteine specifiche con piastra interna (DNA) e piastra esterna (microtubuli)
Adesione fra cellule e fra cellule e matrice
I filamenti intermedi intervengono nella giunzione cellula-cellula; sono importanti per la
formazione dei vari organi -> sono diversi a seconda dell’organo e sono coinvolte nel processo di
riconoscimento tra cellule di diversi organi.
Proteine di transmembrana -> all’interno della cellula sono legate ai microtubuli
Tight junctions
Giunzioni strette con necessità di Ca2+; E. coli è in grado di aprirle
Presenti in serie
Zona aderente
-> caderine
costituiscono i desmosomi -> filamenti di cheratina (citoscheletro)
Gap junction -> canali tra una cellula e l’altra
-> connessine
- caderine -> legano solo tra di loro
-> coda citoplasmatica, nella membrana strutturale esterna
-> presenza di Ca2+
-> mediano l’adesione omofilica Ca2+ dipendente
- cam (neural - cell adhesion molecules) -> molecole di adesione cellulare
-> IgG
-> mucina
-> molecole per l’adesione cellulare Ca2+ indipendente
Il loro ruolo nel determinare l’adesione è meno importante delle caderine. Possono non avere
l’ancoraggio al di sotto del citoscheletro ma essere ancorate con code lipidiche
- selectine
Possono intervenire nella migrazione dei leucociti
- integrine -> giunzione tra cellule e matrice extracellulare -> si attaccano sia dentro sia fuori la
cellula con filamenti
adesioni focali
esmodesmosomi
interno
actina
cheratina
esterno
fibronectina
laminino
Gap junction
Canali selettivi per le dimensioni fino a 1000 Dalton
Importanti per la risposta sincrona da più cellule
Connessori costituiti da sei connessine -> ogni cellula forma metà canale
Regolazione: possono essere chiuse per evitare di trasferire sostanze tossiche -> >>Ca2+ <<pH ->
segno di morte imminente della cellula
Mutazioni delle connessine:
responsabili della sordità -> dominante o recessiva
Malattia di Charcot-Marie-Tooth, neuropatia demielinizzante del sistema nervoso centrale e
periferico
Membrana cellulare
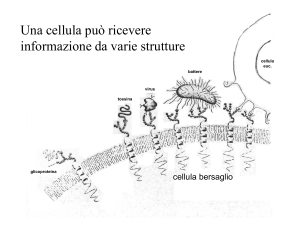
“Signaling” cellula-cellula
Sintesi e rilascio del segnale dalla cellula produttrice
Trasporto alla cellula “target”
Ricezione del segnale da parte della cellula “target” (recettori)
Traduzione del segnale all’interno della cellula “target” (da recettori ad altre proteine)
Risposta cellulare
1) Segnale endocrino: secrezione di un ormone che fa avvenire una risposta da cellule distanti
2) Segnale paracrino: secrezione e rilascio dell’ormone nello spazio extracellulare; risposta delle
cellule vicine
3) Segnale autocrino: la cellula produttrice è la cellula target -> feed-back
4) Segnale della membrana plasmatica: attraverso le giunzioni
Recettori intracellulari situati a livello del citoplasma -> la molecola che li colpisce attraversa
liberamente la membrana -> ormoni steroidei
Azione a livello del nucleo della cellula -> sintesi di proteine -> agisce sul nucleo facendo copiare in
mRNA una determinata sequenza genica -> sintesi (o inattivazione della sintesi)
Caratteristiche della risposta recettoriale
1) Interazione del ligando (ormone, fattore di crescita, neurotrasmettitore) con un recettore
posto sulla superficie cellulare
2) Vie di risposta interna simili con diverse caratteristiche in comune (protein-chinasi -> fosforila)
3) Svariate proteine bersaglio dell’attività protein-chinasica (enzimi del metabolismo, proteine
trasportatrici, proteine regolatrici)
A inattiva
B attiva
-----> A attiva
-----> B inattiva
Protein-fosfatasi -> defosforilano
Recettori situati sulla superficie
a) Accoppiati a proteine G
Ligando -> si lega al recettore -> attiva la proteina G -> agisce su altre proteine che generano un
secondo messaggero ed, essendo molto piccole, diffondono -> i secondi messaggeri trasferiscono
l’informazione all’interno della cellula (Ca2+)
b) Ioni canale
Ligando -> si lega al recettore -> permette l’apertura del canale -> passaggio di ioni
c) Recettori legati a tirosin-kinasi (fosforilano dove c’è la tirosina)
Recettore costituito da due subunità poste in vicinanza ma inattive e tirosin-kinasi inattive -> il
ligando si mette a ponte tra le due subunità -> il recettore dimerizza -> attivazione della kinasi ->
fosforilazione delle proteine -> attivazione o inibizione
d) Recettori con attività enzimatica intrinseca
Ligando -> si lega al recettore -> la parte intracitoplasmatica:
1) funge da enzima -> trasforma GTP in cGMP (secondo messaggero)
2) ha funzione chinasica -> fosforila
a) G-proteins
Proteine costituite da tre subunità:
-> lega ed idrolizza il GTP
-> sito attivo
-> attiva le proteine a valle -> adenilato ciclasi (trasforma l’ATP in cAMP)
, -> ancorano la proteina G alla membrana (tramite ) e mantengono inattiva la catena
Esistono anche proteine G inibitorie
1 -> lega ed idrolizza il GTP, inibisce l’adenilato ciclasi
G-protein attivante la fosforilasi C- che trasforma dei fosfolipidi di membrana in secondi
messaggeri
Il recettore che attiva la proteina G è costituito da:
-> una parte esterna che lega il ligando
-> dei domini transmembrana
-> una zona interna che va ad interagire con la proteina G
Avviene un cambiamento conformazionale del recettore ad opera del ligando che modifica la
struttura della zona intercellulare -> attivazione della proteina G si sostituisce GDP con GTP ->
distacco delle subunità e -> attivazione dell’adenilato ciclasi -> ATP -> cAMP + ppi
Tutte queste molecole sono presenti in un raft lipidico
Successivamente la subunità idrolizza il GTP -> si riforma la struttura trimerica -> viene
bloccata l’attività della subunità
L’adenilato ciclasi ha prodotto l’AMP ciclico che attiva l’A-kinasi (presente nel citoplasma o
legata alla membrana) -> protein-kinasi dipendente dal cAMP presente in forma inattiva grazie
a subunità regolatorie alle quali si lega l’cAMP -> le subunità si staccano -> si attiva la proteinkinasi A -> va nel nucleo a fosforilare proteine che regolano la trascrizione dei geni
Può attivare un ligando che attiva un recettore che, a sua volta, attiva una proteina G inibitoria
sullo stesso adenilato ciclasi.
Ligandi di questa cascata -> glucagone, ACHT, eparina
-> ad es. rilascio glucosio
Secondi messaggeri: cAMP, cGMP, 1,2-diacilglicerolo (DAG), inositolo 1,4,5-trifosfato (IP3), Ca2+
DAG (idrofobica) e IP3 (idrofilica) sono costituenti dei fosfolipidi
La fosfolipasi C agisce su un fosfolipide di membrana spaccandolo in due:
la fostatidilinositolo kinasi fosforila in posizione 4, poi 5 (1 a ponte con glicerolo)
la fosfolipasi può funzionare -> diacilglicerolo che resta nella membrana
-> IP3 che va nel citoplasma
IP3, nel citoplasma, agisce su canali specifici a livello del REL, aprendoli, il Ca2+ immagazzinato nel
REL passa nel citoplasma secondo gradiente di concentrazione
-> fuoriuscita di Ca2+ nel citoplasma
Attiva la Pkc e provoca un suo spostamento verso la membrana plasmatica dove interagisce con
il DAG
L’attivazione di Pkc avviene attraverso
La liberazione di ioni calcio (C2)
Il suo movimento verso la membrana
L’interazione con DAG (C1A – C1B)
DAG va ad interagire sulla cascata delle MAP kinasi va ad agire a livello nucleare
provocando la trascrizione di determinati geni
Fosfolipasi A2 -> interviene nel ciclo dell’ac. arachidonico che è un precursore dei mediatori
dell’infiammazione (convertito tramite lipo ossigenasi o ciclo ossigenasi in mediatori
dell’infiammazione gli antinfiammatori non steroidei agiscono su questi due enzimi) -> agisce
sulla Pkc, sulla fosfolipasi C e sulla liberazione di ioni calcio.
Le citochinine hanno un ruolo essenziale nei processi infiammatori e nella risposta immunitaria.
Il calcio liberato va ad interagire con la calmodulina -> può legare al massimo 4 ioni calcio -> il
legame provoca un cambiamento conformazionale della proteina, attivandola -> in grado di
legare (e quindi attivare) la cAMP fosfodiesterasi, un enzima che degrada il cAMP -> “spegne” il
segnale -> meccanismo di controllo -> azione contraria rispetto all’adenilato ciclasi -> INSERZIONE
TRA LE DUE VIE
Ossido nitrico (NO) -> prodotto secondario derivato dalla conversione dell’L-arginina in Lcitrullina da parte di enzimi chiamati nitric oxide sinthase (NOS)
Arginina + O2 -NOS-> citrullina + NO
- n NOS neuronale
produzione di
- e NOS endoteliale (tono dei vasi)
NO costante
- i NOS inducibile (infiammazione)
poco espresso, dopo stimolo
Azione intracellulare di NO
attivazione di fattori trascrizionali (proteine che agiscono sul DNA)
interazione con proteine contenenti Fe -> emoglobina, proteine della catena di trasporto
degli e legame con radicali liberi
La calmodulina si va a legare anche al NOS -> produzione di NO -> nelle cellule endoteliali ->
diffonde nelle cellule muscolari lisce che regolano il tono dei vasi -> agisce sulla guanilato ciclasi
(che contiene Fe) -> da GTP a cGMP
Recettori che si legano a proteine che hanno attività kinasica
Recettore costituito da due subunità -> il ligando lo dimerizza -> attivazione Pk che vanno a
fosforilare lo stesso recettore a cui sono state legate (l’altra subunità del recettore) -> nella sua
porzione intracitoplasmatica. Alla zona fosforilata si vanno ad attaccare degli adattatori ->
ponte tra recettore e proteine che attiveranno la cascata a valle.
Domini degli adattatori
- SH2 -> consente il legame alle tirosine fosforilate
- SH3 -> interagisce con altre proteine per la trasduzione del segnale
Gli adattatori vanno ad interagire con RAS che, se è legato con GTP è attivo, con GDP è inattivo;
esso agisce attraverso le MAP kinasi ed è stato il primo oncogene scoperto (se mutato).
GAP -> GTPase activactina protein -> stimola l’idrolisi di GTP
GNRP (GEF) -> Guanine nucleotide releasing protein -> fa rilasciare GDP da RAS
In condizioni patologiche RAS non è in grado di idrolizzare GTP -> la cascata successiva porta alla
duplicazione cellulare -> se patologica -> tumori
Differenti recettori possono concorrere attraverso vie diverse per arrivare allo stesso scopo.
I fattori di trascrizione possono anche essere presenti nel citoplasma -> in forma inattiva che una
volta attivati da una kinasi migrano nel nucleo.