How can you explain human
complexity when we have so
few protein coding genes,
e.g. about 5,000 less than a
cucumber?
Isabella Ceccherini
UOC Genetica Medica, IGG
17 Febbraio2015
C-value* paradox
non vi è relazione tra il C-value di un organismo e la sua
complessità biologica
* C-value=quantità di DNA in un set aploide
G-value* paradox
non vi è relazione tra il G-value di un organismo e la sua
complessità biologica
C. elegans = 959 o 1031 cellule ma stesso
numero di geni che nell’uomo
Pulce d’acqua e afide del pisello = molte
migliaia di geni più che nell’uomo (≥35.000)
* G-value=numero di geni presenti in un corredo aploide
Perché organismi tanto semplici
necessiterebbero di tanti geni?
1.
Pressione selettiva per l’adattamento a
ambienti e predatori diversi
2.
Espansione di famiglie di geni tipicamente
coinvolti nella risposta a stimoli ambientali
es.: roditori hanno più recettori olfattivi
(cambio adattativo), primati hanno più geni
codificanti miRNA (hanno contribuito allo
sviluppo cerebrale)
Come fanno organismi tanto
complessi con un numero di geni
relativamente basso?
Se non è il numero di geni il
determinante primario della
complessità di un organismo, cosa è
allora?
Proporzione di DNA non codificante, aumenta
dai Metazoi semplici a quelli complessi (es.: da
75Mb in C. elegans a 3070Mb nell’uomo)
Tra il DNA non codificante si trovano aumentate:
- le regioni non tradotte di geni codificanti proteine
(5’ UTR e 3’ UTR), sede di sequenze regolatorie
- le regioni altamente conservate (es.: si equivalgono
alla porzione codificante in Drosophila, 4 volte la
porzione codificante nell’uomo)
Splicing alternativo, raro nei Metazoi semplici
ma presente nella maggioranza (>80%) dei
geni umani
Poliadenilazione alternativa
Regolazione
dell’espressione
genica
considerata quale responsabile di molte
delle differenze fenotipiche tra specie
comparando l’espressione genica genome-wide in
tessuti equivalenti da DNA umani e da DNA di
primati non umani è emerso che sono i geni
codificanti fattori di trascrizione quelli che mostrano
con più alta probabilità differenze tra le due specie
Cellule
umane
specializzate
mostrano
patterns
distinti di
espressione
genica
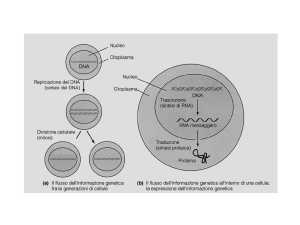
La regolazione dell’espressione
genica prevede il coordinamento di
una serie di eventi che
dall'attivazione della
trascrizione di un gene, conducono
alla produzione della proteina
corrispondente.
Il controllo di questi processi è
molto fine e la sua complessità
aumenta salendo lungo la scala
evolutiva.
Check points
Modificazioni post-trascrizionali
dell’RNA
I geni sono inizialmente trascritti come lunghi
mRNA precursori che vanno incontro ad una
serie di modificazioni nucleari (aggiunta del
5’cap, poliadenilazione e splicing) prima di
essere esportati nel citoplasma.
Splicing alternativo
(AS) dell’RNA
Permette ad un singolo gene di
codificare isoforme multiple di
trascritti, un modo per generare
diversità funzionale nel proteoma
cellulare
Avviene in quasi ogni gene umano
e, mentre in alcuni casi deriva da
imprecisioni nel complesso
macchinario, in numerosi altri è
chiaramente funzionale
Meccanismo dello splicing
Nei Vertebrati gli esoni sono molti più corti degli introni.
Prima che gli introni vengano rimossi dal trascritto primario, ogni
esone è inizialmente riconosciuto da fattori proteici.
Meccanismo dello
splicing
Meccanismo dello
splicing
Meccanismo dello
splicing
“U” factors: small nuclear ribonucleoprotein particles (snRNPs)
In funzione dello splicing si possono avere 4 tipi di esoni
Splicing
alternativo
(AS) dell’RNA
Lo spliceosoma si assembla in
base al bilanciamento tra fattori
proteici che lo promuovono e
fattori proteici che lo
sopprimono. Tali fattori
possono avere una diversa
distribuzione tissutale. Inoltre, i
siti di splicing stessi possono
essere deboli o forti; gli esoni
alternativi possiedono siti di
splicing più deboli
Controllo dello
splicing alternativo
Controllo dello
splicing alternativo
Binding of U2 snRNP to the branch site is promoted by the binding of an alternating arginine/serine (RS)
domain-containing factor (U2AF) to the polypyrimidine tract (PPT). The large RS domain protein (green
oval) represents an SR-related splicing coactivator protein that serves to bridge crossintron, and possibly
crossexon, interactions involving snRNPs and ESE bound SR proteins.
Risultati dello splicing alternativo
Insieme ad esoni alternativi si possono
introdurre:
codoni di stop prematuri*,
frameshifts*,
siti per modificazioni post-traduzionali
siti per la localizzazione subcellulare
* Splicing alternativo & evoluzione
Legano l’apparizione e la moltiplicazione degli introni nei genomi
agli effetti benefici del “nonsense mediated decay” (NMD): NMD
avrebbe agito come selezionatore degli introni di nuova insorgenza,
permettendo che rimanessero nei genomi solo quelli non deleteri
Osservano che l’AS e l’NMD sono strettamente accoppiati. Infatti
riportano che 1/3 delle varianti AS che esaminano contengono PTCs
(premature truncating codons), ossia sono targets di NMD. Questo
fenomeno non va visto come uno spreco cellulare ma piuttosto come
mezzo per le cellule di regolare l’espressione genica a livello posttrascrizionale in una maniera tempo– e tessuto-specifica
Risultati dello splicing alternativo
Insieme ad esoni alternativi si possono
introdurre:
codoni di stop*,
frameshifts*,
siti per modificazioni post-traduzionali
siti per la localizzazione subcellulare
Alcuni recettori di membrana hanno
isoforme di membrana e isoforme solubili a
seconda dell’inclusione o meno di un
dominio TM
Due diverse isoforme possono competere,
ad esempio per un ligando, determinando
conseguenze funzionali
Un gene
alternative splicing
più prodotti genici
splicing alternativo della Tropomiosina
Lo splicing alternativo può aver generato durante l’evoluzione nuovi geni
con nuove combinazione di esoni che specificherebbero per domini diversi
a partire dalla ricombinazione tra introni di geni diversi
Risultati dello splicing alternativo
AS può anche risultare in:
diverse sequenze al 5’UTR e 3’UTR
diversi segnali di poliadenilazione
in esoni alternativi
5’UTR è principalmente coinvolto nel controllo della
traduzione. 3’UTR regola aspetti multipli del
metabolismo dell’mRNA (esporto nucleare,
localizzazione citoplasmatica, efficienza della traduzione
e stabilità dell’mRNA)
Gli mRNA acquisiscono
una coda di poli(A)
all’estremità 3’terminale in un
processo noto come
poliadenilazione
Uso alternativo di 3’UTR e di siti di poliadenilazione genera
un altissimo grado di variabilità di isoforme
≤1/3 geni
≥2/3 genei
Poliadenilazione costitutiva: il gene contiene solo un sito poli(A)
Regione codificante non tradotta (UTR)-APA: il gene contiene siti poli(A)
multipli localizzati nel 3’UTR. APA risulta in mRNAs con diverse lunghezze
del 3’UTR, ma che producono la stessa proteina
Regione codificante (CR)-APA: il gene contiene siti poli(A) aggiuntivi
localizzati in esoni e introni. APA risulta in mRNAs con diversi 3’UTRs and
regioni codificanti C-terminali, che producono isoforme proteiche distinte
Pattern di poliadenilazione in diversi contesti cellulari
Sito poli(A) prossimale, normalmente non-canonico e debole. Usato
durante
la proliferazione,
e trasformazione
Siti di legame
per diversidedifferenziamento
fattori di trascrizione
coinvolti nella cellulare,
proliferazione/differenziamento
(E2F, c- myc, and p53) si trovano
quando
fattori PA up-regolati
arricchiti nei promotori di geni codificanti per fattori di poliadenilazione
Sito poli(A) distale, normalmente canonico e forte. Usato durante il
differenziamento, quando fattori PA down-regolati
CITOPLASMA
mRNA nel citoplasma
Degradazione
dell’mRNA
traduzione
Polipeptide
Processamento della
proteina (es. Cleavage,
modificazioni chimiche)
Degradazione
della proteina
Proteina attiva
Trasporto alla
destinazione cellulare
Funziuone cellulare (es.
attività enzimatica,
supporto strutturale)
Ulteriori Controlli Posttrascrizionali
Stabilità dell'RNA
Inibizione della traduzione di
RNA specifici
Regolazione dell'efficienza
della traduzione
Controllo della localizzazione
citoplasmatica degli RNA
Ancora un supplemento di spiegazione nelle
prossime diapositive ………
La concentrazione di un mRNA è una funzione del suo
grado di sintesi e di degradazione
Quando la sintesi è favorita, l’mRNA resterà disponibile più a lungo per essere tradotto,
risultando in un più alto livello di prodotto genico
La stabilità degli RNAs è regolata fa fattori che agiscono in trans come proteine che legano gli
mRNA, miRNA e lncRNA
Tutti questi fattori sono regolatori genici post-trascrizionali che legano gli mRNA e possono
regolare sia la stabilità dei trascritti che la loro traduzione
Regolazione della
stabilità dell’mRNA
della caseina
Elementi AU-rich (AREs) sono
elementi destabilizzanti che
agiscono in cis (cis-acting),
localizzati nel 3’UTR di una varietà
di mRNAs a vita corta come quelli
per le citochine e i protooncogeni.
AREs sono riconosciuti da fattori
trans-acting alcuni dei quali
promuovono mentre altri
inibiscono la deadenilazione e la
degradazione degli mRNA
Meccanismi di localizzazione
dell’mRNA e traduzione
controllata dal
rimodellamento del 3’UTR
I trascritti maturi vengono esportati dal
nucleo e una volta giunti nel citoplasma:
se l’mRNA è attivamente tradotto, la
coda di poli(A) è progressivamente
scorciata ad una velocità specifica per
ciascun mRNA, determinante la sua
emivita
gli mRNAs che devono essere silenziati
(non tradotti) sono deadenilati,
“decapped “ e avviati all’ mRNA decay
La selezione dei siti poli(A) genera isoforme di mRNA con
diversa localizzazione subcellulare e funzione
Eventi nucleari (a) e/o citoplasmatici (b) inducono il
rimodellamento del 3’UTR e influenzano la traduzione di
isoforme specifiche
In alcuni casi, gli mRNAs che devono
essere mantenuti in uno stato dormiente
vengono deadenilati e vanno incontro a
poliadenilazione citoplasmatica
successivamente, ossia quando tornano
ad essere traducibili
Esempi di sintesi proteica locale in neuroni di mammifero
Segnali-guida attrattivi o repulsivi
dirigono la crescita assonale attraverso
riarrangiamenti del cono di crescita. Il
riarrangiamento del citoscheletro è
indotto, almeno in parte, da traduzioni
locali di b-actin (ACTB) o RHOA mRNAs
Una isoforma del BDNF con un lungo
3’UTR è trasferita ai dendriti e la sua
traduzione in loco è necessaria per
manifestare i suoi effetti sulla sfrondatura
e la morfologia delle spine dendritiche,
oltre che per la plasticità sinaptica
Modificazioni della cromatina
trascrizione
Ulteriori Controlli
Post-trascrizionali
Processamento dell’RNA
degradazione
dell’mRNA
traduzione
Processamento e
degradazione
delle proteine
Degradazione dell’mRNA
ogni mRNA ha una
caratteristica emi-vita,
determinata in parte da
sequenze al 5’UTR e 3’UTR
Traduzione
L’iniziazione della traduzione può essere controllata
mediante la regolazione dei fattori di inizio
Processamento e degradazione delle proteine
Anche il processamento e la
degradazione delle proteine
mediante proteasoma (UPS) sono
soggetti a regolazione
Cytoplasmic
Polyadenylati
on Promotes
Translation in
Some mRNAs
In immature oocytes,
many mRNA containing U
rich and short poly (A) are
inactive for translation.
These mRNAs have to be
polyadenylated in the
cytoplasm before they can
be activated for translation.
The best-characterized cytoplasmic polyadenylation element, CPE, whose consensus U(4–
5)A(1–2)U is highly conserved, binds the CPE binding protein (CPEB) and recruits its interacting
partners, the poly(A) ribonuclease (PARN) and the poly(A) polymerase GLD2.
As PARN activity is higher than GLD2, in the cytoplasm, the poly(A) tails of CPE-containing
RNAs are shortened and translation is repressed. Extracellular stimuli that activate protein
synthesis induce phosphorylation of CPEB, resulting in dissociation of PARN from the
ribonucleoprotein complex and GLD2-dependent elongation of mRNA poly(A) tails