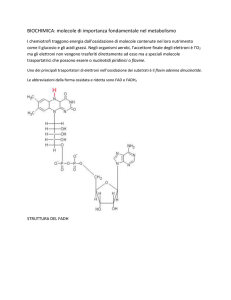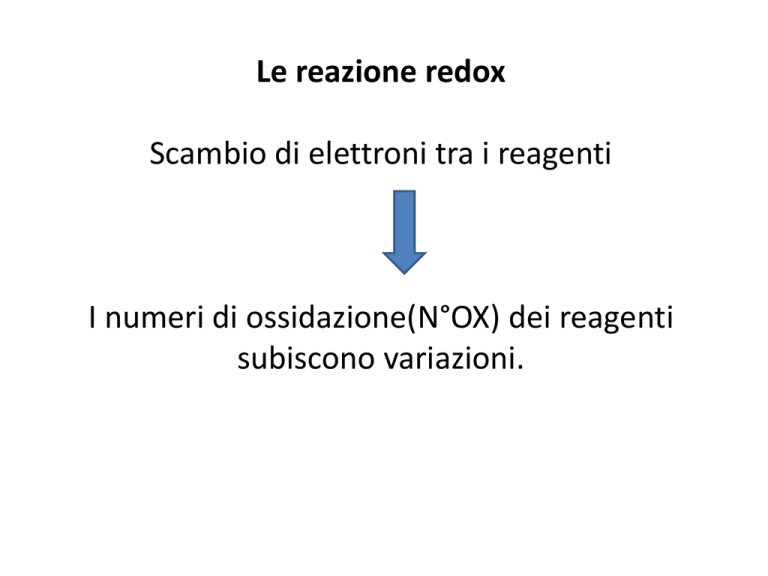
Le reazione redox
Scambio di elettroni tra i reagenti
I numeri di ossidazione(N°OX) dei reagenti
subiscono variazioni.
Ossidazione: perdita di elettroni dapartedi un reagente.
(il NOX aumenta)
Riduzione: guadagno di elettroni da parte di un reagente.
(NOX diminuisce)
Agente Ossidante: sostanza cheaccetta gli elettroni.
Agente Riducente: sostanza checede gli elettroni.
Le reazioni di ossidoriduzione sono quelle reazioni in cui si
ha uno scambio di elettroni tra due specie chimiche; una
specie subisce una reazione di ossidazione, l'altra subisce una
reazione di riduzione.
Reazione di ossidazione
La reazione di ossidazione è una reazione in cui una specie
chimica, atomo o ione perde elettroni. Il suo numero di
ossidazione aumenta.
Fe → Fe2+ + 2 e(NB e- è il simbolo dell'elettrone che ha carica negativa)
Reazione di riduzione
La reazione di riduzione è una reazione in cui una specie
chimica, atomo o ione acquista elettroni. Il suo numero di
ossidazione diminuisce.
2H+ + 2 e- → H2
Se in una reazione chimica un elemento si ossida perdendo
elettroni, dovrà esistere un altro elemento che, acquistando
gli elettroni, si riduce. Pertando le reazioni di ossidazione e di
riduzione devono avvenire contemporaneamente.
Si parla quindi di reazioni di ossidoriduzione
o di reazioni redox.
Come si riconoscono le reazioni di ossidoriduzione
Un modo semplice per riconoscere le reazioni redox è quello
di osservare se vi è variazione del numero di ossidazione di
due differenti elementi. Infatti, se vi è variazione del numero
di ossidazione, la reazione è di ossidoriduzione.
Consideriamo la reazione tra ioduro di potassio e bromo:
2 KI + Br2 → 2 KBr + I2
Seguendo le regole per attribuire il numero di ossidazione, si ha che:
lo iodio I in KI ha numero di ossidazione -1, mentre in I2 ha numero di
ossidazione 0.
-1 → 0
Il numero di ossidazione di I passa da -1 a 0, il suo numero di
ossidazione aumenta. KI quindi si ossida ed è una sostanza riducente.
Il bromo in Br2 ha numero di ossidazione 0, mentre in KBr ha numero di
ossidazione -1.
0 → -1
Il numero di ossidazione di Br passa da 0 a -1, il suo numero di
ossidazione diminuisce. Br2 quindi si riduce ed è una sostanza ossidante.
In questa reazione vi è variazione del numero di ossidazione di due
differenti elementi, si tratta quindi di una reazione redox.