Acidi carbossilici
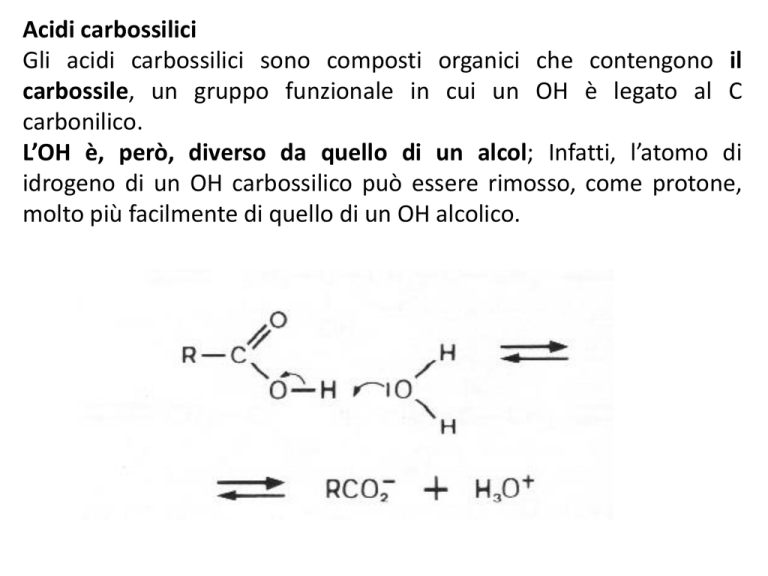
Gli acidi carbossilici sono composti organici che contengono il
carbossile, un gruppo funzionale in cui un OH è legato al C
carbonilico.
L’OH è, però, diverso da quello di un alcol; Infatti, l’atomo di
idrogeno di un OH carbossilico può essere rimosso, come protone,
molto più facilmente di quello di un OH alcolico.
Effetto induttivo.
L’acidità non cambia in modo significativo con le dimensioni del gruppo alchilico legato
alla funzione carbossilica.
L’acidità di un acido aumenta quando nella molecola sono presenti atomi elettronattrattori (EA). Un sostituente elettron-attrattore, come l’atomo di cloro, attrae gli
elettroni del legame C-Cl impoverendone l’atomo di carbonio a cui esso è legato e anche
gli atomi di carbonio vicini. Il risultato finale è quello di sottrarre elettroni al carbossile e di
stabilizzare conseguentemente l’anione carbossilato. Quest’ultimo risulta così una base
più
debole
ed
il
suo
acido
coniugato
un
acido
più
forte.
Quest’effetto, chiamato induttivo, diminuisce rapidamente con l’aumento del numero di
legami interposti tra il sostituente e il carbossile.
Proprietà fisiche Acidi carbossilici
Gli acidi carbossilici a basso peso
molecolare
hanno
punti
di
ebollizione relativamente alti, sono
molto solubili in acqua ed esistono
come dimeri, persino in fase
vapore. Infatti, il carbossile
partecipa sia come donatore sia
come accettore ad un’estesa “rete”
di legami idrogeno. Gli acidi
carbossilici che non presentano
altri gruppi funzionali ed hanno
nella catena meno di dieci atomi di
carbonio sono liquidi a temperatura
ambiente,
gli
altri
sono
generalmente solidi. Gli acidi
monocarbossilici a basso peso
molecolare
sono
totalmente
solubili in acqua, aumentando il
peso molecolare, la solubilità
diminuisce.
Il carbonile della funzione carbossilica è meno reattivo del
carbonile di aldeidi e chetoni.
Per questa ragione molti composti che reagiscono facilmente con
aldeidi e chetoni danno reazioni più lente, o reagiscono solo in
presenza di catalizzatori, con i derivati di acidi carbossilici.
Derivati degli acidi carbossilici
Nei derivati degli acidi carbossilici l’ossidrile è sostituito da atomi o gruppi
atomici diversi:
•in un cloruro acilico, un atomo di cloro;
•in un’anidride, l’anione di un secondo acido carbossilico;
•in un estere, un gruppo alcossile;
•in un’ammide, il gruppo amminico (e pertanto si parla di ammidi 1e, 2e e 3e a
secondo del numero di atomi di carbonio legati all’atomo di N).
Il nitrile
Un caso particolare
I nitrili sono composti che contengono il gruppo ciano, C≡N.
Pur non aderendo a quella che è la formula generale dei derivati degli
acidi carbossilici, sono considerati tali in quanto per idrolisi forniscono
le ammidi e poi gli acidi carbossilici.
Nomenclatura: Acidi carbossilici
Acido carbossilico alchilico:
si fa derivare dall’idrocarburo con lo stesso numero di atomi di
carbonio nella catena, sostituendo la desinenza -o con il suffisso -oico
e premettendo al nome così ottenuto la parola acido.
La catena è numerata a partire dal carbonio del carbossile, che per
sua natura è terminale, e la presenza di eventuali altri sostituenti è
indicata assegnando il nome e il numero della posizione di ciascuno.
I primi due acidi carbossilici, l’acido metanoico e l’acido etanoico, sono
indicati comunemente con i nomi d’uso, rispettivamente acido
formico ed acido acetico.
Acidi carbossilici aromatici:
il carbossile è legato direttamente all’anello aromatico. Quando il
carbossile è legato ad un cicloalcano si sostituisce la -o finale del
nome dell’idrocarburo ciclico con la desinenza –carbossilico.
Acidi carbossilici:
Il gruppo carbossilico –COOH è il gruppo funzionale degli
acidi carbossilici, che hanno formula generale R-COOH.
Secondo la nomenclatura ufficiale il nome dell’acido si
ottiene da quello del corrispondente idrocarburo
cambiandone la desinenza in –oico:
H-COOH acido formico (acido metanoico)
CH3-COOH acido acetico (acido etanoico)
CH3-CH2-COOH acido propionico (acido propanoico)
CH3-CH2-CH2-COOH acido butirrico (acido butanoico)
CH3-CH2-CH2-CH2-COOH acido valerianico (acido pentanoico)
Gli atomi di carbonio della catena possono essere indicati
con i numeri arabi, assegnando la posizione 1 al
carbossile, o con le lettere dell’alfabeto greco
assegnando la posizione alfa al carbonio adiacente al
carbossile
Acidi carbossilici:
• acidi a catena breve (<4C)
• intermedia (4-10C)
• lunga (11-20)
• molto lunga (>20C)
Gli acidi carbossilici a lunga catena (>10C)
sono detti acidi grassi
Nomenclatura (segue)
Gruppi acilici e cloruri
Il nome del gruppo acile si fa derivare da quello dell’acido corrispondente, sostituendo la
desinenza -ico con –ile.
Per indicare il gruppo acile degli acidi nel cui nome è utilizzata la dizione -carbossilico,
quest’ultima viene trasformata in -carbonile.
I cloruri degli acidi carbossilici sono indicati sistematicamente come cloruri di acile.
Nomenclatura (segue)
Anidridi
L’anidride conserva il nome dell’acido corrispondente, avendo
sostituito la -o finale con una -a e la parola acido con anidride.
Tra le anidridi, sono importanti l’anidride acetica ed alcune anidridi
cicliche che derivano da acidi dicarbossilici.
Le anidridi cicliche con anelli a cinque e a sei atomi sono stabili e si
formano facilmente dagli acidi dicarbossilici.
Nomenclatura (segue)
Ammidi, immidi e nitrili.
Ammidi:
si ottiene da quello degli acidi carbossilici omettendo la parola “acido”
e sostituendo la desinenza -oico (o -ico per i nomi d’uso) con -ammide,
oppure la desinenza -carbossilico con -carbossiammide.
Se l’atomo di azoto di un’ammide è legato a sostituenti alchilici, il
nome dell’ammide si fa precedere dalla maiuscola N-, per indicare la
sostituzione sull’azoto, seguita dal nome dei gruppi alchilici.
Se il sostituente sull’atomo di azoto di un’ammide è un fenile, si
sostituisce la desinenza del nome dell’acido carbossilico con -anilide.
si usa il suffisso -immide nel caso delle ammidi cicliche in cui i due
gruppi acilici sono legati allo stesso atomo di azoto.
Nitrili:
si aggiunge il suffisso -nitrile direttamente al nome dell’idrocarburo che ha lo stesso numero
di atomi di carbonio, compreso l’atomo di carbonio del gruppo ciano.
Se sono presenti altri gruppi funzionali, il gruppo ciano è considerato come sostituente ed
indicato con il nome -ciano
Nomenclatura (segue)
Sali ed esteri
Si ottiene omettendo dal nome dell’acido carbossilico la parola
“acido” e:
per un sale si sostituisce la desinenza -ico (anche nei nomi d’uso)
con il suffisso -ato di, cui segue il nome del catione,
per un estere si sostituisce la desinenza -ico con il nome del residuo
organico legato all’ossigeno del carbossile.
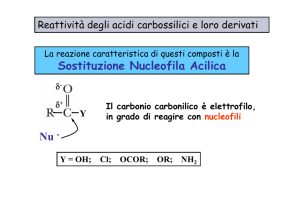
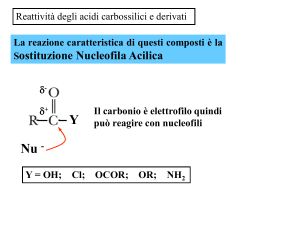
Sostituzione nucleofila acilica (SNA)
Il C del CO è elettrofilo. Perciò gli acidi carbossilici, ma molto meglio i loro derivati,
danno reazioni di sostituzione nucleofila. Esse avvengono in due stadi:
1.attacco nucleofilo al carbonio carbonilico, con conseguente formazione di un
intermedio tetraedrico;
2.eliminazione di un gruppo uscente, con ripristino del carbonile.
Reattività dei derivati
Scala di reattività
I derivati degli acidi carbossilici presentano una reattività diversa
nelle reazioni di sostituzione nucleofila.
Tale reattività nei confronti delle reazioni di sostituzione nucleofila
al carbonio carbonilico diminuisce nell’ordine riportato di fianco.
Essa è direttamente proporzionale all’effetto di stabilizzazione per
risonanza.
Idrolisi
Tutti i derivati acilici reagiscono con l’acqua, reagente
nucleofilo, per dare i corrispondenti acidi carbossilici.
In particolare, i cloruri acilici reagiscono con H2O molto
rapidamente formando l’acido corrispondente ed HCl come
sottoprodotto.
Le anidridi, sebbene meno reattive, reagiscono con la stessa
rapidità
e
formano
anch’esse
l’acido
carbossilico
corrispondente.
Saponi
L’idrolisi di un estere in condizioni basiche è definita reazione di
saponificazione in quanto è appunto utilizzata nella produzione dei
saponi. In passato il sapone si produceva a livello casalingo facendo
bollire i residui grassi dei cibi con cenere di legna che costituisce una
sorgente di idrossido di potassio. I saponi sono, quindi, sali sodici o
potassici di acidi grassi, mescolati a glicerolo.
Acidi bicarbossilici saturi
Contengono nella loro molecola due gruppi carbossilici.
Alcuni acidi bicarbossilici saturi di interesse in biologia:
Acido ossalico
HOOC-COOH
Acido malonico HOOC-CH2-COOH
Acido succinico HOOC-CH2-CH2-COOH
Acido glutarico HOOC-CH2-CH2- CH2-COOH
Acidi tricarbossilici
Acidi bicarbossilici insaturi
Es: acidi fumarico e maleico
isomeria geometrica o isomeria cis-trans