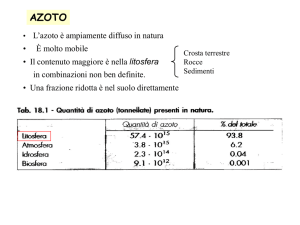
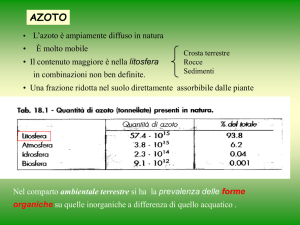
Metabolismo dell’azoto
Tutti gli organismi sono capaci di convertire l’ammoniaca in
composti organici azotati cioè sostanze contenenti legami C-N
Sono molto meno gli organismi in grado di sintetizzare
ammoniaca a partire da N inorganico, cioè l’azoto molecolare
(N2), costituente principale dell’atmosfera terrestre, e lo ione
nitrato (NO3 –), presente nel suolo ed essenziale per le piante
Il primo processo di riduzione dell’N2 in NH4 + è detta
FISSAZIONE BIOLOGICA DELL’AZOTO, ed è svolta da
particolari microrganismi in simbiosi o meno con piante
Il secondo processo di RIDUZIONE DEI NITRATI presenti nel
suolo è ampiamente diffuso sia in piante che microrganismi
Nella biosfera c’è un costante equilibrio tra l’azoto
totale inorganico e quello organico
La conversione dell’azoto dalla forma organica,
attraverso la fissazione biologica o la riduzione dei
nitrati, è controbilanciata dal catabolismo e cioè
dalla
DENITRIFICAZIONE
e
dalla
DECOMPOSIZIONE
Il catabolismo produce ammoniaca e altri
composti organici azotati che possono essere
metabolizzati da diversi batteri:
Nitrosomonas ossida l’ammoniaca a nitrito
Nitrobacter ossida il nitrito a nitrato
I batteri denitrificanti
l’ammoniaca a N2
catabolizzano
invece
Gli animali eterotrofi utilizzano azoto già
contenuto in molecole organiche vegetali. Essi poi
utilizzano i "mattoni" per la costruzione delle
proprie proteine
Al contrario delle piante, gli animali effettuano
l'escrezione di N sotto forma di urea ed acido
urico. Da queste molecole può essere nuovamente
liberata NH3 per attività della ureasi (batteri,
terreno, piante)
NH3 si forma anche in processi di putrefazione
Nel terreno è presente NH3 sotto forma di NH4+
assorbita dai colloidi
Fissazione dell'azoto atmosferico
Dando uno sguardo al ciclo dell'azoto è chiaro che
l'azoto fissato in forma inorganica (nitrati ed
ammoniaca) ed organica tende, attraverso vari
processi, a ritrasformarsi in N2
Occorre pertanto un processo contrario che renda
l'N2 atmosferico di nuovo disponibile per le piante
(riduzione dell'N2 a NH4+). Questo avviene attraverso
la
FISSAZIONE
BIOLOGICA
DELL’AZOTO
ATMOSFERICO
Secondo una stima, la fissazione dell'N2 ammonta
annualmente a 9x1010 Kg
La fissazione dell’N2 è prerogativa esclusiva di alcuni batteri
ed alcune specie di alghe blu, liberi o in simbiosi con piante
superiori
I microrganismi fissatori si distinguono a seconda della
pianta ospite:
1° gruppo:
Leguminose
Queste piante ospitano nei tubercoli radicali una forma
degenerata del Rhizobium (come batteroide)
Inizialmente si pensava che si trattasse di una malattia, in
quanto no era nota la capacità di fissazione dell’azoto
atmosferico
Esiste una stretta associazione metabolica fra la pianta
ospite ed il Batteroide. Né il Rhizobium né la pianta sono in
grado da soli di fissare l'N2
Non si conoscono i fattori che attraverso la simbiosi
consentono al Batteroide di fissare l'N2
2° gruppo: non Leguminose
Anche in angiosperme e gimnosperme si trovano
microrganismi in tubercoli radicali. L'endofita delle
angiosperme non è ancora ben noto. Probabilmente si
tratta di Actinomiceti. Presso alcune gimnosperme
svolgono questo ruolo simbiotico alcune alghe blu
Il contributo di organismi non simbionti al totale dell'N2
fissato è relativamente scarso
Esistono tuttavia batteri N2-fissatori nell'intestino di
mammiferi (uomo, maialino d'india). Essi sono stati
molto utili per chiarire i meccanismi biochimici della
fissazione (Clostridium pasteurianum, Azotobacter
vinelandii, Klebsiella pneumoniae, Bacillus polymyxa,
Rhodospirillum rubrum)
Meccanismo di fissazione dell'azoto
Il punto focale della N2-fissazione è costituito dalla reazione
catalizzata da un enzima: la NITROGENASI
La fissazione dell'azoto attraverso estratti liberi da cellule procede
solo in anaerobiosi
L'enzima viene infatti disattivato irreversibilmente dalla presenza di
O2
Questo e la mancanza di un isotopo radioattivo dell'azoto spiegano
le difficoltà incontrate nel chiarire questo meccanismo
Secondo i primi studi effettuati la reazione di fissazione
biologica era la seguente:
N2 + 6e- + 6H+ -----> 2NH3
Studi ulteriori sottolinearono che per avvenire la
fissazione era necessaria l’idrolisi di ATP e veniva
liberato idrogeno gassoso
Il meccanismo biologico di fissazione richiede inoltre 8
elettroni invece che 6, i due aggiuntivi sono necessari
per la produzione dell’idrogeno gassoso:
2 + 8e- + 8H+ + ATP -----> 2NH3 + H2 + ADP + Pi
La fissazione è quindi operata dall’enzima nitrogenasi
che si compone di due parti:
- (DI) NITROGENASI RIDUTTASI (omodimero di 64kDa)
- (DI)NITROGENASI (eterotetramero di 240 kDa)
Questo complesso enzimatico è localizzato nel citosol del
batteroide
La nitrogenasi lega l’N2 e lo trattiene sin quando non viene
ridotto, mentre la nitrogenasi riduttasi fornisce elettroni per
la riduzione
Dopo la riduzione della nitrogenasi riduttasi con 1
elettrone, 2 moli di ATP si legano ad essa e determinano
cambiamenti conformazionali per cui il potenziale redox dei
centri Fe-S cambia da -0.25 a -0.4 V
La NITROGENASI è un tetramero e contiene 2 siti catalitici
indipendenti (2 centri Fe-S) ed anche un cofattore FeMoCo
La nitrogenasi opera la riduzione dell’N2 utilizzando gli
elettroni che gli sono stati ceduti dalla Nitrogenasi
Riduttasi
8H+ + 8e- + N2 2NH3 + H2
Considerando la reazione precedente il bilancio della
fissazione dell’N2 è dato da:
N2 + 4NADH + 4H+ + 16 ATP 2NH3 + H2 + 4NAD+ + 16
ADP + 16P
Ancora oggi non è chiaro perché viene evoluto H2 durante
il processo
La NITROGENASI RIDUTTASI è un omodimero che contiene
un singolo centro 4Fe-4S e spesso è chiamata Fe-proteina
Una caratteristica peculiare della nitrogenasi riduttasi è
quella che nella forma ridotta l’enzima può legare 2
molecole di MgATP che determina cambiamenti
conformazionali della struttura. In questa nuova forma, la
nitrogenasi riduttasi si lega più strettamente alla
nitrogenasi
La nitrogenasi riduttasi ossidata accetta un elettrone che
proviene dalla ferredossina, lega 2 moli di MgATP e
trasferisce l’elettrone alla nitrogenasi
L’ATP è quindi idrolizzato a produrre 2 moli di MgADP e 2 Pi
in una reazione che vede coinvolte entrambi i complessi
della nitrogenasi
La
NITROGENASI
RIDUTTASI trasferisce
elettroni
sequenzialmente alla nitrogenasi dove essi si accumulano
prima nei centri F-S e quindi sono trasferiti al complesso
FeMoCo, che a questo punto lega l’N2
Con la riduzione della nitrogenasi, il complesso acquisisce
sino a 4 idrogeni prima di legare l’N2 e prima che la
riduzione inizi
Quando l’N2 si lega, si ha il rilascio dell’idrogeno gassoso
come prodotto di scarto, ma la nitrogenasi può ancora
rilasciare improduttivamente idrogeno senza legare l’N2
La nitrogenasi è sensibile all’ossigeno
La ragione principale che consente la fissazione dell’azoto nei
noduli delle radici delle piante infettate da Rhizobium è che
questi
noduli
contengono
elevate
quantità
di
LEGHEMOGLOBINA che mantiene l’ambiente anaerobico
legando tutto l’ossigeno che trova accesso ai noduli
La leghemoglobina è localizzata nel citosol delle cellule ospite
ed è normalmente presente ad elevate concentrazioni
In presenza di alcune specie di rizobio, le leguminose formano
una struttura caratteristica che è il NODULO RADICALE in cui
avviene la fissazione dell’azoto
Nell’ambito del nodulo avvengono sia la fissazione dell’azoto
che la sintesi di ATP da parte del batterio
La pianta nei noduli genera acidi organici che nutrono il
batterio e forniscono scheletri carboniosi utilizzati per il
trasporto dei composti azotati necessari per trasferire l’azoto
fissato al resto della pianta
La cellula ospite scambia con il batteroide essenzialmente
MALATO formato dalla sintesi del saccarosio
La saccarosio sintasi scinde il saccarosio in glucosio che
tramite la glicolisi viene ossidato sino a PEP che è
carbossilato ad ossalacetato (OAA) e quindi ridotto a malato
L’NH3 formato dalla fissazione nelle cellule ospiti viene
inizialmente convertito in GLUTAMMINA e trasportato tramite
lo xilema nei vari organi della pianta
Saccarosio
Malato
Batteroide
Fissazione N2
NH4+
Glutammina
N2
Il nodulo radicale è quindi formato dalla pianta ospite
L’infezione avviene normalmente attraverso i peli radicali
i quali rispondono a specifici segnali batterici alterando
la loro crescita per intrappolare il potenziale simbionte
Anche la struttura attraverso cui avviene l’infezione
(FILAMENTO INFETTIVO) può essere formata dalla pianta
e si compone di materiale della parete cellulare
Il filamento infettivo riempito di batteri in attiva crescita
penetra negli starti radicali per incontrare le cellule della
pianta in divisione
Dopo che il filamento infettivo è penetrato in uno o più
strati di cellule ospiti, i batteri vengono rilasciati in
vacuoli legati alle membrane ed entrano nella cellula
ospite
Questi vacuoli sono denominati SIMBIOSOMI e possono
contenere da uno a più batteri
In simbiosi i batteri differenziano i BATTEROIDI
che sono talvolta morfologicamente distinguibili
dai batteri liberi
I noduli sono strutture relativamente semplici che
contengono da decine a poche centinaia di
proteine nodulo-specifiche sintetizzate dalla piante
e chiamate NODULINE
Una caratteristica essenziale della simbiosi è il
mutuo riconoscimento tra pianta ospite e
simbionti batterici: composti rilasciati dalla pianta
inducono l’espressione di geni batterici implicati
nella simbiosi (geni nod)
I segnali associati all’espressione di questi geni
sono normalmente i FLAVONOIDI
RIDUZIONE ASSIMILATORIA DEI NITRATI
Le piante verdi, i batteri ed i funghi sono in grado di
prelevare i nitrati dal terreno e ridurli a NH3 e trasferire
quest'ultima nei composti azotati tipici della cellula
Il nitrato viene assorbito dalla soluzione circolante del
suolo attraverso le cellule epidermiche e corticali della
radice
Il trasporto di nitrato nelle radici procede con un simporto
di 2 protoni. Un gradiente protonico trans-membrana,
generato da un H+-ATPasi, permette il trasporto del nitrato
contro gradiente e l’ATP richiesto deriva dalla respirazione
mitocondriale
Il nitrato deve quindi essere ridotto a nitrito dalla NITRATO
RIDUTTASI e quindi ad ammonio attraverso l’azione
dell’enzima NITRITO RIDUTTASI
RIDUZIONE DEL NITRATO:
ENZIMA NITRATO RIDUTTASI
Il primo step è la riduzione dei nitrati a nitriti
Il potere riducente è rappresentato dal NADH o NADPH
La NR è un metallo-enzima che possiede siti per il legame con
il NAD(P)H e per il nitrato
Sono presenti 3 cofattori, forniscono centri redox per il
trasporto degli elettroni:
- FAD (-272 mV)
- un gruppo Fe-eme (-160 mV)
- un cofattore contenente molibdeno (MoCo) (-10 mV)
NO3- + NAD(P)H + H+ NO2- + NAD(P)+ + H2O
RIDUZIONE DEL NITRITO IN AMMONIACA:
enzima NITRITO RIDUTTASI
NO2- + NAD(P)H + H+ (o Fdred) NH4+ + NAD(P)+ (o Fdox)
L’enzima responsabile è la NITRITO RIDUTTASI, che è localizzata nei
plastidi e per il suo meccanismo occorre fare distinzione fra :
a) tessuti non fotosintetizzanti, (radici) e funghi. Il donatore di
elettroni in vivo è probabilmente NADPH attraverso ripetute
cessioni di 2 elettroni all'NO2-. Il NADPH proviene probabilmente dal
ciclo dei pentosi fosfati (ossidativo). Il NADPH riduce la
ferredossina in una reazione catalizzata dalla Fd-NADP riduttasi
b) tessuti fotosintetici. L'enzima è localizzato nei cloroplasti.
L’elettrodonatore è la Ferredossina. L'enzima è inducibile da nitrito
e nitrato
Equazione generale
NO3 - + 8H+ + 8e- NO3 + H2O + OH Si consumano otto equivalenti di elettroni e otto
equivalenti di idrogenioni nella riduzione di un
grammoione di NO3- a NH3
La reazione risulta in una alcalinizzazione con la
produzione di 1 equivalente di OH-. Ciò induce un
accumulo di acidi organici, in particolare di acido malico
nel citoplasma e nei vacuoli
Interazione tra assimilazione nitrato e
metabolismo carbonio
Deviazione della sintesi dell’amido verso la produzione di
aminoacidi ed acidi organici come il malato
La PEPcase che catalizza la sintesi di OAA, il quale è quindi
convertito in -chetoglutarato, è regolata da alte
concentrazioni di nitrato
L’ADP-glucosio pirofosforilasi è invece sottoregolata
alte concentrazioni di nitrato
da
La luce svolge un ruolo importante nella assimilazione dei
nitrati
Basse intensità luminose deprimono la riduzione dei nitrati
favorendone l'accumulo nei vegetali, soprattutto in
corrispondenza di abbondanti concimazioni nitriche
Ciò può costituire un pericolo quando i vegetali siano
destinati ad alimentazione del bestiame o all'alimentazione
umana
Assimilazione dell’ammoniaca: BIOGENESI
DELL’AZOTO ORGANICO
Indipendentemente dalla fonte di azoto, tutti gli organismi hanno in
comune un numero limitato di vie metaboliche per l’utilizzo dell’azoto
inorganico sotto forma di ammoniaca
L’ammoniaca in concentrazioni elevate è assai tossica, ma a
concentrazioni più basse è un metabolita chiave in quanto serve in
reazioni che la convertono in composti organici azotati
ENZIMI:
A) GLUTAMMATO-DEIDROGENASI
B) GLUTAMMINA-SINTETASI
C) GLUTAMMATO-SINTASI
B 3A
GLUTAMMATO DEIDROGENASI: aminazione
riduttiva dell’ -chetoglutarato
-chetoglutarato
glutammato
GLUTAMMINA SINTETASI: produzione
dell’azoto ammidico biologicamente attivo
glutammato
glutammina
I cloroplasti realizzano una riserva di azoto in forma di
Glutammina attraverso la reazione catalizzata della
Glutammina-sintetasi. Questo enzima possiede una affinità per
NH4+ di oltre 3 volte superiore di quella della Glutammatodeidrogenasi
Per questo si attribuisce all’enzima, oltre ad una funzione
assimilatrice, anche una funzione “disintossicante” dei
cloroplasti onde evitare un eccesso di NH4+ (disaccoppiante
della fotofosforilazione in vitro)
LA TRANSAMINAZIONE
La transaminazione gioca un ruolo molto importante nel
metabolismo degli amminoacidi in quanto costituisce una via
per la ri-distribuzione dell’azoto amminoacidico
Il GLUTAMMATO costituisce l’amminoacido chiave nel processo
di transaminazione
Le reazioni di transaminazione sono catalizzate da enzimi detti
TRANSAMINASI, che utilizzano come cofattore il PIRIDOSSAL
FOSFATO
chetoacido
amminoacido
-chetoglutarico
glutammico
ossalacetico
aspartico
gliossilico
glicina
piruvico
alanina
idrossi-piruvico
serina
glutammato -semialdeide
ornitina
succinato semialdeide
aminobutirrico
-cheto ß-idrossibutirrico
treonina