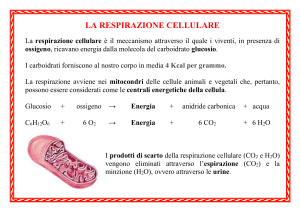
Chimica
Integrate)
(Scienze
Attività di recupero durante le vacanze di
Pasqua
Teoria ed Esercizi
Classi prime e seconde del Tecnico Tecnologico
Prof. Luciano Canu
Applicazione della prima legge
ponderale
In un sistema chiuso (che non scambia
materia)…
La somma delle masse dei reagenti è uguale alla
somma delle masse dei prodotti
Cioè…
mR = mP
Ciò significa che gli atomi degli elementi che formano I
reagenti non scompaiono nè si creano dal niente, quindi…
Una equazione chimica deve essere bilanciata
__NH3 __N2 + __H2
il numero di atomi non coincide
quindi si devono inserire dei coefficienti numerici
2NH3 N2 + 3H2
ora i numeri degli atomi prima e
dopo la reazione corrispondono
Esercizi
Prova a bilanciare le seguenti equazioni
chimiche
__Al2O3 + __H2O __Al(OH)3
__Na + __O2 __Na2O
__H2 + __Cl2 __HCl
_NaOH + _H2SO4 _Na2SO4 + _H2O
__H2O + __F2 __HF + __O2
La seconda legge
ponderale
Quando due elementi (due sostanze) si combinano per
formare un composto…
…lo fanno secondo rapporti di massa definiti e costanti
Utilizzando le masse atomiche indicate nella tavola
periodica è possibile ritrovare I rapporti di massa indicati
nella seconda legge
Cu + S CuS
63,5 + 32,0 = 95,5
Esercizio guidato
• Se nella tabella precedente dovesse mancare un dato (x)
è possibile risolvere utilizzando la prima legge ponderale
• Quanti grammi di zolfo (S) sono necessari per far reagire
63,5 grammi di rame (Cu) e ottenere 95,5 grammi di
solfuro di rame (CuS)?
Cu
63,5
+
+
S
x
=
CuS
95,5
• È possibile ottenere la quantità mancante sottraendo dal
totale (CuS) la quantità conosciuta (Cu)
▼ 95,5 g - 63,5 g = 32,0 g
Esercizio da
risolvere
Bilancia la reazione seguente
__CH4 + __O2 __CO2 + __H2O
▼E determina il componente mancante
(CO2)
__CH4 +
16
+
__O2
32
__CO2 + __H2O
=
x
+
36
Esercizio sulla seconda
legge
• È possibile utilizzare la seconda legge per prevedere
qualsiasi combinazione di masse coinvolte in una
reazione
▼ Per esempio dalla reazione seguente…
H2
2
+
+
O2
32
=
H2O2
34
▼ …è possibile ricavare tutte le masse delle sostanze coinvolte
partendo dalla massa di una sola
2
45 kg
+
+
32
x kg
=
=
34
y kg
▼ Il problema è risolvibile utilizzando una proporzione
Risolvere la proporzione
H2
+
O2
H 2O 2
2
+
32
=
34
45 kg
+
x kg
=
y kg
• Una proporzione possibile può essere (frecce nere)
▼ 2 : 45 = 32 : x
• Un’altra soluzione può essere (frecce bianche)
▼ 45 : x = 2 : 32
• È possibile ottenere anche la massa del terzo componente
(frecce viola)
▼ 2:45=34:y
Esercizio sulla legge di
Proust
• Scrivere l’equazione bilanciata di
formazione del gas N2O partendo
dall’azoto (N2) e dall’ossigeno (O2)
▼Indica il rapporto numerico di combinazione
tra azoto e ossigeno nel composto (N2O)
▼Determina (calcola) quanto N2O si produce se
si vogliono consumare 67 g di azoto (N2) e
quanto ossigeno (O2) si consuma
• Un consiglio: utilizza una tabella simile a
quella impostata negli esercizi precedenti
Esercizio 2 sulla seconda
legge
• Calcolare quante tonnellate di calce (CaO)
si ottengono per
▼riscaldamento di 3 t di marmo bianco
(considerato CaCO3 puro) secondo la
reazione: CaCO3 CaO + CO2