EVENTO ECM Rif. N° 7531 – 130619
Polo Universitario di Colle Val d’Elsa, 23 maggio 2004 e 10 ottobre 2004
Facoltà di Farmacia - Università degli Studi di Siena
E’ stato il primo inibitore selettivo, attivo per via orale,
dell’enzima di conversione ACE (angiotensin converting
enzyme) che idrolizza l’angiotensina I in angiotensina II e
che, nel contempo, inattiva la bradichinina, potente
vasodilatatore.
Trova impiego nel trattamento dell’ipertensione da solo o
in associazione.
Utilizzato anche nel trattamento dell’insufficienza
cardiaca congestizia, per lo più in associazione con
diuretici e digitale.
EUROPEAN PHARMACOPOEIA 4th 2002.
01/2002:1079
CAPTOPRIL
Captoprilum
O
HS
H
CO2H
N
H
CH3
C9H15NO3S
Mr 217.3
DEFINIZIONE
(2S)-1-[(2S)-2-Methyl-3-sulphanylpropanoyl]pyrrolidine-2-carboxylic acid.
Contenuto: dal 98.0 per cento fino a 101.5 per cento (sostanza essiccata).
CARATTERI
Aspetto: polvere cristallina bianca o quasi bianca.
Solubilità: molto solubile in acqua, in diclorometano e in metanolo. Si scioglie in
soluzioni diluite di idrossidi alcalini.
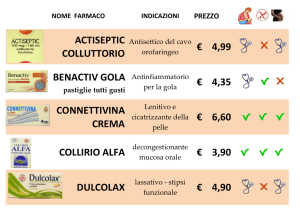
Pervietà del dotto di Botallo (DBP)
Descrizione Farmaco
ACEPRESS 25 50 CPR 25 MG
ACEPRESS 50 24 CPR 50 MG
ACEPRILEX 50 CPR 25 MG
ACEPRILEX 24 CPR 50 MG
CAPOTEN 25 50 CPR 25 MG
CAPOTEN 50 24 CPR 50 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 50 CPR 25 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 50 CPR 25 MG
CAPTOPRIL 50 CPR 25 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 50 CPR 25 MG
CAPTOPRIL 50 CPR 25 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 24 CPR 50 MG
CAPTOPRIL 50 CPR 25 MG
Gruppo Farmaceutico
Fonte:
http://www.giofil.it/offline/solttptt.htm
CARDIOVASCOLARI IPOTENSIVI ANTIIPERTENSIVI
Scopo dello studio
necessità di fornire dosaggi orfani di captopril non reperibili
in commercio
allestimento di una forma farmaceutica che possa essere
assunta dai bambini in alternativa allo sciroppo che dà
problemi di preparazione, dato il basso dosaggio del
principio attivo
allestimento di una forma farmaceutica che possa essere
preparata in grandi quantitativi, evitando così continue
richieste da parte dei pazienti
verifica della stabilità del principio attivo nel tempo
CAPSULE DI CAPTOPRIL DOSAGGIO ORFANO
COMPOSIZIONE:
Captopril
Quantità prescritta
Lattosio
q.b.
METODO DI PREPARAZIONE:
Misceliamo il captopril, con adatto colorante, al lattosio secondo la regola delle diluizioni
geometriche, quindi distribuiamo la miscela così ottenuta nelle capsule.
CARATTERI:
Capsule del tipo snap-fit contraddistinte dal numero 4.
CONSERVAZIONE:
In luogo asciutto.
AVVERTENZE:
Uso interno, agitare prima dell’uso.
CONTROLLO DI QUALITA’:
Uniformità di massa come descritto al punto 8 dalle N.B.P. F.U. XI Ed., numero di dosi
forma da dispensare.
PERIODO DI VALIDITA’:
Non oltre il 25 per cento del più breve periodo di validità dei componenti utilizzati; tale
periodo non può superare 6 mesi.
Note terapeutiche e d’uso:
Si può usare nei bambini che presentino la pervietà del foro di Botallo; il captopril è
indicato nel trattamento dell’ipertensione arteriosa e nell’insufficienza cardiaca
congestizia, la sua azione è dovuta all’abbassamento delle resistenze arteriose
periferiche indotte dalla soppressione del sistema R.A.A.
Note legislative:
Tipo ricetta: RR
La capsula funziona da involucro e
va aperta al momento della
somministrazione per liberare il
contenuto, che viene solubilizzato
in acqua.
Captopril Ph.Eur. – Ditta Galeno, Comeana (Prato) per
retta di taratura (in NaOH 0,1 N)
Capsule contenenti captopril 5 mg e lattosio come
eccipiente (peso medio= 144 mg) –
Farmacia Interna del Monoblocco Valdelsa, Loc. Campostaggia,
Poggibonsi (Siena) per verificare la stabilità nel tempo
La stabilità del preparato è stata valutata attraverso un saggio
spettrofotometrico che si basa sull’assorbimento del captopril in
soluzione alcalina diluita alla lunghezza d’onda di 238 nm (Medicamenta,
Cooperativa Farmaceutica, Milano, vol. VI, VII Ed., 1996).
Il giorno stesso dell’allestimento delle capsule è
stato eseguito il saggio spettrofotometrico alla
lunghezza d’onda di 238 nm per valutare i
seguenti parametri:
• Uniformità
di
contenuto
delle
forme
farmaceutiche a dose unica (Saggio B) previsto
dalla F.U.I. XI Ed.
• Contenuto del principio attivo al tempo 0
N.B. La retta di taratura è stata effettuata con captopril polvere in
soluzione di NaOH 0,1 N e ripetuta ogni volta con soluzione
preparata di fresco.
Le capsule sono state poi suddivise in quattro
gruppi per valutare la stabilità del principio attivo
nel tempo:
Capsule captopril 5 mg correttamente conservate
(in luogo fresco e asciutto, al riparo dalla luce)
Capsule captopril 5 mg sottoposte a stress termico
(mantenute in stufa termostatata a 50°C)
Capsule captopril 5 mg sottoposte a stress termico
(mantenute al sole, sul davanzale di una finestra)
Capsule captopril 5 mg in soluzione di NaOH 0,1 N
(conservate in frigorifero a 4°C)
Le determinazioni spettrofotometriche dei campioni,
tutte in soluzione di NaOH 0,1 N, sono state eseguite
ai seguenti tempi:
a cinque giorni dalla preparazione
a dieci giorni dalla preparazione
a 15 giorni dalla preparazione
Tutti i calcoli matematici e statistici (test “t” di Student)
sono stati eseguiti con il programma Microsoft Excel.
Spettrofotometro Beckman DU-650
Stabilità del captopril
6,00
Capsule
mg/ml captopril
Soluzione
Capsule a 50°C
*
4,00
Capsule al sole
*
*
2,00
0,00
0
* p < 0,001
5 giorni
10 giorni
15 giorni
(formulazione della Farmacia Interna degli Ospedali Riuniti di Bergamo)
captopril
acido L-ascorbico
sodio benzoato
acqua depurata
0,1%
5 mg
1 mg
1 ml
portare a volume con sciroppo semplice F.U.
La data limite di utilizzo è stata attribuita in 56 giorni a
4°C e 22 giorni a 22°C (Am.J.Hosp.Pharm. 1994,
51(13), 1707-2708)
Il captopril in soluzione, pur conservato in frigorifero, non
garantisce il titolo minimo necessario per la terapia, con un
decadimento del contenuto in principio attivo veloce e
costante;
Le capsule di captopril presentano una stabilità nel tempo
in grado di garantire un lungo periodo di terapia;
La stabilità delle capsule di captopril non viene
significativamente alterata da una conservazione non
idonea, aumentando i margini di sicurezza per il paziente;
Prove effettuate su capsule di captopril preparate da alcuni
anni, dimostrano che l’involucro gelatinoso è un ottimo
contenitore che non permette l’alterazione del principio
attivo.
Ringraziamenti
• Dr. Alessandro D’Arpino – Gruppo di Lavoro Area Buona
Produzione Farmaceutica SIFO
• Dr. Silvano Giorgi – Gruppo di Lavoro Area Buona
Produzione Farmaceutica SIFO
• Dr.ssa Cristina Nencini – Dipartimento di Farmacologia
“G. Segre”, Università degli Studi di Siena
• Dr.ssa Elga Collavoli - Dipartimento di Farmacologia
“G. Segre”, Università degli Studi di Siena