Perchè parlare di proteine?
Funzione:
- enzimatica
- trasporto e deposito (emoglobina)
- movimento (componenti muscolo)
- difesa immunitaria (anticorpi)
- risposta stimoli nervosi (mediata da ormoni)
- ormoni (insulina)
- controllo crescita e differenziamento
(repressori/promotori traduzione)
Le proteine sono costituite da aminoacidi: questi hanno una
struttura base comune (atomo di carbonio asimmetrico
legato ad un gruppo amminico, un gruppo carbossilico, un
idrogeno) e un gruppo R variabile che ne detemina le
proprietà chimico-fisiche.
Amminoacido
a-amminoacido
Lisina
Carbonio alfa
L-Alanina
D-Alanina
Stereoisomeri dell’alanina
L-Alanina
D-Alanina
Legame degli amminoacidi ad altri componenti
cellulari
Il gruppo aminico nell’asparagina ed il gruppo ossidrilico
nella serina e nella treonina possono legare i
carboidrati.
Il gruppo ossidrilico della serina, treonina e tirosina,
inoltre, può essere fosforilato. Tale fosforilazione gioca
un ruolo fondamentale nel controllo del metabolismo
cellulare.
In un ambiente ossidante due molecole di cisteina
possono essere ossidate a formare un legame disulfuro
S-S.
Ossidazione della cisteina
ossidazione
Cisteina
Cistina
Cisteina
riduzione
Struttura primaria: il legame
peptidico
Il legame peptidico si forma fra il gruppo carbossilico di
un aminoacido ed il gruppo amminico di altro
aminoacido, con la perdita di una molecola d’acqua.
Una serie di aminoacidi uniti da legami peptidici formano
una catena polipeptidica.
Una catena polipeptidica ha una polarita’ perche’ le sue
estremita’ sono differenti: abbiamo infatti una estremita’
N-terminale ed una estremita’ C-terminale.
L’estremita’ N-terminale e’considerata come l’inizio della
catena perche’ i polipeptidi vengono sintetizzati nei
ribosomi a partire da questa estremita’.
Nterminale
Cterminale
Le proteine hanno sequenze aminoacidiche uniche che
sono specificate da geni
La sequenza di una proteina viene chiamata anche
struttura primaria
La catena principale o
scheletro di una proteina
e’ la successione degli
atomi che fanno parte dei
legami peptidici della
catena senza tener conto
delle catene laterali.
La struttura secondaria e’ la disposizione spaziale degli
atomi dello scheletro polipeptidico, senza considerare la
disposizione delle catene laterali.
Alcuni elementi di struttura secondaria sono
energeticamente favoriti e si ritrovano nella maggior
parte delle proteine:
-elica: e’ una avvolgimento
elicoidale destrorso. Un giro
dell’elica comprende 3.6
residui. Il passo dell’elica,
cioe’ la distanza che intercorre
tra un giro ed il successivo e’
pari a 5.4 Å. Questa
disposizione e’ tale che il
gruppo carbonilico C=O di un
residuo risulta in diretta
corrispondenza con il gruppo
N-H del quarto residuo
a.acidico successivo. L’atomo
di ossigeno e quello di
idrogeno vengono a trovarsi a
2.8 Å di distanza e formano un
legame idrogeno
particolarmente stabile
La catena peptidica puo’
anche assumere una
conformazione quasi
completamente estesa
chiamata filamento .Diversi
filamenti possono poi
affiancarsi per formare legami
idrogeno interfilamento che
stabilizzano la struttura
complessiva. Il risultato
prende il nome di foglietto .
foglietto b
antiparallelo
foglietto b parallelo
Diversi filamenti b,
tipicamente 4 o 5 ma
in certi casi anche 10
o piu’, interagiscono
per formare foglietti b.
Questi possono
essere interamente
paralleli, antiparalleli
o misti.
Struttura terziaria delle proteine: e’ la struttura
tridimensionale di un’intera catena polipeptidica.
Ossidazione della cisteina
ossidazione
Cisteina
Cistina
Cisteina
riduzione
Struttura quaternaria: la distribuzione spaziale relative
delle diverse subunita’ in proteine constituite da piu’ di
una catena polipeptidica.
Le diverse catene polipeptidiche sono normalmente legate
fra loro da interazioni non covalenti.
Nella maggior parte delle proteine oligomeriche le varie
subunita’ sono disposte in modo simmetrico
L’emoglobina ed il trasporto dell’ossigeno
I vertebrati hanno selezionato due meccanismi principali per rifornire
di ossigeno le cellule di un organismo
1) Sistema circolatorio
2) Molecole in grado di trasportare l’ossigeno, superando cosi’ la
limitazione costituita dalla bassa solubilita’ dell’ossigeno in acqua
Emoglobina: contenuta nei globuli rossi
trasporta non solo ossigeno ma anche ioni
idrogeno ed anidride carbonica
Mioglobina: espressa nel tessuto
muscolare funge da riserva di ossigeno e
ne facilita il movimento
L’ossigeno si lega al gruppo
prostetico eme
L’eme e’ costituito da una parte organica, chiamata
protoporfirina (IX) e da un atomo di ferro
La mioglobina presenta una forma compatta
Sono presenti otto
maggiori (A-H).
segmenti
a-elicoidali
Il gruppo eme e’ inserito in una fessura fra
le eliche E ed F
Tutti i residui interni alla struttura sono
idrofobici con due eccezioni: l ’ istidina F8
(prossimale) e l’istidina E7 (distale)
Il gruppo eme e’ in grado di legare
reversibilmente l’ossigeno in soluzione.
A che cosa serve allora l’impalcatura proteica?
L’ossigeno legato all’eme isolato ossida
rapidamente il ferro (II) a ferro (III) che non e’, a
sua volta, piu’ in grado di legare ossigeno.
Questa reazione avviene tramite la formazione di
un intermedio eme-ossigeno-eme. Tale intermedio
non si puo’ formare nella mioglobina e
nell’emoglobina a causa dell’ingombro sterico
causato dalla catena polipeptidica
La mioglobina e’ costituita da una
sola catena polipeptidica.
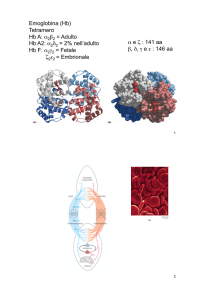
Al contrario l’emoglobina
dell’adulto (emoglobina A) e’ un
tetramero costituito da due
catene a e due catene b.
Durante lo sviluppo del feto
diversi tipi di emoglobina si
succedono:
La prima emoglobina sintetizzata
dall’embrione possiede due
catene zeta (z) simili alle catene a
e due catene epsilon (e) simili alle
b. Nel corso dello sviluppo la
catena z e’ sostituita dalla a e la
catena e dalla catena g e
successivamente dalla catena b.
La emoglobina piu’ presente
negli ultimi due trimestri di vita
fetale ha una composizione a g
La struttura tridimensionale delle subunita’
dell’emoglobina e’ molto simile alla struttura
della mioglobina.
Mioglobina
Subunita’ b dell’emoglobina
Questo risultato fu del tutto inaspettato perche’
pochi residui aminoacidici sono identici nelle tre
catene polipeptidiche allineate.
Questo fu il primo esempio di un principio
biologico alla base dell’evoluzione: la struttura
delle proteine e’ sempre piu’ conservata della
loro sequenza
Nonostante le strutture tridimensionali della mioglobina e
delle catene a e b isolate dell’emoglobina siano molto simili,
le proprieta’ di legame nei confronti dell’ossigeno sono
diverse.
L’emoglobina e’ una molecola molto piu’
sensibile della mioglobina ed e’ in grado di
modulare la sua affinita’ verso l’ossigeno in
risposta a diversi stimoli ambientali.
Questa capacita’ puo’ essere riassunta in tre
proprieta’ diverse:
Cooperativita’: il legame di O2 favorisce il
legame di altro O2 alla stessa molecola di
emoglobina.
Effetti allosterici: l’affinita’ dell’emoglobina per
l’ossigeno varia in funzione del pH e della
concentrazione di CO2. Questi effettori legano la
molecola in siti diversi dall’O2.
Cofattori: l’affinita’ dell’emoglobina per
l’ossigeno e’ anche regolata dal legame di
composti organici contenenti gruppi fosforici
come il 2,3-bisfoglicerato.
Un abbassamento del pH Effetto Bohr: H+ e CO stimolano
2
sposta la curva di
il rilascio di O2
dissociazione dell’ossigeno
verso destra, riducendo di
fatto l’affinita’
dell’emoglobina per
l’ossigeno. Lo stesso
effetto si ottiene
aumentando la [CO2] a pH
costante.
In tessuti
metabolicamente attivi,
come il muscolo, vengono
prodotte grandi quantita’
di H+ e CO2 che stimolano il
rilascio di O2.
L’effetto opposto si ottiene
negli alveoli polmonari
dove l’elevata [O2] induce
il distacco di H+ e CO2
dall’emoglobina.
Y
Polmoni
O2
HHb
H+
HbO2
HCO3-
Atmosfera
CO2+H2O
Tessuti
Sangue venoso
Sangue arterioso
Plasma
HHb
O2
HbO2
H+
HCO3-
Metabolismo
H2O+ CO2
CO2 diminuisce l’affinità Hb-O2
Tessuti: CO2 alta, affinità Hb-O2 bassa = rilascio di O2
Polmoni: CO2 bassa, affinità Hb-O2 alta = assunzione
di O2
Polmoni
O2
HHb
H+
HbO2
HCO3-
Atmosfera
CO2+H2O
Tessuti
Sangue venoso
Sangue arterioso
Plasma
HHb
O2
HbO2
H+
HCO3-
Metabolismo
H2O+ CO2
CO2 diminuisce l’affinità Hb-O2
Tessuti: CO2 alta, affinità Hb-O2 bassa = rilascio di O2
Polmoni: CO2 bassa, affinità Hb-O2 alta = assunzione
di O2
Domini.
Il termine dominio viene usato per descrivere un’area di una
proteina che è funzionalmente o fisicamente distinta da altre
aree.
Un esempio sono le proteine che passano attraverso le
membrane biologiche: queste hanno un dominio citosolico, un
dominio transmembrana e un dominio extracellulare.
In figura si riporta una proteina (src)
coinvolta nel controllo della divisione
cellulare.
L’attività catalitica risiede nei domini
giallo e arancione, l’attività
regolatoria in quello verde e in quello
blu. Le regioni di collegamento sono
colorate in verde scuro.
Funzione delle proteine
Le proteine svolgono molteplici ruoli:
1)Catalisi enzimatica: gli enzimi sono molecole capaci di
aumentare la velocità delle reazioni. Quasi tutti gli enzimi
sono proteine.
2) Trasporto e deposito: molte molecole vengono trasportate
da proteine (es. Emoglobina trasporta l’ossigeno,…)
3) Protezione immunitaria: gli anticorpi sono proteine
altamente specifiche che riconoscono e attaccano sostanze
estranee.
4) Produzione e trasmissione di impulsi nervosi: la risposta
delle cellule nervose a stimoli specifici è mediata da proteine
con funzione recettoriale.
5) Controllo della crescita e differenziamento: I fattori di
trascrizione regolano l’attività dei promotori genici.
6) Movimento coordinato: le proteine sono la componente
principale del muscolo, che si contrae in seguito a movimenti
di scivolamento di due specie di filamenti proteici.
7) Sostegno meccanico: la resistenza alla trazione della pelle
e delle ossa è dovuta alla presenza di una proteina, il
collagene.
Gli enzimi sono i catalizzatori dei sistemi biologici e come
tali mediano tutte le trasformazioni chimiche cellulari
Gli enzimi sono, nella stragrande maggioranza dei casi,
proteine ma esistono anche enzimi costituiti da RNA
Le caratteristiche piu’ importanti degli enzimi sono il
POTERE CATALITICO e la SPECIFICITA’
Reazione di idratazione dell’anidride carbonica
Anche una reazione semplice come questa viene catalizzata
da un’enzima specifico: l’anidrasi carbonica
In assenza di questo enzima il trasferimento di CO2 dai
tessuti al sangue non sarebbe efficiente
Una molecola di enzima catalizza 100000 reazioni di
idratazione al secondo.
La reazione catalizzata e’ 10 milioni di volte piu’ veloce
della reazione non catalizzata
La formazione di un complesso enzima-substrato e’ la prima
tappa nella catalisi enzimatica
I substrati si legano ad una specifica regione dell’enzima
che si chiama sito attivo
Gli enzimi sono molto selettivi nel legame: la specificita’ di
catalisi dipende dalla specificita’ di legame
Caratteristiche comuni dei siti attivi:
1) Occupano una parte relativamente piccola del volume
della molecola enzimatica
2) Sono generalmente cavita’ o fenditure sulla superficie
dell’enzima
3) La specificita’ del legame dipende dagli aminoacidi che si
affacciano nel sito attivo
Gli enzimi possono essere inibiti da molecole specifiche
Si tratta di un meccanismo di controllo dell’attivita’ enzimatica
fondamentale. Inoltre la maggior parte dei farmaci e degli
agenti tossici sono inibitori di enzimi
Inibitori irreversibili: una volta legatisi all’enzima si dissociano
molto lentamente o non si dissociano affatto. I legami sono di
norma covalenti
Inibitori reversibili: si associano e si dissociano dall’enzima
rapidamente. L’inibizione reversibile puo’ essere distinta in
inibizione competitiva e non-competitiva
Un inibitore competivivo diminuisce la velocita’ di catalisi
riducendo il numero di molecole enzimatiche disponibili per il
substrato
Un inibitore non competitivo si puo’ legare all’enzima
simultaneamente al substrato, quindi il loro sito di legame non
coincide. L’inibitore non competitivo agisce diminuendo il numero
di turnover cioe’ il numero di reazioni che l’enzima e’ in grado di
catalizzare nell’unita’ di tempo
Enzimi Allosterici
In ogni via metabolica la maggior parte degli enzimi segue il
modello cinetico che abbiamo descritto.
Gli enzimi allosterici sono normalmente enzimi composti da piu’
subunita’ e legano, oltre ai substrati, altri composti detti
modulatori che sono in grado di modificarne l’efficienza catalitica. I
modulatori possono avere sia un effetto stimolatorio che inibitorio.
In molte vie metaboliche
l’enzima che controlla la
velocita’ complessiva della via
viene inibito dal prodotto finale:
inibizione retroattiva (a
feedback)
Introduzione al
metabolismo
Il Metabolismo altro non e’ che una rete integrata di reazioni
chimiche che permette ad una cellula:
1) Estrarre energia e potere riducente dall’ambiente che le
circonda
2) Sintetizzare i precursori le molecole e macromolecole
necessarie al funzionamento della cellula
Il numero complessivo di reazioni che compongono il
metabolismo e’ molto grande (piu’ di mille) ma il tipo di
reazioni e’ invece relativamente piccolo
Come si lega tutto ciò ai composti tossici?
Il legame di xenobiotici o loro metaboliti ad una proteina
può portare a:
1) Perdita della funzione della proteina.
2) Creare un falso segnale nel sistema di regolazione
della cellula. Ciò è critico soprattutto per proteine
coinvolte nel controllo della crescita cellulare.
3) Interferire nell’organizzazione della cellula.
4) Interferire nello scambio di informazioni tra le cellule
nell’organismo.
Gli organismi si sono evoluti per superare tali alterazioni
perciò, in molti casi, basse dosi di xenobiotici vengono
controllate dai sistemi di difesa dell’organismo.
L’ATP e’ il trasportatore universale di energia libera nei
sistemi biologici
Gli esseri viventi richiedono un apporto continuo di energia
libera;
1) Produzione di lavoro meccanico nella contrazione
muscolare ed in altri movimenti cellulari
2) Trasporto attivo di molecole e ioni
3) Sintesi di molecole da precursori semplici
Questa energia e’ ottenuta tramite l’ossidazione di sostanze
nutrienti (chemotrofi) od intrappolando l’energia solare
(fototrofi)
In entrambi casi l’energia deve essere poi immagazzinata
sotto forma di energia chimica facilmente accessibile
L’ATP (adenosina trifosfato) e’ un nucleotide costituito da
una molecola di adenina legata ad ribosio a sua volta
legato ad una unita’ trifosfato
L’idrolisi di un legame anidridico porta alla formazione di ADP
L’ADP puo’ essere poi ulteriormente idrolizzato a AMP
Nei sistemi biologici l’ATP ha la funzione di donatore immediato di
energia e non quella di conservare energia per lunghi periodi
In condizioni normali una molecola di ATP viene consumata circa un
minuto dopo la sua sintesi.
Un uomo a riposo consuma circa 24 kg di ATP in 24 ore
Il NADH ed il FADH2 sono i principali trasportatori di elettroni nelle
ossidazioni delle sostanze nutrienti
I chemotrofi ottengono l’energia necessaria alla loro vita
dall’ossidazione di sostanze nutrienti come gli zuccheri e i grassi.
Negli organismi aerobi l’accettore finale degli elettroni e’
l’ossigeno. Gli elettroni non vengono pero’ trasferiti direttamente
dalle sostanze nutrienti all’ossigeno: intervengono dei
transportatori intermedi che prendono il nome di:
Nicotinamide adenin dinucleotide (NAD+)
Flavin adenin dinucleotide (FAD)
Queste sostanze, una volta ridotte, trasferiscono gli elettroni
all’ossigeno con concomitante sintesi di ATP. Questo processo
prende il nome di fosforilazione ossidativa
NAD+: Nicotinamide adenin dinucleotide nella forma ossidata
FAD: flavin adenin dinucleotide nella forma ossidata
Esempi di reazioni di ossido-riduzione che coinvolgono il NAD+
ed il FAD
Il coenzima A e’ un trasportatore universale di gruppi acile
I gruppi acile si legano al CoA con un legame tioestere
con il gruppo sulfidrilico terminale del CoA. Il gruppo
acile e’ poi facilmente trasferibile dall’Acil-CoA.
Struttura del Coenzima A (CoA)