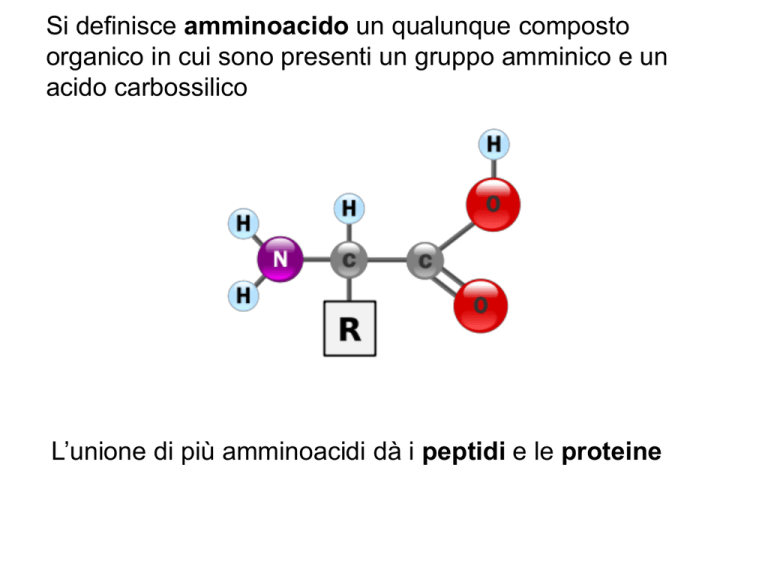
Si definisce amminoacido un qualunque composto
organico in cui sono presenti un gruppo amminico e un
acido carbossilico
L’unione di più amminoacidi dà i peptidi e le proteine
Tra i numerosi amminoacidi, solo 20 partecipano alla formazione delle
proteine e, quindi, sono definiti amminoacidi proteogenici.
Gli amminoacidi proteogenici:
• Sono tutti a (la funzione NH2 è legata al C adiacente alla funzione
carbossilica)
• Sono tutti chirali (eccetto la glicina)
• Presentano stereochimica L (il C chirale ha la stessa
configurazione del C chirale della L-gliceraldeide)
• Il C chirale ha una configurazione assoluta S (ad eccezione
della cisteina, che è R)
Inoltre, gli amminoacidi:
• si differenziano tra loro per la natura del gruppo –R,
definito residuo amminoacidico o catena laterale
• si presentano come zwitterioni, cioè come ioni dipolari,
in cui sono presenti, contemporaneamente, una carica
positiva e una negativa
Proprietà acido-basiche degli amminoacidi
Gli amminoacidi sono zwitterioni (sali interni).
•Hanno momenti dipolari elevati
•Sono, generalmente, solubili in H2O
•Sono sostanze cristalline con alti punti di fusione
Il comportamento in soluzione acquosa viene influenzato
dal pH
Se un amminoacido in soluzione viene sottoposto
all’azione di un campo elettrico esterno tenderà :
• A migrare verso il catodo (elettrodo negativo) se
è in forma cationica
• A migrare verso l’anodo (polo positivo) se è in
forma anionica
• A non migrare se si trova al suo punto
isoelettrico (PI)
Per gli amminoacidi con una carica (+ o -) nel
residuo R, il PI è:
• la media dei valori di pKa più bassi, se R è un residuo
acido
• la media dei valori di pKa più alti, se R è un residuo
basico
Alcuni metodi di sintesi racema
1) Sintesi di amminoacidi da a-alogenoacidi
2) Sintesi di Strecker
3) Sintesi di Gabriel
1) da a-alogenoacidi:
La reazione di amminazione fatta con NH3 dà rese basse, a causa della polialchilazione.
In alternativa, si utilizza la sodio azide, che per idrogenazione catalitica, o con NaBH4 si
riduce ad ammina.
2) Sintesi di Strecker
3) Sintesi di Gabriel (della glicina)
PEPTIDI
Il legame che si instaura fra gli amminoacidi per formare i
peptidi e le proteine è un legame ammidico, detto legame
peptidico
Il dipeptide è il più semplice peptide, formato dall’unione di
due amminoacidi
Per formare il legame peptidico, un amminoacido mette a
disposizione il proprio gruppo –COOH, mentre l’altro amminoacido
interviene con il suo gruppo –NH2, con formazione di una molecola di
H2O.
I dipeptidi si indicano scrivendo i simboli dei due residui
amminoacidici che li costituiscono
.
Per convenzione, i peptidi sono rappresentati ponendo a sx l'amminoacido
con il gruppo amminico libero (a.a. N-terminale) e all'estremità di dx quello
con il gruppo carbossilico libero (a.a. C-terminale)
Sintesi dei peptidi
Attivazione del COOH
protezione del gruppo NH2
La protezione del gruppo NH2 consiste nel rendere l’N del gruppo
amminico meno reattivo, cioè meno nucleofilo.
Alcuni esempi di gruppi protettori dell’-NH2
Terz-butossicarbonile (Boc)
Viene introdotto facilmente facendo reagire l’-NH2 con il di-terz-butil dicarbonato
(Boc-anidride), e rimosso facilmente per idrolisi acida
Carbobenzilossi cloruro (benzilcloroformiato)
Viene facilmente introdotto sul gruppo amminico (SNacilica), in presenza di basi
per neutralizzare l’HCl che si forma, e rimosso altrettanto facilmente per
idrogenazionecatalitica
Fluorenilmetossicarbonil cloruro
Viene rimosso facilmente tramite idrolisi debolmente basica
•La sintesi di una catena peptidica per addizione sequenziale di un
amminoacido richiede un processo accurato di purificazione del prodotto
ottenuto, poiché ad ogni passaggio sintetico è necessario isolarlo dal solvente,
dai sottoprodotti, dall’eccesso di reagenti
Resina più usata:
Granuli di polistirene-divinilbenzene
contenenti gruppi clorometilici.
Ha lo svantaggio di dover essere rimossa
in condizioni acide drastiche (HF)
Resine più innovative: non hanno bisogno di un acido forte per essere
rimosse
Passaggi della sintesi in fase solida
1) Un amminoacido (es. valina) N-Boc protetto si lega alla resina per reazione
con i gruppi clorometilici.
2) L’amminoacido viene lavato per liberare dall’eccesso di reagente e trattato con
acido trifluoroacetico per rimuovere il –Boc.
3) Il secondo amminoacido N-Boc protetto e –COOH attivato condensa con il primo
amminoacido (valina)
4) Il dipeptide N-Boc-Val-Phe viene lavato e trattato con acido trifluoroacetico per
rimuovere il Boc. Il ciclo si ripete n volte, fino all’ottenimento del peptide desiderato
5) L’ultimo passaggio prevede il distacco dell’amminoacido dalla resina, ad opera di HF
che rimuove anche il Boc.
Proteine:
Sono formate da lunghe catene amminoacidiche.
Queste catene possono assumere conformazioni diverse,
così che si hanno quattro livelli di struttura:
Struttura primaria delle proteine, costituita dalla sequenza degli amminoacidi
nella catena
Struttura secondaria delle proteine, costituita dalla conformazione ordinata che i
vari segmenti della catena possono assumere
Struttura terziaria delle proteine, data dai ripiegamenti che le varie proteine
assumono per generare la loro forma
Struttura quaternaria, che descrive come le varie subunità che eventualmente
costituiscono la proteina si assemblano fra loro
Determinazione della struttura primaria di peptidi e
proteine
• Identificazione degli amminoacidi presenti
• Identificazione della quantità degli
amminoacidi presenti
• Identificazione della sequenza degli
amminoacidi presenti
Identificazione della composizione amminoacidica di
un peptide: si effettua attraverso reazioni di degradazione
• Scissione dei ponti disolfuro (reazione di riduzione)
• Scissione dei legami peptidici (a 110°C in HCl acquoso:
idrolisi dei legami ammidici)
L’analisi della miscela di amminoacidi ottenuta dall’idrolisi
si effettua tramite cromatografia (HPLC), o
gascromatografia, dopo averli trasformati in esteri
metilici
Identificazione dell’amminoacido N-terminale:
degradazione di EDMAN
Consente di scindere selettivamente l'amminoacido N-terminale, lasciando il
polipeptide accorciato di un'unità.
Il reattivo di Edman è il fenilisotiocianato, che trasforma l'amminoacido N-terminale
in una tiourea ciclica.
tiourea ciclica con il suo gruppo R identificabile
Meccanismo :
Vantaggio: lascia intatta la restante catena peptidica, così l’analisi può essere ripetuta.
Identificazione dell’amminoacido N-terminale:
degradazione di SANGER
Utilizza il reattivo di Sanger : 2,4-dinitrofluorobenzene (2,4D)
Dopo aver marcato il peptide con il reattivo di Sanger, si idrolizza in ambiente
acido ottenendo l’amminoacido N terminale marcato dal 2,4 D, che viene
separato e identificato
Identificazione dell’amminoacido C-terminale
L'identificazione dell'amminoacido C-terminale di una sequenza amminoacidica viene
effettuata impiegando un enzima, la carbossipeptidasi, in grado di idrolizzare il
legame peptidico a partire esclusivamente dall'unità C-terminale