BRCA1 – BRCA2 &
GENI SOPPRESSORI DI METASTASI
Fermo Raffaella
Nunziata Daniela
CHE COS’E’ IL CANCRO?
Il cancro può essere considerato una
malattia dovuta ad una sregolazione del
bilancio tra:
proliferazione
differenziazione
apoptosi
COME SI SVILUPPA IL CANCRO?
Lo sviluppo dei tumori nell’uomo è il risultato di una
complessa interazione tra:
Genoma umano
Fattori ambientali
La probabilità che una persona sviluppi tumore è 1: 1029
FATTORE GENETICO
Le mutazioni del DNA che sono alla base del cancro
possono essere:
germinali, che conferiscono suscettibilità
(trasmissione mendeliana)
somatiche (dette sporadiche).
Sono necessarie 6-7 mutazioni per convertire una
cellula normale in una neoplastica.
IPOTESI DI KNUDSON
FATTORE GENETICO
I GENI RESPONSABILI DEI
TUMORI
Le mutazioni tumorali solitamente interessano geni
che controllano la progressione del ciclo cellulare o
l’apoptosi
G0
M
R
G1
G2
S
Ciclo cellulare e “check point”
IL CICLO CELLULARE
Le principali alterazioni che intervengono durante il ciclo
cellulare interessano:
i punti di restrizione
proteine check-point
inibitori delle CDK
ONCOGENI / ONCOSOPPRESSORI
Oncogeni :controllo positivo della proliferazione
Oncosoppressori suddivisi in:
geni che controllano negativamente la proliferazione
geni che controllano la stabilità del DNA
ONCOGENI
Le proteine da essi
distinguere in 5 classi:
sintetizzati
si
possono
fattori di crescita
recettori di superficie
componenti del sistema intracellulare di
traduzione del segnale
proteine che si legano al DNA, fattori di
trascrizione
cicline, chinasi- dipendenti e i loro inibitori
ONCOGENI
Perché si abbia la trasformazione da protooncogene ad oncogene è sufficiente una mutazione
in una della due copie geniche “a singola dose
genica”.
L’attivazione può avvenire mediante:
Mutazione puntiforme
Traslocazione
Amplificazione
Mancata ubiquitazione
ONCOSOPPRESSORI
Le proteine da essi sintetizzate fanno parte di
sistemi difensivi che mantengono l’integrità del
genoma e che sono capaci di:
rilevare la presenza di danni
bloccare la progressione del ciclo per consentire il
riparo del DNA
dare inizio al processo di apoptosi (nel caso in cui
il danno sia irreparabile)
Per gli oncosoppressori, a differenza degli
oncogeni, è necessario che entrambe le copie
geniche siano mutate perché si abbia la perdita
della loro funzione (“doppia dose genica”).
BRCA1 / BRCA2
Le alterazioni nell’ espressione di proteine del
pathway “risposta al danno del DNA” sono
fondamentali nell’eziologia di molti tumori.
Le proteine note per la loro attività di
oncosoppressori, quali BRCA1 (17q21) e BRCA2
(13q12) sono collegate ed integrate in alcuni
fondamentali “pathway”.
QUALI SONO LE NORMALI FUNZIONI
DI BRCA1 / BRCA2?
inibiscono la crescita
delle ghiandole
mammarie
interagiscono con le
proteine RAD (BRCA1RAD50; BRCA2-RAD51)
regolano l’attività di altri
geni (p21)
giocano un ruolo
fondamentale
nell’embriogenesi
BRCA1 / BRCA2
Le mutazioni a carico di questi geni sono
responsabili dell’80% e 14% rispettivamente del
cancro alla mammella e del 60% e 27%
rispettivamente del cancro all’ovaio.
Sono state identificate oltre 600
(proteine tronche) in BRCA1 e BRCA2:
mutazioni
187delAG, 5385ingC,5382insC
3,8 kb delezione dell’esone 13; 6-kb duplicazione dell’esone
13; 7,1 kb del dell’esone 8-9; 26 kb delezione dell’esone 1420
Altri riarrangiamenti sono stati identificati nella trascrizione
dell’RNA
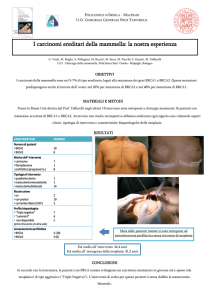
TUMORI FAMILIARI
Il 5-10% di tutte le neoplasie hanno una base
ereditaria.
Condizione di predisposizione
editaria:
più casi di carcinoma alla
mammella in parenti di primo
grado soprattutto in giovane età
o con un coinvolgimento di
entrambe le mammelle
carcinoma dell’ovaio in familiari
di primo grado
casi di carcinoma della
mammella maschile (BRCA2)
TUMORI FAMILIARI
Hanno modalità di trasmissione autosomica
dominante, con penetranza variabile:
Età
Rischi
BRCA1
BRCA2
30 anni
3.2 %
4.6 %
40 anni
19.1 %
12 %
50 anni
50.8 %
46 %
60 anni
54.2 %
61 %
70 anni
85 %
86 %
METASTASI
I tumori grandi
hanno
maggiori
probabilità
di
infiltrare anche se
tale grandezza non
è
strettamente
correlata con le
proporzioni
delle
metastasi.
VIA LINFATICA
VIA EMATICA
PER CADUTA
METASTASI
Tale processo è quindi costituito da una serie di
“sequential step” e, a secondo del tessuto di origine
del tumore, possono proliferare all’interno o
all’esterno del vaso.
Entrano nel tessuto secondario legandosi:
endotelio vascolare
sostanze chemiotattiche(chemiochine)
METASTASI
TUMOROGENESI
(instabilità genetica)
METASTATIZZAZIONE
MICROAMBIENTE
(sistema endocrino- immunologico)
METASTASI
Nella prima fase(6-24 h) vi è un primo declino
esponenziale del loro numero dovuto a :
trauma meccanico
tossicità dell’ossigeno
sistema immune
Un secondo declino può essere dovuto a:
apoptosi (entro le 24 h)
periodo di dormienza pre- angiogenico (equilibrio tra
proliferazione e apoptosi)
POTENZIALE METASTATICO
Le metastasi sono la principale causa di
morte nei pazienti affetti da cancro, per cui
diviene di importanza sempre maggiore
definire il POTENZIALE METASTATICO.
Il primo gene ad essere individuato fu
l’nm23
(non
metastasi
23),
che
normalmente dovrebbe essere in equilibrio
con un altro gene denominato h-prune (il
quale invece promuove l’insorgenza di
metastasi nel carcinoma alla mammella)
ESEMPI DI SOPPRESSORI DI
METASTASI (al seno)
KISS-1:livelli alti nella placenta, in corso di gravidanza
ridotti nell’adenocarinoma
Ruolo: controllo migrazione e invasione.
CAD1: presente nel 50% dei soggetti affetti da
cancro al seno e tumori gastrici.
Ruolo: “probabilmente” traduce segnali specifici
supporto all’invasione tumorale.
BRMS1: cromosoma 11. La sua espressione
è inversamente correlata con le metastasi
nelle cellule del melanoma.
ridotta in una variante metastatica del
carcinoma.