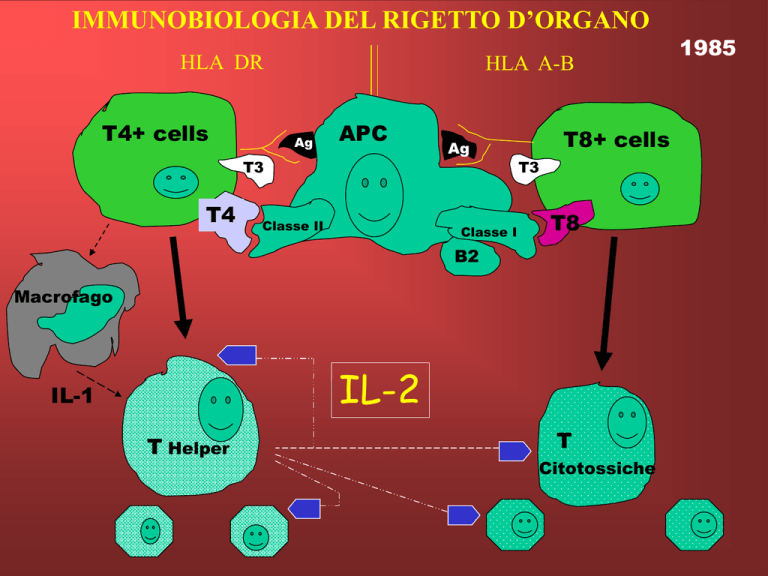
IMMUNOBIOLOGIA DEL RIGETTO D’ORGANO
HLA DR
T4+ cells
HLA A-B
Ag
T3
T4
APC
APC
Classe II
Ag
Classe I
T8+ cells
T3
T8
B2
Macrofago
IL-2
IL-1
T Helper
T
Citotossiche
1985
IMMUNOBIOLOGIA DEL RIGETTO D’ORGANO
Ipersensibilità
ritardata
RICONOSCIMENTO
INDIRETTO
Self
antigen
presenting
cell
Self MHC
classe II +
Allopeptide
Macrofago
attivato
TCR
CD4
T cell
CD4
T cell
CD4 T cell
citochine
+
espansione
clonale
Produzione
alloanticorpi
B cell
MHC class I
TCR
Allo MHC
Classe II
RICONOSCIMENTO
DIRETTO
Alloantigen
presenting
cell
1999
CD 8
Graft
cell
TCR
Citotossicità diretta
Il riconoscimento solo dell’antigene non è sufficiente ad attivare
pienamente i CD4, occorre un secondo segnale costimolatore
che proviene da altre interazioni recettoriali.
APC
LFA1
B7
ICAM-1
CD28
MHC
Classe II
?
TCR
CD3
CD4
CD45
CD40
CD154
LFA3
CD2
ICAM-1
LFA1
T cell
INTERAZIONI COSTIMOLANTI MEGLIO CARATTERIZZATE:
- CD 28/B7
- CD 154/CD40
Anticorpi monoclonali o agenti “bloccanti questi recettori di superficie
a livello ancora sperimentale sono effettivamente immunomodulatori
PER UNA BUONA SOPRAVVIVENZA DEL TRAPIANTO RENALE.
Riduzione delle crisi di rigetto acuto (attualmente 25%)
Ripresa diuretica immediata
(brevi tempi di ischemia fredda, evitare nefrotossicità)
Dose nefronica ottimale
Trapianto da vivente anche da non apparentato
Matching HLA ?
SIERO ANTILINFOCITARIO
ALG
MONOCLONALI
OKT3
STEROIDI
SIERO ANTITIMOCITICO
ATG
DACLIZUMAB
BASILIXIMAB
AZATIOPRINA
CICLOSPORINA
MICOFENOLATO
TACROLIMUS
SIROLIMUS
FTY 720
SDZ-RAD
Target molecolare
Effetti molecolari
Side effects
ATG/ALG Antigeni multipli
o cellule linfoidi
Lisi complemento mediata
Opsonizzazione e clearance
Modif. recettori di superficie
Malattia da siero
Piastrinopenia
Granulocitopenia
OKT3
Lisi complemento mediata
Opsonizzazione e clearance
Modifiche recettore CD3
Cytokine release
syndrome (febbre
cefalea, edema polm
CD3 T cells
DACLIZUMAB
BAXILIXIMAB
Anticorpi monoclonali umanizzati che bloccano una sub -unità del
recettore dell’IL2
Lunga emivita, rarissimi effetti collaterali.
Costimolazione
APC
Stimolo
antigenico
TCR
Recettore
interleuchina 2
Ca2+
Interleuchina 2
Calcineurina
attivata
P
NFAT
NFAT
Interleukin-2 gene promoter
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
Costimolazione
APC
Stimolo
antigenico
TCR
Recettore
interleuchina 2
Ca2+
Interleuchina 2
Calcineurina
attivata
NFAT
P
NFAT
STEROIDI
Interleukin-2 gene promoter
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
ANTICALCINEURINE
CICLOSPORINA
FK 506 (TACROLIMUS)
CyA
“Refreshing”
Costimolazione
APC
Stimolo
antigenico
TCR
Recettore
interleuchina 2
CyA
Ca2+
Interleuchina 2
Ciclofillina
Calcineurina
attivata
P
NFAT
NFAT
Interleukin-2 gene promoter
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
CICLOSPORINA
Microemulsione (Neoral)
- Maggiore biodisponibilità e stabilità ematica
Effetti collaterali:
NEFROTOSSICITA’ (anticalcineurina)
Irsutismo
Ipertrofia gengivale (soprattutto se associata a Calcio antagonisti)
Iperuricemia
Iperglicemia
Ipercolesterolemia
Disturbi neurologici (tremori soprattutto)
Tendenza ad ipertensione e ritenzione idrosodica
Ipomagnesiemia
Target trough levels T2 > 800 ng/ml
CICLOSPORINA CURIOSITA’
Stimola la produzione di TGF-Beta:
- Aumento matrice mesangiale
- Induzione in vitro di transdifferenziazione neoplastica
ACE inibitori e ANGIO II inibitori a livello sperimentale
riducono l’espressione di TGF-beta
CICLOSPORINA Interferenze Farmacologiche
Cimetidina
Ciprofloxacina
Clotrimoxazolo
Eritromicina
Diltiazem
Conazolici
Ca-Antagonisti
Naringenina
Livelli
ematici
Barbiturici
Anticonvulsivanti
Rifampicina
Isoniazide
Induttori enzimatici
FK 506
“ some news”
Costimolazione
APC
Stimolo
antigenico
TCR
Recettore
interleuchina 2
FK 506
Ca2+
Interleuchina 2
FK binding protein
Calcineurina
attivata
P
NFAT
NFAT
Interleukin-2 gene promoter
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
FK 506 (Tacrolimus)
Anticalcineurina molto più potente della Ciclosporina
forse per maggiore affinità di legame
Minor dipendenza dal ricircolo entero-epatico e maggiore
stabilità ematica (più lenta la modificazione dei levels 48 h)
Minor incidenza di rigetti acuti nei trial controllati
Impiegato per os nel rescue treatment dei rigetti o conversioni
mirate, oppure quando si vuole sospendere lo steroide
Dose 0.2 mg/Kg/die
Trough level 8-15 ng/ml
Recentemente usato il succo di pompelmo per aumentare
la dose di picco ai “cattivi assorbitori”
FK 506 (tacrolimus)
Effetti collaterali:
NEFROTOSSICITA’ (Anticalcineurina)
NEUROTOSSICITA’
IPERGLICEMIA
Bassa incidenza di:
Iperlipidemia
Irsutismo
Ipertensione arteriosa
Riassunto complicanze potenziali degli
inibitori delle calcineurine
CyA
FK506
Nefrotossicità
+++
+++
Neurotossicità
+
+++
Intoll. Glucidica
+
+++
Irsutismo
+++
-
Ipertensione
+++
++
Iperplasia Gengivale
+++
-
++
+
Dislipemia
AGENTI
ANTIPROLIFERATIVI
AZATIOPRINA
MICOFENOLATO
SIROLIMUS
Costimolazione
APC
Stimolo
antigenico
TCR
Recettore
interleuchina 2
Ca2+
Interleuchina 2
Calcineurina
attivata
P
NFAT
NFAT
Interleukin-2 gene promoter
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
A
Z
A
T
I
O
P
R
I
N
A
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
mmmmmmm
AZATIOPRINA
Analogo delle purine che inibisce la sintesi del DNA
impiegato sin dal 1960.
Ricordarsi sempre dell’interazione nefasta sul midollo
dell’associazione con l’allopurinolo perché ne aumenta
a dismisura l’emivita non essendo in grado di degradarla
Principale effetto collaterale: soppressione midollare
Curiosità:
Esistono demetilatori veloci e lenti dell’azatioprina e questo
ne spiega la particolare sensibilità midollare in alcuni individui
MICOFENOLATO
“ Alternative?”
MICOFENOLATO MOFETILE
Inibitore altamente selettivo reversibile e non competitivo
della inosin monofosfato deidrogenasi (IMPDH). Enzima cruciale
nella sintesi de novo della guanosina
I linfociti proliferanti sono avidi e completamente dipendenti
dalla sintesi de novo della guanosina. Mentre molte altre cellule
vivono benissimo sfruttando la sola via di salvataggio
I nucleotidi della guanosina sono anche implicati nella
glicosilazione delle molecole di adesione linfocitaria e
monocitaria. Questo sarebbe il razionale per cui il micofenolato
dovrebbe teoricamente ridurre la proliferazione di matrice
extracellulare (vedi sclerosi e rigetto cronico)
MICOFENOLATO MOFETILE
Dosaggi: max impiegati attualmente 2 g/die,
mantenimenti con 1 g/die
Effetti collaterali:
Gastrolesivo (utile associazione con inibitori pompa protonica)
Diarrea (riducendo la dose migliora)
Meno frequentemente: leucopenia, epatopatia
Possibilità di maggiori infezioni (CMV principalmente)
Curiosità:
probabilmente inibisce un enzima che è
alla base della crescita dello Pneumocistiis Carinii
Ricordarsi aggiustamento posologia in IRC (non codificato)
Non interferenze con l’allopurinolo
MICOFENOLATO MOFETILE
Riduzione dei rigetti acuti del 50% e minori dosi di steroide
Follow-up a tre anni no improvement of long-term graft survival
Impressione clinica:
Immunodeprime più dell’azatioprina, ma se per questa la
conta leucocitaria era un marker di immunodepressione,
con il micofenolato esponiamo i pazienti a
overimmunosuppression senza accorgercene (tumori) e
le bassi dosi a volte sono meno
immunosoppressive dell’azatioprina stessa..
RAPAMICINA
“News”
Costimolazione
APC
Stimolo
antigenico
TCR
RAPAM
Ca2+
FKBP
Interleuchina 2
FKBP
Calcineurina
attivata
P
NFAT
NFAT
Interleukin-2 gene promoter
Recettore
interleuchina 2
mTOR
Sintesi
purine de novo
G1
S
Ciclo
cellulare
M
G2
RAPAMICINA (Sirolimus)
La rapamicina blocca la progressione del ciclo cellulare
e non è NEFROTOSSICA
La sua attività non si limita alle cellule linfoidi, ma in vitro
inibisce la proliferazione di cellule tumorali non
linfoidi e dei fibroblasti (a concentrazioni + elevate)
Sembrerebbe più razionale il suo impiego in associazione
a Ciclosporina che FK506 vista l’affinità recettoriale
Dose in mg 2-8 mg/die
Commercializzata a Marzo
Trough levels variabili ancora in base ai trial e dosaggio
centralizzato in Inghilterra al momento
RAPAMICINA (Sirolimus)
Studi clinici in Fase III hanno evidenziato:
Associazione CyA + Steroide + Rapa max
10% di rigetti acuti
Ad un anno lo steroide è praticamente sospeso a tutti i pazienti
RAPAMICINA (Sirolimus)
Effetti collaterali
IPERLIPIDEMIA
PIASTRINOPENIA
ARTRITI (potenziano la CIPS?)
RAPAMICINA (Sirolimus)
INTERFERENZE FARMACOLOGICHE CONOSCIUTE
Ketoconazolo
Diltiazem
Neoral
FK506?
AUC
Barbiturici
Rifampicina
SDZ- RAD
Derivato dalla rapamicina con 1/3 di effetto in vitro
ma lo stesso effetto in vivo
Dovrebbe indurre minor iperlipidemia
FTY 720
“The Future?”
FTY 720
Ancora scarse le informazioni ma:
Modificherebbe l’ “homing” linfocitario
Nessun effetto collaterale sinora dimostrato
Compresse per os
Utilizzato in associazione a CyA
Dovrebbe partire un trial fase IIb a Torino
Alcune pozioni
attualmente
in uso
Induzione: Baxiliximab
Mantenimento:
Ciclosporina + micofenolato + steroide
FK 506 + steroide
FK 506 + azatioprina + steroide
FK 506 + Micofenolato + Steroide
Ciclosporina + rapamicina + steroide (poi sospensione
CyA)
Ciclosporina + RAD + steroide per otto giorni
Possibili conversioni:
Ciclosporina vs FK 506 + sospensione steroide
Rapamicina + riduzione dose CyA + sospensione steroide
Micofenolato + riduzione dose CyA + sospensione steroide
Sarà teoricamente possibile un trapianto senza
inibitori delle calcineurine attualmente nefrotossici
E’ già possibile “concertare” terapie di mantenimento
con sospensione rapida dello steroide (ottava giornata)
Grazie per la vostra
attenzione !!!!