ENZIMI
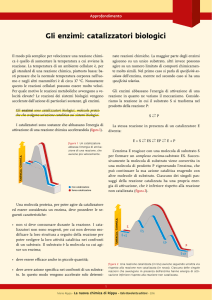
Gli enzimi sono molecole proteiche aventi il compito di
catalizzare praticamente tutte le reazioni chimiche che
avvengono negli organismi viventi.
Svolgono il loro ruolo con modalità differenti da reazione a
reazione, ma in tutti i casi la catalisi procede attraverso la
formazione di complessi tra l'enzima e i reagenti.
1
La più semplice reazione catalizzata da un enzima può essere così
rappresenta da:
E + S <===>ES <====>EP <====> E + P
L'enzima si combina con l'unico reagente S, detto substrato, per
formare un complesso enzima-substrato, ES. ES è poi trasformato
in EP che si scinde in prodotto P ed enzima libero, che è
nuovamente disponibile per reagire con un'altra molecola di S.
Il processo può avvenire in maniera estremamente rapida: in molti
casi una sola molecola di enzima è in grado di trasformare in 1
secondo migliaia di molecole di substrato in prodotto.
La velocità di una reazione catalizzata da un enzima può essere fino
a 1014 volte superiore alla velocità della stessa reazione non
catalizzata.
2
Come ogni catalizzatore, gli enzimi accelerano le reazioni (che
coinvolgono composti organici) abbassando l’energia di
attivazione.
Costante cinetica espressa nella forma di Arrhenius:
K=A*exp(-Ea/RT)
3
Modello chiave-serratura
Il primo modello ad essere stato messo a punto per spiegare la
specificità degli enzimi è quello suggerito da Hermann Emil Fischer
nel 1894, secondo il quale l'enzima ed il substrato possiedono una
forma esattamente complementare che ne permette un incastro
perfetto.
Questo modello spiega bene la specificità degli enzimi, ma è
decisamente insufficiente per spiegare la stabilizzazione dello
stato di transizione che l'enzima raggiunge durante il legame con
il substrato.
4
Modello dell’adattamento indotto
Nel 1958 Daniel Koshland propose una modifica del modello
chiave-serratura: dal momento che gli enzimi sono strutture
relativamente flessibili, egli suggerì che il sito attivo potesse
continuamente modellarsi in base alla presenza o meno del
substrato. Come risultato, il substrato non si lega semplicemente
ad un sito attivo rigido, ma genera un rimodellamento del sito
stesso, che lo porta ad un legame più stabile in modo da portare
correttamente a termine la sua attività catalitica.
5
L'enzima esochinasi è un esempio del modello
dell'adattamento indotto: quando il glucosio si avvicina al
sito attivo (immagine a sinistra - freccia), l'enzima cambia
conformazione, avvolgendosi attorno al substrato (destra).
6
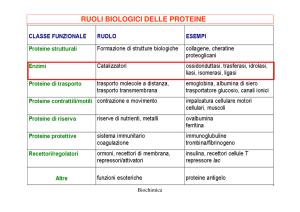
Esistono sei differenti classi di enzimi secondo la natura delle
reazioni che catalizzano:
• Ossidoreduttasi: catalizzano reazioni di ossidoriduzione e
includono le ossidasi (ossidazione diretta con ossigeno), le
deidrogenasi (rimozione di idrogeno), ecc;
• Transferasi: catalizzano il trasferimento di un gruppo
funzionale da un donatore ad un accettore;
• Idrolasi: catalizzano reazioni di idrolisi (proteasi, esterasi,
ecc);
• Liasi: catalizzano le addizioni al doppio legame o le
eliminazioni con formazione di doppi legami;
• Isomerasi: catalizzano le isomerizzazioni all'interno di una
molecola;
• Ligasi: catalizzano la formazione di un legame covalente tra
due molecole.
7
Cofattori o attivatori
Molti enzimi richiedono la presenza di gruppi non proteici per
svolgere la loro azione catalitica. Questi gruppi sono detti cofattori
e rientrano in 3 gruppi principali:
1. Coenzimi: molecole organiche che possono essere separate
dall’enzima.
2. Gruppi prostetici: sono legati all’enzima da cui non si distaccano
né durante il corso della reazione, né ad enzima inattivo.
3. Ioni organici (K+, Na+, Mg2+, Zn2+, Ca2+, Fe3+, ecc).
Il complesso enzima-cofattore è detto oloenzima.
Mentre se si rimuove il cofattore rimane l’apoenzima inattivo.
8
9
10
11
12
13
CINETICA DI MICHAELIS-MENTEN
14
15
16
17
18
19
20
21
EFFETTO DEL pH
Come detto, l’enzima può contenere gruppi carichi sia
positivamente sia negativamente ad un dato pH.
Tali gruppi ionizzabili sono spesso parte del sito attivo. Perché
possano esplicare azione catalitica, i gruppi ionizzabili del sito
attivo devono spesso possedere ciascuno una particolare carica,
cioè l’enzima catalitico attivo esiste solo in un particolare stato di
ionizzazione. Pertanto, l’enzima cataliticamente attivo può
essere solo una frazione dell’enzima totale a seconda del pH.
22
Effetto del pH
23
24
ea + S <===> ea S
ea S <====> ea + P
Ks
k
25
Effetto della temperatura
Un aumento della temperatura tra 0 e 40-50 °C accresce l’attività
della maggior parte degli enzimi a causa dell’aumento delle
collisioni efficaci tra i reagenti (vedi eq.ne di Arrhenius).
Al di sopra di 40-50°C l’attività decade in genere drasticamente, fino
ad annullarsi, nella maggior parte dei casi, intorno a 60°C a causa
della disattivazione dell’enzima. Infatti, all’aumentare della
temperatura gli atomi nella molecola dell’enzima hanno maggiore
energia e quindi una maggiore tendenza a muoversi, superando
così le deboli interazioni che tengono insieme la struttura globulare
della proteina (denaturazione).
26
27
28
29