Biologia Molecolare
Prodotti da geni clonati nativi e
manipolati
Fattori che influiscono sull’espressione dei
geni clonati
Nella fusione traduzionale la
proteina clonata avrà un
frammento iniziale non presente
nella proteina originaria
Fattori che influiscono sull’espressione dei
geni clonati
Se non è possibile inserire il
frammento “in frame”:
-Cambiare la scelta del
vettore
-Modificare il vettore e/o
l’inserto (utilizzando dei
linker)
-Generare il frammento dai
inserire utilizzando la PCR
per ineririre un sito di
restrizione appropriato
Espressione in cellule eucariotiche
Sistemi di espressione in Lievito:
-Crescono rapidamente
-Terreni di coltura semplici
-Facili da manipolare e contare (unicellulari)
-Saccharomyces cerevisiae, Pichia pastoris
Saccharomices:
•Per molti aspetti l’approccio è molto simile a quelli visti per i batteri
•E’ possibile utilizzare vettori episomici
•Si possono usare vettori che possiedono l’origine di replicazione episomica (alto
numero di copie) o vettori dotati di centromero (di solito una copia per cellula)
•Utilizzo di vettori Shuttle
•Promotore regolabile (di solito promotore ed enhacer del gene GAL1)
Espressione in cellule eucariotiche
Pichia pastoris:
-Può utilizzare metanolo come fonte di carbonio
-Gene AOX1 (alcol ossidasi)
-Gene finemente regolato e promotore altamente efficiente
-Vettori non episomici
-Contengono origine di replicazione per E. coli
Espressione in cellule di insetto:
-Sistema Baculovirus
Il baculovirus AcMNPV (Autographa californica Multicapsid Nucleopolyhedrovirus)
Infetta cellule di insetto. Durante l’infezione
produce una grande quantità della proteina virale
Poliedrina. I virus si riproduce anche senza poliedrina
ma la progenie generata è distinguibile da quella
prodotta dal virus naturale.
Il vettore è troppo grande (> 100kb) per essere
manipolato direttamente, quindi viene utilizzato un
vettore di trasferimento (shuttle).
Sistema Baculovirus
Vettore di
trasferimento
DNA virale
si
Progenie virale “non
aggregata”
Ricombinazione
no
Progenie virale
“aggregata”
Sistema Baculovirus
È possibile aggiungere anche un gene betagalattosidasi (per il facile riconoscimento delle
placche ricombinanti)
-Modificazioni post traduzionali più complesse
(non ottenibili con lievito)
-Meno efficiente (e semplice) dei sistemi di
lievito
-Elevati livelli di proteina ottenuti subito prima
della lisi cellulare
Espressione in cellule di mammifero
Esistono numerosi sistemi di espressione in mammifero
-Vettori basati su Citomegalovirus umano (CMV)
-SV40
-Herpes Simplex
Anche in questo caso è auspicabile il controllo dell’espressione:
È possibile interporre tra il promotore e il gene clonato la sequenza dell’operatore
dell’operone batterico per la resistenza alla tetraciclina.
Trasfettando le cellule con un plasmide contenente il gene repressore per la
tetraciclina (tetR) questo impedisce la attivazione del gene clonato.
La tetraciclina stacca tetR dall’operatore permettendo l’inizio della espressione del
gene clonato.
Si può utilizzare anche il RE per l’ecdisone (elemento di insetto)
-Probabilità più elevata di ottenere proteine di mammifero funzionanti
-Versatilità del targeting proteico utilizzando peptidi segnale
-Costi elevati e produzione quantitativamente non paragonabile ai sistemi batterici
o di lievito.
Aggiunta di marcatori e segnali
-Epitopi
-Estremità di poliistidina (affinità per il
nickel)
-Poliistidina-nickel come epitopo
marcatore
-Possibilità di aggiunegere siti per
peptidasi specifiche
Aggiunta di marcatori e segnali
Segnali di secrezione
E. coli non secerne molte
proteine -> secrezione nello
spazio tra membrana e
parete
Bacillus subtilis (e grampositivi) possono secernere
nel terreno di coltura.
- Segnale N-terminale
contenente diversi
sottodomini, tra cui una
parte centrale idrofobia, che
permette il riconoscimento
da parte di un sistema di
traslocazione
Il processo non dipende solo dal segnale ma
anche dalla struttura generale della proteina!
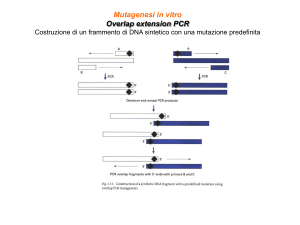
Mutagenesi in vitro
Mutagenesi generalizzata indotta
da agenti mutageni
Beadle & Tatum
-Produzione di mutanti di Neurospora
crassa utilizzando raggi X
-Selezione di mutanti auxotrofi per
l’arginina
-Identificazione di 3 diversi tipi di mutanti:
-Mutanti ARG1: crescono in presenza
di arginina, ornitina o citrullina
-Mutanti ARG2: crescono in presenza
di arginina o citrullina
-Mutanti ARG3: crescono solo in
presenza di arginina
Mutagenesi in vitro
Mutagenesi in vitro
Mutagenesi sito-specifica
Alterazione specifica (singola base
o corta sequenza di basi) a livello di
un sito specifico della sequenza
bersaglio
Mutagenesi in vitro
Mutagenesi sito-specifica
Produzione del 50% dei cloni
mutanti
Inferiore al 50% per riparazione del
DNA non metilato (è possibile
l’utilizzo di ceppi mutanti)
Mutagenesi in vitro
Applicazioni di ingegneria proteica
I vaccini
I vaccini sono costituiti da proteine capaci di attivare risposta immunitaria specifica.
Sono quindi molecole con la stessa attività antigenica dell’agente eziologico verso il
quale si vuole fornire immunità.
Vaccino tradizionale->agente eziologico naturale inattivato
Vaccino ingegnerizzato->viene usata solo la parte antigenica e non la parte
funzionalmente attiva
Vaccini da Subunità
Espresso in:
E. coli -> non funziona
S. cerevisiae -> funziona
Altro esempio: tossina del colera.
Subunità A -> effetto tossico
Subunità B-> non tossica (trasporto)
Vaccini a DNA