Altri Herpes virus
Ubiquitari (> 90% popolazione). Isolati dalla saliva
HHV-6
Linfociti B e T, megacariociti.
Infezione primaria: exanthem subitum (roseola infantum)
Latenza nei linfociti T
Associato a disordini neurologici (encefaliti, convulsioni)
Ruolo nella sclerosi multipla?
HHV-7
Linfociti T (CD4).
Associato a casi di exanthem subitum (roseola infantum)
Gamma-herpesvirus…..
HHV-6
Isolato nel 1986 da PBMC di un paziente immunocompromesso (Salahuddin et
al., 1986). Successivamente si è dimostrato che l’infezione è molto comune e
virtualmente tutti i bambini sono infettati da questo virus nei primi anni di vita.
Classificazione: β-herpesvirus
VARIANTI: HHV-6A e HHV-6B, differiscono nel tropismo, nella sequenza
nucleotidica e nella patogenesi
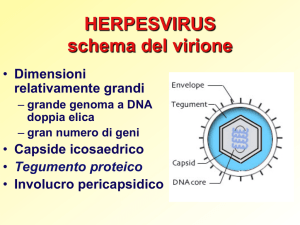
MORFOLOGIA: tipica degli herpesvirus, genoma dsDNA, capside iscosaedrico
ricoperto di tegumento ed envelope lipidico derivato dalle membrane delle cellule
infettate modificate per l’inserimento delle glicoproteine virali (virione Ø 160-200
nm).
TROPISMO: non limitato alle sole cellule linfoidi (linfociti B e T), presenta un
tropismo ampio per diversi tipi di cellule umane (cellule timiche, gliali
megacariociti, fibroblasti), in accordo al fatto che il suo recettore cellulare è il
CD46 (Santoro et al., 1999), una glicoproteina di tipo-1 che appartiene ad una
famiglia di regolatori dell’attivazione del complemento.
LATENZA: instaura un’infezione latente in linfociti T e monociti.
EPIDEMIOLOGIA: Virus ubiquitario, presente in tutte le aree del mondo.
Sieroprevalenza > 90% negli adulti. L’infezione avviene prevalentemente nei primi
mesi di vita: 6-9 mesi (Caserta et al., 2001). La modalità di trasmissione non è
completamente chiarita, HHV-6 replica nelle cellule epiteliali ed è presente nella
saliva.
PATOGENESI: nei bambini l’infezione primaria causa l’exanthem subitum (roseola
infantum, sesta malattia) con febbre alta e lo sviluppo di un rash cutaneo dopo la
risoluzione della febbre (Yamanishi et al., 1988). HHV-6 è correlato anche a
patologie nell’adulto dovute a fenomeni principalmente di riattivazione (sindrome
simil-mononucleosica), che possono essere clinicamente significative soprattutto
nei pazienti immunocompromessi.
…..è stato suggerito che possa essere associato a patologie autoimmuni come
artrite reumatoide, sclerosi multipla…..
DIAGNOSI DI LABORATORIO: ricerca di anticorpi o ricerca del virus mediante
PCR nel sangue e nella saliva.
Altri Herpes virus
Ubiquitari (> 90% popolazione). Isolati dalla saliva
HHV-6
Linfociti B e T, megacariociti.
Infezione primaria: exanthem subitum (roseola infantum)
Latenza nei linfociti T
Associato a disordini neurologici (encefaliti, convulsioni)
Ruolo nella sclerosi multipla?
HHV-7
Linfociti T (CD4).
Associato a casi di exanthem subitum (roseola infantum)
Gamma-herpesvirus
I gamma-herpesvirus umani
Lymphocryptovirus
Virus di Epstein Barr (EBV)
Rhadinovirus
Herpesvirus umano 8 (HHV-8) o
Kaposis’s sarcoma associated herpesvirus (KSHV)
La struttura di questi virus e la modalità di replicazione sono
riconducibili a quelle comuni della famiglia.
Virus di Epstein-Barr (EBV) (I)
- Scoperto nel 1964 da Epstein e Barr analizzando in
microscopia elettronica delle biopsie linfonodali prelevate da
adolescenti centroafricani con tumore di Burkitt.
- E' un virus molto diffuso, oltre il 90% della popolazione
adulta è sieropositiva per EBV.
Virus di Epstein-Barr (EBV) (II)
- EBV è l’agente etiologico della mononucleosi infettiva, una
malattia tipica dei giovani adulti. Di solito nell’infanzia è
asintomatica.
- La malattia si manifesta con febbre, faringite,
ingrossamento dei linfonodi, splenomegalia, alterazioni delle
funzioni epatiche.
- EBV viene trasmesso attraverso le secrezioni faringee,
spesso tramite scambio di saliva:
Bacio (adolescenti/adulti)
Contatti all’interno della famiglia o negli asili (spesso
attraverso oggetti: posate, piatti, bicchieri, giocattoli,
etc.)
Virus di Epstein-Barr (EBV) (III)
- La sede del primo impianto sono le cellule epiteliali del
faringe, dove si instaura un’infezione produttiva.
- Da qui il virus viene trasmesso ai linfociti B, dove instaura
un’infezione non produttiva (latenza).
- Recettore cellulare per l’EBV
CR2, CD21: recettore per il C3d del complemento
corecettore: molecole di classe II HLA
Linfociti B, cell. epitelio oro- e naso-faringe, cellule
dendritiche follicolari, cell. cervice uterina
Virus di Epstein-Barr (EBV) (IV)
Nell’epitelio oro-faringeo il virus, dopo l’infezione primaria, può dar luogo a
un’infezione litica persistente che può durare alcuni anni.
Il soggetto infetto anche se asintomatico funziona da sorgente di infezione.
Il genoma virale è presente in forma circolare episomiale all’interno del nucleo.
Comparsa e durata degli anticopri anti-EBV
EBV VCA IgM sono in genere già presenti all'esordio clinico. Declinano con la guarigione, ma in una piccola percentuale dei casi (10%)
possono essere rilevabili fino a 4 mesi dalla presentazione della malattia, (eccezionalmente osservati fino ad 1 anno).
EBV VCA IgG possono essere già presenti all’esordio clinico, aumentano fino ad un picco in 3-4a settimana e poi declinano in un periodo di
mesi. Possono essere rilevate a basso titolo per tutta la vita.
EBNA IgG compaiono tardivamente in fase di convalescenza 1-2 mesi dopo l'esordio della malattia. Persistono per tutta la vita. La comparsa
di anticorpi anti-EBNA in persone precedentemente positive per VCA e negative per EBNA documenta una sieroconversione e quindi
infezione recente.
Anticorpi eterofili: anticorpi (IgM) reattivi contro antigeni di specie diversa, in particolare contro antigeni di superficie di emazie di pecora e
di cavallo (emoagglutinine) o di bue (emolisine).
EBV: diagnosi, terapia e profilassi
La diagnosi si basa attualmente:
sulla dimostrazione di anticorpi contro le proteine virali precoci, nucleari o
del capside virale (ELISA o immunofluorescenza su linfociti paziente)
ricerca del genoma con PCR (PCR quantitativa)
Non è attualmente disponibile un vaccino efficace
Gli antivirali efficaci contro altri herpesvirus non hanno dimostrato alcuna
efficacia nella progressione della malattia
EBV e tumori
L’EBV è classificato dall’International Agency for Research on Cancer come
agente di tipo 1: agente cancerogeno nell’uomo.
L’infezione da EBV è significativamente associata a:
Linfoma di Burkitt (endemico in Africa)
Malattia linfoproliferativa e linfomi immunoblastici in pazienti
immunocompromessi (trapiantati, AIDS)
Mononucleosi linfoproliferativa fatale associata a immunodeficienza congenita
(XLP)
Carcinoma nasofaringeo
Nei pazienti con AIDS si ritiene associato alla leucoplachia orale
EBV e tumori
In vitro può infettare ed immortalizzare i linfociti B.
La capacità trasformante dell’EBV è tipicamente legata
all’espressione delle proteine di latenza:
6 proteine a localizzazione nucleare
EBNA – 1, 2, 3A, 3B, 3C e LP
3 proteine localizzate sulla membrana
LMP1, LMP2A, LMP2B
EBV e tumori
Proteine espresse durante la latenza
LMP 2
EBERs
EBERs
EBERs
EBNA-3A
LMP 1
EBNA-1
BARF0
LMP 2
EBNA 1
BARF0
EBNA-3B
EBNA-1
EBNA-3C
EBNA-2
LP
LMP 1
BARF0
Latenza di tipo I
Latenza di tipo II
Latenza di tipo III
linfoma di Burkitt
Linfoma di Hodgkin
Carcinoma Nasofaringeo
PTLD
Linee cellulari Linfoblastoidi
Gli antigeni nucleari (EBNA) e le proteine di membrana (LMP)
sono correlate con l’immortalizzazione dei linfociti B
EBNA-1: si lega al DNA virale e consente
al genoma EBV di essere mantenuto nella
cellula B come DNA episomiale circolare
EBNA-2: incrementa l’espressione delle
LMP1 e LMP2, così come di proteine
cellulari che contribuiscono alla crescita e
trasformazione di cellule B.
EBNA-3C: aumenta espressione CD23
LMP1:si associa con molecole di membrana e
induce:
• molecole di adesione (vimentina, ICAM 1, LFA
1, and LFA 3) (adesionione omotipica)
•Espressione bcl2
•Calcio intracellulare
•Markers di attivazione (recettore della transferrina,
HLA-II, CD21, CD23, CD39,CD40, CD44)
•Altera il pathway di risposta a TGF-beta
LMP2A: attiva il pathway tirosin-chinasico del Bcell receptor desensibilizzando l’ulteriore
attivazione dei B
Co-fattori
Lo sviluppo del tumore richiede comunque
la presenza di co-fattori
Risposta CTL (EBNA 2, 3A, B, C) controlla l’infezione
Deficit CTL
per cause endogene (es. immunodeficenza congenita)
per cause esogene (es. malaria, immunodeficienza
post-trapianto, AIDS)
Favorisce la proliferazione policlonale dei linfociti B e i successivi
eventi genetici (es. traslocazione e attivazione di c-myc)
Patogenesi multifattoriale del linfoma di Burkitt
Deficit CTL
EBV
Malaria
B
• Attivazione policlonale dei linfociti B,
proliferazione e immortalizzazione
• Blocco della differenziazione
a plasmacellula
Linfocita B
quiescente
Attivazione
policlonale dei linfociti B,
soppressione dei linfociti T
Linfociti B attivati e proliferanti
Evento
genetico
L.Burkitt
Traslocazione cromosomica,
attivazione c-myc
Cellula tumorale
Linfoma di Burkitt
Burkitt’s Lymphoma
traslocazioni
8;14 (90%)
2;8 (5%)
8;22 (5%)
myc
Linfoma di Burkitt
Persistenza di EBV nei tessuti e nel sangue periferico
Kimura H et al., Rev. Med Virol 2008
Metodi di valutazione della carica virale di EBV
Kimura H et al., Rev. Med Virol 2008
Valutazione della carica virale di EBV e PTLD
Kimura H et al., Rev. Med Virol 2008
Uccisione selettiva delle cellule tumorali EBV+ mediante
chemioterapia/RT e ganciclovir
Herpesvirus umano di tipo 8
E’ il più recente herpesvirus umano scoperto
Identificato nel 1994 con un approccio di biologia
molecolare in biopsie di sarcoma di Kaposi
Genoma dsDNA di circa 165 kbp
Classificato tra i Rhadinovirus
Virus di difficile coltivazione
Diffusione e modalità d’infezione
Diversamente dagli altri herpesvirus HHV-8 è poco
diffuso nella popolazione generale.
E’ presente in determinate aree geografiche: Italia, Egitto,
Israele, Grecia e regione sub-sahariana.
La trasmissione avviene tramite la via alimentare e
sessuale.
Patologie associate all’infezione con HHV-8
Malattia
Multicentrica di
Castleman
Iperplasia
policlonale
Sarcoma di
Kaposi
Linfoma ad
effusione
primaria
Proliferazione
Clonale
HHV-8 è classificato dall’International Agency for Research on Cancer come
agente di tipo 2a: agente probabilmente cancerogeno nell’uomo.
HHV-8 DNA in leucociti circolanti
La cellula infettata è positiva in sezioni consecutive,
dimostrando la specificità del segnale
sezione I
Blasig et al., 1997
sezione II
HHV-8 è presente nei linfociti B derivati da PEL (BCBL-1)
Riattivazione dell’infezione con TPA
HHV-8 e PEL
Effusioni maligne delle cavità viscerali
Rappresentano un tipico processo neoplastico, a differenza del KS
Estremamente aggressivi in corso di AIDS
100% infettati latentemente da HHV-8 (molti co-infettati da EBV)
Le cellule derivate da PEL esprimono i geni di latenza di HHV-8 e nello
0.1-1% di esse si riattiva l’infezione litica spontaneamente
Le cellule derivate dai PEL, a differenza delle cellule derivate dal KS sono
trasformate e tumorigeniche in topi immunodeficienti
Interazioni delle proteine di HHV-8 con proteine che controllano
il ciclo cellulare
Interazione di HHV-8 con molecole che regolano le
risposte immuni
K3, K5 sequestrano molecole di MHC classe I nel reticolo
endoplasmatico
K5 inoltre diminuisce l’espressione delle molecole co-stimolatorie
B7.1 e di ICAM-1
Ciò potrebbe contribuire alla ridotta attività CTL
verso cellule latentemente infettate da HHV-8
ed inibire le risposte delle cellule NK
Coscoy et al., PNAS 2000
Ishido et al., J. Virol. 2000; Immunity 2000
Stevenson et al., PNAS 2000
Brander et al., J. Immunol. 2000
HHV-8 e trasformazione cellulare
Le interazioni delle proteine di HHV-8 con proteine che
regolano il ciclo cellulare e i segnali di attivazione
dell’immunità innata, nonché la modulazione dell’espressione
di molecole che regolano le risposte immuni, producono come
effetto finale l’attivazione della proliferazione cellulare,
l’inibizione dell’apoptosi
e potrebbero contribuire all’ “immune escape” di HHV-8
e potrebbero perciò contribuire ai processi di trasformazione
cellulare e di carcinogenesi
HHV-8 e KS
Evidenziato in PCR in:
80-100% lesioni KS (AIDS-KS, CKS, PT-KS, AKS)
40-80% dei PBMC di pazienti con KS
10-30% dei PBMC di individui omosessuali
0-20% dei PBMC di donatori normali con prevalenza
diversa in base alle aree geografiche (USA, Nord Europa,
paesi bacino mediterraneo, Africa)
HHV-8 e KS
Presente nella popolazione normale, e in particolare nelle aree ad alta incidenza
di KS (Mediterranean area e Africa), ma anche in regioni a bassa incidenza di
KS
Il carico virale è elevato nei pazienti con KS o a rischio per KS ed è associato
con attivazione di citochine Th1 e produzione di citochine proinfiammatorie IC)
Nelle lesioni il carico virale di HHV-8 aumenta con la progressione e la
presenza di citochine infiammatorie (CI) precede (aumenta il carico virale) il
ritrovamento del virus nei tessuti
CI mantengono e aumentano il carico virale nei PBMC inducendo riattivazione
virale
Fattore di inizio o di progressione?
L’espressione dei geni di latenza di HHV-8 predomina nelle lesioni KS, e i geni
di latenza (v-cyclin, vFLIP, LANA etc.) potrebbero avere un ruolo nella
progressione del KS a vero tumore
Reviewed in:
Stürzl et al., Adv. Cancer Res., 2001
Ensoli et al., Adv. Cancer Res., 2001
Sarcoma di Kaposi
Ensoli et al.
Individui a rischio di KS (HHV-8+, immunodisregolati)
Citochine infiammatorie
(Th-1: -IFN, IL-1, TNF)
HHV-8: riattivazione,
Aumento virus sangue e tessuti
Attivazione delle cellule
endoteliali e formazione
cellula fusata del KS
Induzione dei progenitori delle
cellule fusate (HHV-8 infettate)
Adesione delle cellule infettate da
HHV-8 ai vasi e passaggio nei
tessuti
Produzione di fattori
Inizio KS (lesioni angiogeniche angiogenici (bFGF-VEGF)
infiammatorie)
Infezione latente di HHV-8 nella
cellula KS (v-cyclin, v-FLIP,
Kaposine, LANA)
Ensoli et al.
Progressione KS
(tumore)
Sinergia con la proteina
Tat di HIV-1
Diagnosi di laboratorio di HHV-8
• Ricerca di anticorpi con metodologie ELISA o
immunofluorescenza (LANA, K8.1)
• Ricerca del genoma virale mediante PCR
• Studio dei trascritti per valutare lo stato di replicazione
Herpes B (herpesvirus cercopitechino 1)
• Virus erpetico della scimmia
• Può essere un patogeno per persone che maneggiano
scimmie (trasmissione tramite il morso) o per
laboratoristi che utilizzano tessuti o cellule di scimmia
• Nell’uomo la malattia può essere letale (75% casi) o
dare gravi danni neurologici (mielite o encefalite) in chi
sopravvive
• Evidenza di trasmissione da uomo (infettato da scimmia)
ad altro uomo.
• Diagnosi mediante isolamento del virus e test sierologici
• Acyclovir e Ganciclovir raccomandati per terapia
(sensibile in vitro)