2.1
SPETTROFOTOMETRIA DI ASSORBIMENTO MOLECOLARE
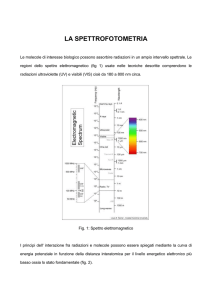
La spettrofotometria di assorbimento è una tecnica strumentale di indagine che fornisce
importanti informazioni sulla natura e su altri importanti parametri sia di composti
organici sia inorganici. Essa consiste nel far interagire una radiazione luminosa con la
materia in esame e nel misurare l’entità dell’assorbimento relativo ad una ben precisa
lunghezza d’onda oppure, a seconda degli scopi, a lunghezze d’onda comprese in una
zona di spettro delle onde elettromagnetiche più o meno ampia. In funzione della
lunghezza d’onda della luce utilizzata si parla di spettrofotometria UV-VIS (ultravioletta e
visibile ) e di spettrofotometria IR ( infrarossa ) (Fig. 1).
Lunghezza d’onda λ
100 nm
200 nm
380 nm
2,5 µm
Regione dello spettro
Eccitazione
Lontano
UV
Vicino
UV
Visibile
Transizioni elettroniche
0,1 cm
50 µm
780 nm
25 µm
V
i
c
Medio IR
i
n
o Transizioni vibrazionali
e rotazionali
IR
Lontano IR
Transizioni
rotazionali
Fig. 1
Come si può osservare dalla Fig. 1, la luce ultravioletta e visibile provoca eccitazioni di
elettroni di valenza mentre la luce infrarossa agisce sui moti vibrazionali e rotazionali
molecolari.
La spettrofotometria UV-VIS teoricamente potrebbe utilizzare radiazioni comprese tra 100
e 780 nm (nanometri); in realtà gli strumenti normalmente usati sono in grado di lavorare
tra 200 e 780 nm in quanto con valori inferiori di λ si avrebbe assorbimento da parte
dell’ossigeno dell’aria, per cui occorrerebbe operare sotto vuoto. La spettrofotometria IR
invece utilizza normalmente solo le radiazioni comprese in una zona del Medio IR, tra 2,5
µm (2500 nm) e 25µm (25000 nm) circa, però sono in fase di avanzato sviluppo anche le
tecniche di utilizzazione del vicino e del lontano IR.
2.1.1 SPETTROFOTOMETRIA ULTRAVIOLETTA E VISIBILE
L’assorbimento di radiazioni in questa zona dello spettro si verifica quando l’energia dei
fotoni è sufficiente a provocare transizioni elettroniche a livelli energetici superiori con
conseguente eccitazione della molecola. La richiesta energetica per tale fenomeno varia da
1
sostanza a sostanza e, in generale, solo i composti organici, ma non tutti, e alcuni
complessi di metalli di transizione e di lantanidi sono in grado di dar luogo a salti
elettronici con luce UV e VIS; altrimenti bisogna ricorrere ai raggi X e, ovviamente, la
strumentazione risulta essere diversa e comunque molto più sofisticata. Circa i salti
elettronici che possono verificarsi, le motivazioni teoriche sono leggermente diverse nei
composti organici rispetto ai complessi dei metalli di transizione.
2.1.1.1 COMPOSTI ORGANICI
Per comprendere ciò che può accadere quando una radiazione investe una sostanza, si
consideri la semplice molecola dell’idrogeno H2.
È noto che il legame H-H si forma in seguito alla sovrapposizione degli orbitali atomici s
dei due singoli atomi. Dalla teoria dell’orbitale molecolare risulta anche però che dalla
sovrapposizione di due orbitali atomici si formano due orbitali molecolari, uno detto
“legante” e l’altro “antilegante”; così al legame sigma tra i due atomi di H corrispondono
l’orbitale di legame σ (sigma) e l’orbitale di antilegame σ* (sigma asteriscato). Ciò accade
in quanto i due orbitali atomici s dell’H possono essere di fase concorde o discorde: se
hanno la stessa fase, nella zona di sovrapposizione si ha un rinforzo e quindi un aumento
della densità della “nuvola” elettronica a cui corrisponde una maggiore probabilità di
trovare la coppia di elettroni in comune.
+
+
+
H
+
H
+
σ
+
H2
Se invece i due orbitali hanno fase opposta, essi danno luogo a interferenza
elettromagnetica con diminuzione di densità di nuvola elettronica e in quindi risulta essere
bassa la probabilità degli elettroni di trovarsi tra i due atomi e quindi “legarli”.
Piano
nodale
+
+
+
+
+
σ*
In sostanza tra i due atomi si ha un cosiddetto “piano nodale”, cioè una zona di spazio
povera di nuvola elettronica per cui i due nuclei + non sono più schermati nella loro forza
repulsiva e, pertanto, il contenuto energetico della struttura aumenta. Si sono così formati
l’orbitale di legame e l’orbitale di antilegame. Siccome in ogni orbitale possono stazionare
2
al massimo 2 elettroni, è ovvio che gli elettroni dei due atomi di H andranno a posizionarsi
nell’orbitale a più bassa energia, cioè quello di
Energia
legame mentre quello di antilegame rimane
Orb. mol. σ*
vuoto. Il tutto è visualizzato nella fig. 2 da cui
H
si può appunto vedere che una molecola di H2
H
Orb.atom.
può esistere in due stati di energia elettronica.
Orb.atom.
Orb. mol. σ
Ovviamente tale molecola assumerà lo stato a
Fig. 2
più bassa energia e cioè quello in cui i due
elettroni che hanno dato luogo al legame sono posizionati sull’orbitale molecolare a più
bassa energia, pertanto il σ.
Se però una radiazione elettromagnetica di
Energia
Orb. mol. σ*
opportuna lunghezza d’onda λ, tale che la sua
energia hν
ν sia uguale alla differenza di energia
H
H
Orb.atom.
esistente tra σ e σ*, investe la molecola, essa sarà
assorbita e un elettrone sarà promosso al livello
Orb.atom.
Orb. mol. σ
Fig. 3
energetico superiore (Fig. 3).
Si dice che è avvenuta una transizione elettronica σ →σ* e la molecola si troverà in uno
stato eccitato. In tempi brevissimi, frazioni di secondo, l’elettrone tornerà allo stato di
partenza (stato fondamentale). Strumenti denominati spettrofotometri sono in grado di
rilevare il valore della lunghezza d’onda o della frequenza della luce assorbita e
l’entità dell’assorbimento, quindi da questi parametri si possono poi avere importanti
informazioni analitiche sulla sostanza studiata. A questo punto è necessario fare una
importante considerazione: in realtà per il
legame che stiamo considerando sono possibili
numerosissime
transizioni
elettroniche,
ν2
E
σ*
di
lunghezze d’onda vicinissime tra di loro,
disposte in una zona di alcune decine di
ν0
Fig. 4
nanometri; in pratica si ha una banda di
assorbimento.
La
spiegazione
di
questo
fenomeno risiede nel fatto che il contenuto
energetico
sia
dell’orbitale
legante
che
ν1
ν2
σ
ν1
ν0
antilegante può assumere più valori in quanto a ciascuno di essi corrispondono diversi
3
livelli vibrazionali, ν0 ν1 ν2 (vedi IR), e tra questi ultimi vi sono poi vari livelli rotazionali.
Dalla fig. 4 si vede chiaramente che sono possibili diversi salti elettronici di energia
abbastanza vicina. Dal punto di vista pratico, dopo aver misurato l’assorbanza alle varie
lunghezze d’onda si può costruire un diagramma riportando sull’asse delle ascisse la
lunghezza d’onda e sull’asse delle ordinate l’assorbanza. Si ottiene così una curva che
prende il nome di spettro di assorbimento nell’ultravioletto dell’idrogeno. Si presenta
all’incirca nel seguente modo:
Dalla figura a fianco si può notare che la sostanza
assorbe diverse lunghezze d’onda ma con diversa A
intensità. Il valore di λ per cui si ha il massimo
Amax
valore di A prende il nome λmax mentre da Amax si
può ricavare εmax. Le due grandezze λmax e εmax sono
caratteristiche di ogni banda di assorbimento di una
λ
λmax
sostanza.
I comuni strumenti di laboratorio permettono di studiare transizioni elettroniche a richiesta
energetica, come già detto, inferiore ad un certo limite (λ
λ approssimativamente maggiore
di 200 nm a causa dell’interferenza dell’ossigeno dell’aria) ma comunque superiore ad un
valore minimo (λ
λ approssimativamente inferiore a 780 nm altrimenti l’energia della
radiazione sarebbe insufficiente per avere salti elettronici). La molecola di H2 , ad
esempio, non rientra in questo “range” in quanto richiede una lunghezza d’onda ben al di
sotto di 200 nm. Più in generale possiamo dire che le transizioni σ
σ* non interessano
la spettrofotometria UV-VIS.
La situazione migliora notevolmente se la sostanza in esame contiene almeno un legame
π
π. È il caso della molecola dell’etene C H 2 = C H 2
σ
Nella molecola è presente un doppio legame, costituito da un E
σ*
legame σ e da un π. Da quanto detto precedentemente si evince
π*
che sia per il legame sigma che per il pi-greco, esiste un orbitale
“legante” e un “antilegante”. Dalla teoria inoltre si ottiene il
seguente diagramma dei livelli energetici elettronici:
π
σ
Si può facilmente osservare che la transizione elettronica a
minore richiesta energetica è la π→π*, sicuramente energeticamente più facile sia della
4
π →σ* che della σ→σ*. Anche tale transizione cade, anche se per poco, nel lontano UV
(λmax=165 nm).
Esistono però diversi composti organici per i quali certi gruppi presenti nella molecola
conferiscono loro la possibilità di assorbire radiazioni nella zona di pertinenza della
spettrofotometria ultravioletta e visibile. La parte strutturale responsabile di tale
comportamento si chiama cromoforo. Vedremo in seguito che sono cromofori gruppi
quali il carbonile, insaturazioni coniugate, sistemi aromatici ecc.
I composti più importanti, pertanto, che possiedono le caratteristiche per assorbire il tipo
di luce di cui ci si sta occupando sono:
- dieni e polieni coniugati
- composti carbonilici
- idrocarburi aromatici
- composti con legami multipli tra azoto-ossigeno e zolfo-ossigeno
- composti saturi con elettroni n (non leganti) su eteroatomi
• Dieni e polieni coniugati
Si tratta di composti organici con due o più doppi legami coniugati come l’1,3-butadiene,
l’1,3,5-esatriene ecc. Per composti di questo genere, trascurando i legami σ, nel
diagramma delle energie si hanno n orbitali molecolari (tra “leganti” e “antileganti”) di
tipo π, se n è il numero degli orbitali atomici p che ha dato luogo al sistema coniugato.
Per l’1,3,5-esatriene, ad esempio, si hanno tre orbitali molecolari “leganti”, π1
e tre “antileganti”, π4* π5*
π3,
π6*.
I 6 elettroni p si disporranno sui 3 orbitali “leganti”. In
questi composti l’orbitale molecolare a più alta energia
occupato prende il
π2
nome di orbitale HOMO (highest
occupied molecular orbital) mentre l’orbitale vuoto a più
bassa energia si chiama LUMO (lowest unoccupied
molecular orbital).
E
π6*
π5*
π4*
LUMO
π3
HOMO
π2
La transizione elettronica π3→π4* avviene in pratica tra
l’orbitale HOMO e LUMO, i quali per questo sono anche
detti orbitali di frontiera. A questa transizione
5
π1
corrisponde una banda di assorbimento con λmax=258 nm e con εmax=35000. Si tratta
quindi di una banda che cade pienamente al di sopra dei 200 nm e facilmente
individuabile in quanto, come si può osservare dal valore di εmax, è anche molto intensa
(alta).
Aumentando il numero di doppi legami coniugati, gli orbitali di frontiera vengono a
trovarsi energeticamente sempre più vicini, cioè il λmax aumenta e quando il suo valore
supera i 380 nm il composto ci appare colorato. È il caso del β-carotene, contenuto in
genere nei vegetali di colore arancio come le carote e i pomodori, il quale con i suoi 11
doppi legami coniugati presenta un massimo di assorbimento a 497 nm. Ciò vuol dire che
assorbe luce di colore blu per cui la frazione di luce bianca non assorbita, venendo ad
essere indebolita di questa parte di cromatica, ci appare di colore arancione.
Un comportamento simile ai politeni coniugati evidenziano anche gli alchini coniugati.
Le bande di assorbimento dovute a questi sistemi si chiamano bande K (Konjugierte ) e
sono caratterizzate da valori di εmax>10000
• Composti carbonilici
Un altro importante cromoforo nei composti organici è il gruppo
carbonilico C=O. In questo caso occorre tener presente che
E
σ*
π*
l’atomo di ossigeno coinvolto nel doppio legame possiede due
n
doppietti elettronici non impegnati che contribuiscono al
π
contenuto energetico della molecola. Il diagramma dei livelli
energetici è costituito pertanto dai soliti orbitali “leganti” e
σ
“antileganti” σ e π più due orbitali atomici n non “leganti” e si presenta come nella figura
a destra. Teoricamente sono possibili quattro tipi di transizioni però solamente la n→
→π*,
comunemente chiamata radicalica, richiede una lunghezza d’onda superiore ai 200 nm;
per l’acetone, ad esempio, a tale transizione, corrisponde una banda con λmax=279 nm ma
con εmax=13; si ha cioè un massimo di assorbimento piccolissimo rispetto ai polieni.
Questo valore molto basso dell’assorbività molare è da attribuire al fatto che tale
transizione è vietata dalle cosiddette regole di selezione. Circa il significato di queste
6
regole occorre dire che la meccanica quantistica ha fissato due importanti criteri per
stabilire se può verificarsi una transizione elettronica, e precisamente:
- Il contenuto energetico dell’onda elettromagnetica deve essere uguale al salto
energetico che l’elettrone deve effettuare.
- A tale salto elettronico deve necessariamente corrispondere una variazione di momento
elettrico complessivo della molecola. Le regole di selezione quanto-meccaniche
riassumono appunto le condizioni che devono essere soddisfatte perché l’eccitazione
produca una variazione di momento elettrico e l’eccitazione possa avvenire.
Che poi che tali transizioni “non consentite”, come è il caso del carbonile C=O, diventano
parzialmente permesse è da attribuire al fatto che le suddette regole, basate su
considerazioni di simmetria del sistema allo stato fondamentale e allo stato eccitato, sono
in realtà meno vincolanti in quanto la loro validità è massima per sistemi molto semplici.
All’aumentare della complessità molecolare infatti le restrizioni risultano meno valide in
quanto le perturbazioni intra e intermolecolari determinano piccole variazioni di momento
elettrico durante la transizione che può così verificarsi.
Le bande dovute ai sistemi carbonilici si chiamano bande R (Radikalartig).
Quando il gruppo carbonilico è coniugato con doppi legami etilenici, cioè nei sistemi
enonici, oltre alla banda R, lo spettro evidenzia anche l’intensa banda K tipica dei sistemi
coniugati. Un comportamento analogo si ha quando i doppi legami etilenici sono coniugati
con doppi legami carbonio-azoto C=N, come nelle ossime e negli idrazoni, o con tripli
legami C≡N dei nitrili.
• Idrocarburi aromatici
Le bande dovute a questi sistemi si chiamano bande B (bande benzenoidi) e si tratta di
transizioni non permesse. Il benzene evidenzia una banda con picchi multipli, cinque, tra
230 e 270 nm e il picco più intenso ha εmax=230; la struttura fine di tale banda è
caratteristica e ne agevola il riconoscimento. Questo composto presenta inoltre due bande
etileniche (bande E) molto intense ma localizzate ai confini tra vicino e lontano
ultravioletto. Se la coniugazione si estende al di fuori dell’anello, come nello stirene o
benzaldeide o nitrobenzene ecc., oltre alla banda B, lo spettro evidenzia la tipica banda K
dei sistemi coniugati con valori di λmax nel vicino UV. Qualche esempio:
COMPOSTO
BANDA K
BANDA B
7
BANDA R
λmax εmax
λmax εmax
λmax εmax
Benzene
....
255 215
....
Stirene
244 12000
.....
.....
282 450
Benzaldeide 244 15000
280 1500
328 20
Nitrobenzene 252 10000
280 1000
330 125
• Composti con legami multipli azoto-ossigeno e zolfo-ossigeno
I composti con legami doppi N=O come i nitrocomposti, i nitroso composti, i nitrati e i
nitriti presentano un debole assorbimento di tipo R, dovuto alla transizione n→
→π*, nella
zona del vicino ultravioletto. Se il gruppo N=O è coniugato con altri legami multipli, si ha
una intensa banda K che spesso copre quella R. In modo abbastanza simile si comportano
i composti con legami multipli S=O come i solfoni e i solfossidi.
• Composti saturi con elettroni n (non leganti) su eteroatomi
Appartengono a questa categoria composti quali alcoli, tioli, solfuri, ammine e alogenuri
alchilici. Essi sono caratterizzati dal fatto di avere solo legami σ e coppie di elettroni su
eteroaromi, pertanto la transizione che richiede meno energia è la n→
→σ* ed è
caratterizzata da bassi valori di assorbività molare (transizione vietata). La maggior parte
di tali composti però presenta dei λmax di poco al di sotto dei 200 nm, ma ciò non è poi
uno svantaggio in quanto, proprio per questo motivo, possono essere così adoperati come
solventi in misure spettrofotometriche UV-VIS. Tra quelli invece che danno bande sopra i
200 nm alcuni importanti sono lo ioduro di metile, il bromuro di propile, l’1-esantiolo.
PARAMETRI CHE CONDIZIONANO IL VALORE DI λmax e di εmax
I valori di λmax e di εmax della banda relativa ad un dato cromoforo non sono costanti ma
dipendono dalla struttura chimica nelle immediate vicinanze e dall’ambiente (in genere il
solvente). Le possibili variazioni di tali grandezze vengono normalmente espresse con un
linguaggio specifico e precisamente si parla di:
- Effetto batocromo o shift rosso o red shift. Si ha quando il massimo di assorbimento si
sposta verso valori più elevati di lunghezza d’onda (rosso). Ad esempio l’1,3-butadiene
8
evidenzia uno shift batocromo se ad esso vengono legati due gruppi metilici in modo
da convertirlo in 2,3-dimetil-1,3-butadiene
- Effetto ipsocromo o shift blu. È dovuto ad un sostituente, denominato ipsocromo, che
provoca lo spostamento della banda verso valori di λmax inferiori.
- Effetto auxocromo. Si definiscono auxocromi quei gruppi saturi che determinano
variazioni sia di λmax sia di εmax dei cromofori a cui sono legati. Sono auxocromi i
gruppi -OH, -NH2, -Cl ecc.
- Effetto solvente. Variazioni della polarità del solvente possono contribuire
diversamente alla stabilità della molecola del cromoforo allo stato fondamentale e allo
stato eccitato; di conseguenza si possono avere aumenti o diminuzioni delle energie, e
quindi delle λ, necessarie alla promozione elettronica. Il solvente può in sostanza
indurre shift rossi o blu. É il caso delle bande R come nei carbonili e nei nitro gruppi:
esse sono caratterizzate da shift blu in caso di aumento di polarità del solvente.
- Effetto ipercromo. Si ha un effetto ipercromo quando si osserva un aumento
dell’intensità (εmax) della banda di assorbimento. Ad esempio mentre le bande K dei
dieni e polieni sono sostanzialmente insensibili alla polarità del solvente, le bande K
degli enoni subiscono uno shift batocromo con effetto ipercromo se la polarità del
solvente aumenta.
- Effetto ipocromo. Indica una diminuzione di intensità di assorbimento.
2.1.1.2
COMPLESSI DI METALLI DI TRANSIZIONE E DI LANTANIDI
L’assorbimento di luce UV-VIS da parte di tali composti è determinata non solo dalla
natura del legante, secondo quanto già visto per i composti organici, ma anche da altri due
tipi di interazioni: l’assorbimento d→d o f→f e l’assorbimento per trasferimento di
carica.
• Assorbimento da transizioni d→
→d o f→
→f
I metalli di transizione e i lantanidi possiedono rispettivamente 5 e 7 orbitali isoenergetici
parzialmente occupati. Questa situazione di uguaglianza energetica è vera solo per
molecole di geometria strutturale complessivamente simmetrica in quanto sono proprio le
condizioni di massima simmetria a determinare la formazione di livelli degeneri. La
presenza del legante in genere determina un campo perturbativo con conseguente
9
rimozione della degenerazione degli orbitali d del metallo di transizione (f nei lantanidi).
I 5 orbitali d vengono così ad avere energia diversa, anche se di poco, per cui è possibile
osservare transizioni elettroniche in questo ambito. Dato che i dislivelli energetici sono
piccoli, le energie richieste per le transizioni sono anch’esse piccole e quindi ottenibili con
luce ad elevata lunghezza d’onda, tra visibile e confine con il vicino IR. É questo il
motivo per cui tali specie chimiche sono normalmente colorate (es. [Ti(H2O)6]3- ). Infine
va comunque detto che si tratta di bande deboli in quanto dovute a transizioni “non
consentite”.
• Assorbimento da trasferimento di carica
I complessi di metalli di transizione e di lantanidi possono presentare uno spettro di
assorbimento costituito oltre che dalle deboli bande dovute alla scomparsa di
degenerazione degli orbitali d e f, anche delle ulteriori bande
dovute al cosiddetto
trasferimento di carica. In pratica, per azione di una radiazione luminosa, un elettrone
viene eccitato da un orbitale del metallo ad un orbitale del legante o viceversa. Tali bande
appaiono più spesso nel l’ultravioletto che nel visibile, comunque sono molto intense in
quanto dovute a transizioni elettroniche che comportano una notevole variazione del
momento dipolare della molecola o dello ione. É questo il motivo per cui se il λmax cade
nel visibile si ha a che fare con composti intensamente colorati ; è il caso degli ioni
CrO42- (λmax=372 nm) e MnO4- (λmax=525 nm ), per i quali si verificano transizioni di
elettroni non leganti dall’ossigeno a orbitali d del metallo di transizione. Va infine detto
che l’energia richiesta per tali transizioni è funzione anche dell’energia di ionizzazione
della specie chimica che perde l’elettrone e dell’affinità elettronica di chi riceve
l’elettrone. Chiaramente a bassi valori dell’energia di ionizzazione corrisponde una
relativamente bassa energia di transizione elettronica.
2.1.1.3
STRUMENTAZIONE
Gli strumenti normalmente adoperati per misurare l’intensità dell’assorbimento di una
radiazione possono essere di due tipi: colorimetri e spettrofotometri veri e propri. I
primi sono dispositivi molto semplici e pertanto vengono adoperati sono in quelle
situazioni in cui non è richiesta una eccessiva precisione ( certe analisi di routine).
10
2.1.1.3.1
COLORIMETRI
La colorimetria ha come principio di base, la misura dell’assorbimento della luce da parte
di specie chimiche colorate di per sé o rese tali dopo reazione con un reattivo
(cromogeno). Va da sé che i colorimetri lavorano solo nel visibile sfruttando la legge di
Lambert-Beer : A = a ⋅ b ⋅ c
quantitativa
in
Questa legge è rigorosamente rispettata (vedi “analisi
spettrofotometria
UV-VIS”)
solo
in
presenza
di
radiazioni
monocromatiche. Nei colorimetri si fa invece uso o di luce bianca (policromatica) o di
zone spettrali più ristrette ottenute mediante filtri ottici. In entrambi i casi non è verificata
la suddetta condizione necessaria per il rispetto della legge di Lambert-Beer
(monocromaticità delle radiazioni) e quindi le misure colorimetriche risultano meno
accurate, anche se hanno il vantaggio della praticità e della rapidità.
I colorimetri possono suddividersi in :
• Colorimetri visuali o comparatori ottici
• Colorimetri fotoelettrici o fotocolorimetri
a) Colorimetri visuali o comparatori ottici
Sono dispositivi semplici in cui lo “strumento” di misura e di confronto delle intensità di
colore, è l’occhio umano e la sorgente è la luce solare o al luce bianca di una lampada
(quindi luce policromatica). Possono essere di tipo diverso ma tutti riconducibili allo
stesso principio: in essi si confronta la luce trasmessa dalla soluzione in esame con quella
trasmessa da una o da più soluzioni standard a concentrazione nota facendo in modo che si
uguagliano. L’uguaglianza delle intensità di colore (uguaglianza delle assorbanze) si può
realizzare in due modi:
• usando una sola soluzione standard e facendo variare lo spessore b di soluzione
attraversata dalla luce
• usando più soluzioni standard, a concentrazioni diverse e confrontandole con quella in
esame, utilizzando sempre lo stesso spessore b di soluzione
Il primo principio è sfruttato nei colorimetri visuali tipo Dubosq in cui la soluzione in
esame X e quella a concentrazione nota ST vengono osservate attraverso un oculare diviso
in due semicampi. Se le intensità di colore sono diverse (cioè A x ≠ A ST ) si fanno variare
con un dispositivo meccanico gli spessori di soluzione attraversata dalla luce, di una o di
entrambe le soluzioni finché i due semicampi non presentano la stessa intensità di colore
11
( A x = A ST ). Poiché A x = a ⋅ b x ⋅ c x
A ST = a ⋅ b ST ⋅ c ST (il valore di a è lo stesso
e
perché si tratta della stessa specie chimica irradiata con la stessa luce) si avrà:
c x ⋅ b x = c ST ⋅ b ⋅ST
da cui
c x = c ST
b ST
bx
Il secondo principio si usa, ad esempio, nei tubi di Nessler (tubi di vetro tutti uguali, a
fondo piatto) riempiti di soluzioni standard a concentrazioni diverse C1, C2, C3.....Cn della
stessa specie chimica, fino ad una tacca di riferimento (stessi volumi = stessi spessori). Si
confrontano quindi, osservandoli sotto lo stesso spessore, con un tubo di Nessler
contenente la soluzione in esame. Ad uguale intensità di colore ( A x = A ST ) e spessori
uguali ( b x = b ST ) dovrà per forza essere Cx=CST(nota). I due sistemi descritti hanno però
attualmente solo un interesse storico. Tuttavia sono ancora oggi molto usati, per controlli
rapidi anche se approssimativi (controlli di processi di potabilizzazione acque, pH
colorimetrico, cloro residuo in acqua di piscina ecc.), i cosiddetti comparatori visuali a
filtri, montati su dischi. In essi si riempiono due cuvette (stesso spessore) : in una si mette
il campione tal quale, nell’altra il campione addizionato di un reattivo omogeneo che fa
sviluppare un colore. Davanti alla prima cuvetta si fa poi ruotare un disco contenente una
serie di filtri ottici (in vetro colorato o resina colorata) aventi lo steso colore ma a intensità
diverse : ognuno di questi filtri “simula” una soluzione di quel cromoforo corrispondente
ad una determinata concentrazione della specie in esame. Facendo ruotare il disco e
illuminando le soluzioni con la luce solare o luce bianca di una lampada, si troverà uno dei
filtri che rende uguali le intensità di colore nelle due cuvette. Si legge quindi direttamente
in una finestra, il valore della concentrazione incognita cercata. Nelle figura che segue si
riporta uno schema di un comparatore visuale a filtri.
2
1
3
3
1- Cuvetta contenente il campione t.q.
2- Cuvetta con il campione più reattivo cromogeno
3- Disco con filtri ottici colorati
b) Colorimetri fotoelettrici o fotocolorimetri
12
In essi, la luce bianca policromatica proveniente da una lampada a filamento di tungsteno
viene monocromata facendola passare attraverso un filtro ottico o, nei modelli più costosi,
un filtro interferenziale. Dopo aver attraversato la soluzione in esame, l’intensità della
radiazione uscente viene misurata mediante una fotocellula (di solito una cella a strato di
sbarramento). Schematicamente un fotocolorimetro può essere rappresentato come nella
seguente figura :
S - Sorgente luminosa
OT
SP
SP - Specchio collimatore
FE1
FE1 e FE2 - Fenditure di entrata e di uscita
FE2
M
S
M - Monocromatore (filtro ottico o interferenziale)
C - Cuvetta con il campione
G
C
OT - Otturatore
FC
FC - Cella fotoelettrica (a strato di sbarramento)
Per effettuare le misure, si procede così :
• si azzera lo strumento ad otturatore chiuso (T%=0)
• si mette il “bianco” nella cella portacampione e si impone la condizione
A=0 (T%=100)
• si sostituisce rapidamente la cuvetta del “bianco” con il campione in esame e si legge il
valore di assorbanza su un display digitale
Per risalire alle concentrazioni incognite si applica uno dei metodi dell’analisi quantitativa
in assorbimento (Vedi “analisi quantitativa in spettrofotometria UV-VIS”).
Rispetto agli spettrofotometri UV-VIS, i fotocolorimetri presentano le seguenti differenze
sostanziali :
• lavorano solo nel VIS
• non possono variare (tranne che in modelli più costosi che sono, in sostanza, degli
spettrofotometri che lavorano solo nel VIS, anche a minore classe di precisione ed
accuratezza) la λ con continuità, avendo dei filtri come monocromatori
• la luce utilizzata per le misure non è a banda molto stretta
• possono essere utilizzati per analisi quantitativa ma non qualitativa (non si possono
infatti costruire curve di assorbimento per la forte discontinuità delle λ ottenibili).
13
2.1.1.3.2
SPETTROFOTOMETRI
Gli spettrofotometri sono sofisticati strumenti costituiti essenzialmente da quattro parti ,
che possono così essere rappresentati mediante un diagramma a blocchi:
Sorgente
Monocromator
Portacampioni
e
Rivelatore
La sorgente luminosa emette luce policromatica; il monocromatore fornisce luce
monocromatica la quale investe il campione, viene parzialmente assorbita e quindi va al
rivelatore che dal confronto tra l’intensità della radiazione risultante con e senza campione
è in grado di fornire il valore dell’assorbanza o della trasmittanza di ciò che è contenuto
nel portacampioni.
• Sorgente di energia radiante
Normalmente uno spettrofotometro dispone di due diverse sorgenti, una da utilizzare nella
regione UV e l’altra nel VIS. Le caratteristiche costruttive sono tali che il passaggio da un
tipo all’altro è automatico secondo il valore della lunghezza d’onda prescelta
dall’operatore. Nella zona UV si utilizzano le cosiddette lampade a deuterio o idrogeno
mentre nel “visibile” quelle a filamento di tungsteno (Wolframio). Le lampade a deuterio
sono costituite da un bulbo di quarzo, perché a differenza del vetro è trasparente nel vicino
UV, pieno di gas deuterio, il quale se eccitato da scariche elettriche emette uno spettro
continuo di onde elettromagnetiche comprese tra 190 e 400 nm. Le lampade a tungsteno,
invece, sono costituite da un bulbo di vetro contenente il filamento che in seguito a
passaggio di corrente si arroventa fino a circa 2800 °C emettendo così uno spettro
continuo tra circa 330 e 930 nm. L’intensità della luce emessa dipende notevolmente dalla
tensione V applicata, è funzione di V4, per cui è necessario far uso di buoni stabilizzatori
affinchè durante la misura non si abbiano variazioni sensibili di quantità di energia
emessa. Questo è uno dei motivi per cui, come vedremo in seguito, si preferisce far uso di
spettrofotometri a doppio raggio. Oggi, comunque, si ottengono migliori risultati
utilizzando lampade al Wolframio-alogeno (o quarzo-iodio) come sorgenti nel visibile.
Esse operano a temperatura più elevata di quelle a semplice filamento di tungsteno e
forniscono quindi luce di maggiore intensità. Il loro massimo di emissione si sposta,
sempre nel VIS, verso λ più basse. Risultano pertanto migliorate le intensità di luce
emessa nel “range” 300-400 nm anche perché il bulbo è di quarzo e non di vetro.
• Monocromatori (vedi “natura e caratteristiche della luce”
14
• Portacampioni o celle o cuvette
Ne esistono di tipi diversi in funzione dell’impiego e dello strumento:
-
Celle a sezione circolare di vetro ottico (tipo provetta) il cui diametro può variare da 1
a 5 cm. Sono in genere adoperate quando non è richiesta un’elevata precisione e
vanno bene solo per la regione del “visibile”.
-
Celle a sezione quadrata con spessore (cammino ottico) di 1 cm. A seconda delle
esigenze ne esistono in commercio anche di misure diverse, maggiore o minore del
valore usuale di 1 cm. Sono costruite con estrema precisione e sono ben chiare le
facce del parallelepipedo che devono essere attraversate dalla radiazione. Circa la
natura del materiale di cui sono costituite, sono di vetro quelle per la regione del
“visibile” e di quarzo quelle per l’ultravioletto. Ovviamente quelle di quarzo possono
essere utilizzate anche nel “visibile”. Per l’uso di routine esistono anche delle celle di
vetro monouso.
• Rivelatori
I sistemi di rivelazione hanno la funzione di convertire l’intensità della radiazione
luminosa in un proporzionale segnale elettrico, analogico o digitale. I più usati sono: le
celle fotovoltaiche, le celle fotoconduttive, i fototubi e i fotomoltiplicatori.
-
celle fotovoltaiche: i semiconduttori, in questo caso il selenio, sono caratterizzati dal
fatto che se investiti da luce di sufficiente energia
possono subire eccitazione elettronica a orbitali che si
trovano nella cosiddetta banda di conduzione. Da
questo movimento elettronico consegue un passaggio
luce
-
G
Selenio
+
di corrente elettrica la cui intensità è evidenziata da un galvanometro e il suo valore
risulta essere proporzionale al numero di fotoni (intensità della luce) che l’hanno
generata. Sono rivelatori poco sensibili e vengono utilizzati solo con luce “visibile”,
quindi nei colorimetri, dove le bande passanti sono piuttosto ampie e perciò ricche di
fotoni. Infine tendono facilmente all’affaticamento cioè la sensibilità diminuisce con
l’uso prolungato.
-
celle fotoconduttive: sono complessivamente simili alle precedenti solo che il
semiconduttore fotosensibile è inserito in un circuito elettrico e quindi con una d.d.p.
alle sue estremità (circa 80 V). Quando questo è investito da luce gli elettroni passano
15
nella banda di conduzione e, a causa della d.d.p. preesistente, danno luogo ad una
corrente elettrica. Tali rivelatori hanno gli stessi limiti delle celle fotovoltaiche.
-
Fototubi: si basano sul cosiddetto effetto fotoelettrico, cioè emissione di elettroni,
che si ha quando certi metalli a bassa energia di ionizzazione vengono investiti da
luce di sufficiente energia. Questi rivelatori sono costituiti da un’ampolla di quarzo
sotto vuoto contenente all’interno un anodo e un catodo di materiale fotosensibile,
cioè in grado di dare l’effetto fotoelettrico, sottoposti ad una certa d.d.p. Quando un
fascio luminoso investe il catodo fotosensibile vengono espulsi elettroni i quali
vengono attratti dall’anodo e producono così una corrente elettrica. Anch’essi vanno
soggetti ad affaticamento e non sono nemmeno molto sensibili, anche se più dei
precedenti, però sono in grado di valutare intensità in qualsiasi zona del visibile e
dell’ultravioletto.
-
fotomoltiplicatori: questi dispositivi sono un’evoluzione dei fototubi. Sono costituiti
da un’ampolla di quarzo, sotto vuoto, contenente una serie di catodi e anodi collegati
ad una sorgente di d.d.p. esterna. Tra ciascuna coppia di catodo e anodo vi è una d.d.p
costante di circa 100 Volt. Il principio di funzionamento è il seguente: la luce
incidente investe il primo fotocatodo, un elettrone viene emesso e accelerato dalla
d.d.p. di 100 V, investe il secondo fotocatodo e provoca l’emissione di 4 elettroni (in
genere) i quali poi,
anch’essi accelerati,
vanno
sul
fotocatodo
terzo
da
cui
partono 16 elettroni
64 e
1e
16 e
(luce)
4e
ANODO
FOTOCATODO
+
-
ecc. In questo modo da un solo elettrone ne possono arrivare all’estremità anodica
fino a ben 109. É evidente che in questo modo un fascio di luce di bassissima
sensibilità può dar luogo ad un’apprezzabile corrente elettrica.
Sono i rivelatori più usati nei moderni spettrofotometri in quanto “coprono”
egregiamente tutto il campo spettrale relativo al vicino ultravioletto e al “visibile”;
sono inoltre sensibilissimi per cui anche deboli radiazioni sono in grado di generare
segnali elettrici misurabili. Si possono, infine, deteriorare se troppo esposti alla luce
ambiente e, ovviamente, sono molto costosi. Tutti i rivelatori presi in considerazione
sono poi in grado di esprimere il segnale elettrico in termini di assorbanza o
16
trasmittanza. I valori di queste due grandezze possono inoltre essere visualizzati
mediante un sistema ad ago (analogico), mediante led (digitale) o trascritti, mediante
opportuni sistemi, su carta.
Per quanto riguarda infine i materiali da costruzione di uno spettrofotometro occorre tener
presente che se un dato componente è attraversato dalla radiazione che si sta utilizzando,
deve necessariamente essere trasparente nel campo spettrale in studio. Sotto questo aspetto
il vetro non va bene in quanto assorbe nell’UV mentre è ottimo il quarzo in quanto esso è
molto trasparente da 200 nm fino all’inizio dell’infrarosso. Sono fatti di quarzo, oltre alle
cuvette per UV, anche i prismi, le lenti e l’involucro dei sistemi di rivelazione
Come si misura l’assorbanza.
Normalmente quando si effettua una misura spettrofotometrica interessa l’assorbanza
dovuta al soluto, però inevitabilmente anche il solvente e le cuvette trattengono una certa
quantità di energia luminosa. Per tener conto di questo fattore occorre effettuare il
cosiddetto azzeramento dello strumento: tale operazione consiste nel far segnare A=0 allo
strumento quando nella cuvetta c’è solamente il solvente quindi si passa a leggere
l’assorbanza della soluzione, che poi in realtà è quella del solo soluto. Chiaramente la
misurazione effettuata è veritiera se tra una misura e l’altra lo strumento e il campione non
hanno subìto alcuna variazione: temperatura, intensità della sorgente, tensione di rete,
responso dei rivelatori, ecc. Proprio per l’esistenza di questi problemi, esistono due grandi
categorie di spettrofotometri: strumenti monoraggio e strumenti a doppio raggio (nel
“tempo” e nello “spazio”)
• strumenti monoraggio
Gli spettrofotometri monoraggio sono caratterizzati dal fatto che le caratteristiche
costruttive sono tali che si dispone di un unico fascio di radiazione luminosa che
attraversa prima il solvente e poi, dopo un tempo relativamente non brevissimo, la
soluzione . Lo schema di un generico strumento monoraggio è il seguente:
17
M
T
F
C
S
R
La luce emessa dalla sorgente S attraversa la fenditura, viene riflessa dallo specchi T
verso il monocromatore M. Dal monocromatore riparte luce monocromatica verso lo
specchio quindi, attraverso la fenditura F, investe il campione C dove perde parte
dell’energia dopo di che va al rivelatore R . Per effettuare la misura occorre procedere nei
seguenti modi:
a) misure di assorbanza ( o T%)
1. Fissare la lunghezza d’onda desiderata.
2. Azzerare meccanicamente lo strumento: far segnare, mediante opportune
manopole, T%=0 quando i rivelatori non ricevono luce (otturatore chiuso).
3. Inserire nel portacampioni il riferimento o bianco (il solvente in genere ma anche
una soluzione avente la stessa, o abbastanza simile, composizione del campione ,
escluso il soluto da dosare) e far segnare T%=100 o A=0
4. Inserire il campione di soluzione e leggere l’assorbanza A. Il valore letto
corrisponde all’assorbimento dovuto al solo soluto
b) misure in unità di concentrazione (per strumenti forniti di display a lettura digitale)
1. Fissare la lunghezza d’onda desiderata
2. Azzerare lo strumento (T%=0 ; A=∞) ad otturatore chiuso
3. Inserire la cuvetta con il “bianco” ed imporre le condizioni T%=100 e A=0
4. Commutare il sistema di lettura da A o T a CONC.
5. Inserire in lettura una cuvetta contenente una soluzione standard a concentrazione
nota della specie in esame
6. Impostare mediante apposito comando (manopola o tastierino numerico) il valore
(noto) della concentrazione della soluzione standard ( mg/l o altre unità di misura)
7. Sostituire la cuvetta dello standard con quella del campione in esame
8. Leggere infine sul display direttamente il valore incognito della concentrazione del
campione, nell’unità di misura desiderata
18
Un ruolo importante gioca, nelle operazioni di misura, la fenditura. Ad una sua minore
larghezza corrisponde sicuramente una banda passante più stretta, a vantaggio della
risoluzione dello spettro. C’è però da considerare che se la fenditura è troppa stretta può
arrivare una quantità insufficiente di energia luminosa ai rivelatori; quindi l’operatore
deve valutare attentamente i vari fattori affinché la misura possa essere soddisfacente.
• strumenti a doppio raggio
Uno degli inconvenienti più gravi degli strumenti monoraggio sta nel fatto che dovendo
confrontare continuamente l’assorbimento della soluzione con quello del bianco, mediante
un unico raggio luminoso disponibile,
alternativamente le due celle devono essere
cambiate di posizione e ciò ovviamente richiede un certo tempo, qualche secondo, che se
pur piccolo è sufficiente perché lo strumento possa dare una risposta diversa per una
identica sostanza assorbente. Gli strumenti a doppio raggio invece sono caratterizzati dal
fatto che il raggio luminoso ad un certo punto incontra un dispositivo (chopper), che è uno
specchio a settori, rotante a circa 50 cocli/sec, il quale fa sì che tale raggio
alternativamente, a distanza di frazioni di secondo, passi oltre il chopper oppure venga
riflesso in modo tale da dar luogo a due raggi i quali investono così uno il “riferimento” e
l’altro la soluzione, sequenzialmente nel tempo. Lo strumento quindi con i suoi
automatismi confronta quasi istantaneamente le intensità dei relativi assorbimenti dando
così una risposta praticamente indipendente da eventuali mutamenti dei vari dispositivi
fotosensibili. Lo schema è il seguente :
M
T
S1
S2
B
F
S
Chopper
R
C
S3
dove S1, S2 e S3 sono specchi piani, B è il riferimento (solvente in genere) e C la
soluzione.
Oltre che uno “sdoppiamento” nel “tempo” del raggio monocromatico che
alternativamente attraversa il “bianco” di riferimento o la cuvetta con il campione, si può
avere anche un vero e proprio sdoppiamento del raggio monocromatico in due raggi di
19
uguale intensità (doppio raggio nello “spazio”) che attraversano contemporaneamente la
cuvetta con il bianco e quella con il campione. Risulta ovvio che, al contrario dell’altro
sistema, è necessario che l’apparecchio abbia due rivelatori che misurano rispettivamente
le intensità del raggio di riferimento (Io) e del raggio che ha attraversato il campione (I) ;
un circuito elettronico di tipo logaritmico provvede poi a calcolare il rapporto tra le
correnti corrispondenti alle intensità Io e I e a farne il logaritmo. Il segnale così risultante,
convertito da analogico in digitale, appare su un display. Uno schema di principio di uno
spettrofotometro a doppio raggio nello “spazio” è il seguente :
LD = Lampada al deuterio
Lw = Lampada al quarzo-iodio (o Wolframio-alogeni)
R
S1, S2, S3, S4 = Specchi piani e toroidali
LD
F1
S1
R = Reticolo a riflessione concavo a “gradinata”
HM = Specchio speciale, HALF-MIRROR, che sdoppia il
raggio
monocromatico
(50%
LW
F2
F1, F2 = Fenditure di entrata e di uscita
riflesso
e
50%
C1
S2
FD1
HM
trasmesso)
S4
C1= Cella di riferimento (“bianco”)
C2 = Cella campione in esame
S3
FD1, FD2 = Rivelatori (n.2) : fotodiodi al silicio
FD2
C2
Il sistema di sdoppiamento del raggio nello spazio era stato abbandonato anni fa
nell’architettura degli spettrofotometri perché risultava complicato lo sdoppiamento del
raggio con sistema a specchi ; si era così sostituito con il sistema a “chopper”. Oggi
invece, con la realizzazione di specchi speciali in grado di riflettere un raggio di luce per il
50% e di trasmetterlo per il restante 50% (HALF-MIRROR), si ottengono, da un raggio
monocromatico, due raggi di intensità pressoché uguale. A questo punto si uniscono i
nuovi rivelatori a fotodiodi al silicio, che danno una risposta immediata e consentono
velocità di scansione elevatissime. I vantaggi presentati dal sistema a doppio raggio nello
“spazio” rispetto a quello a doppio raggio nel tempo sono essenzialmente quelli di minori
rischi di rotture e di necessità di manutenzione in quanto hanno meno organi in
movimento (chopper).
2.1.1.4
APPLICAZIONI
20
• analisi qualitativa
La spettrofotometria ultravioletta e visibile è di notevole interesse per la risoluzione di
problemi strutturali sia in chimica organica che inorganica. È possibile infatti costruire le
curve (o spettro) di assorbimento da 200 a 780 nm, oppure in una zona meno ampia di
lunghezze d’onda, da cui si possono avere importanti informazioni sulla molecola in
esame. Questo tipo di applicazione consiste nel misurare l’assorbanza di un dato
composto in soluzione, eventualmente anche in fase di vapore, a diverse lunghezze d’onda
e riportare i relativi valori su un piano cartesiano, ottenendo così un curva di questo
genere :
È evidente che un lavoro del genere è notevolmente scomodo da effettuare con uno
strumento monoraggio in quanto, anche decidendo di leggere i valori di A per valori di λ
abbastanza distanziati, dovendo azzerare per ogni misura, inevitabilmente si impiega
molto tempo. Con uno spettrofotometro a doppio raggio invece tutto è più semplice e più
preciso, e per due motivi :
-
Il confronto dell’entità dell’assorbimento tra riferimento e campione è immediato e
quindi, se le cuvette hanno rigorosamente lo stesso spessore, molti errori vengono
eliminati.
-
L’esecuzione delle misure entro un certo intervallo è semplificata per diversi motivi :
lo strumento è in grado di inviare sul campione luce a lunghezza d’onda variabile, in
modo automatico, con velocità di scansione prefissata e scelta dall’operatore, mentre
un sistema di registrazione (di tipo XY) funziona in perfetta sincronia con i segnali in
arrivo dal rivelatore e disegna lo spettro su un foglio di carta millimetrata (rullo che
si muove sincronicamente al sistema di avanzamento delle λ o scansione) su cui
striscia un pennino. La velocità di scansione può variare all’incirca da 1 a 2400
21
nm/min e il valore da impostare dipende dal tipo di spettro, dalla sua complessità,
dalla zona più o meno ampia da esplorare e, infine, dalla velocità di risposta che è in
grado di dare il rivelatore : se i picchi sono molto vicini occorre operare a bassa
velocità altrimenti si sovrappongono e lo spettro diventa di difficile interpretazione. È
anche possibile lavorare a lunghezza d’onda fissa facendo però ruotare il rullo di carta
millimetrata : si ottiene così un diagramma che esprime l’andamento dell’assorbanza
in funzione del tempo (studio di cinetiche).
Poter disporre dello spettro di assorbimento visibile e ultravioletto di un campione rende
possibile la risoluzione di problemi di vario genere. I casi più importanti di applicazione
sono :
a) Identificazione della struttura di un composto
Dall’esame dello spettro si possono individuare eventuali gruppi cromofori presenti nella
struttura molecolare : uno spettro semplice e con bande comprese tra 200 e 350 nm può
appartenere ad un composto con un cromoforo organico semplice o al massimo coniugato
con un altro, se ci si trova di fronte a molte bande che sconfinano anche nel visibile allora
si può pensare ad un composto organico molto coniugato oppure ad un complesso di
metalli di transizione. Un ruolo importante nella interpretazione possono avere le intensità
delle bande ma occorre sempre tener conto del fatto una banda debole coperta da una
intensa può far pensare erroneamente ad un’unica banda intensa. Comunque in generale si
può dire che bande tra 270 e 370 nm e con ε compreso tra 10 e 100 corrispondono a
transizioni n→π* . Le bande invece con ε tra 20 e 1000 e con λ maggiore di 400 nm sono
in genere dovuto a transizioni d→d o f→f di metalli di transizione o di lantanidi, mentre
quelle con ε di valore medio (tra 500 e 10000) tra 270 e 370 nm indicano un sistema
aromatico coniugato con altri cromofori. Infine, bande con ε maggiore di 30000 devono
far pensare a transizioni da trasferimento di carica inter o intramolecolari.
Per una più accurata interpretazione degli spettri, gli spettrofotometri più sofisticati sono
dotati anche di un sistema computerizzato in grado di registrare, oltre al normale spettro,
anche quella della derivata di A rispetto λ, anche di ordine superiore ; ad esempio ad un
massimo dell’assorbanza corrisponde un minimo della derivata seconda. La tecnica delle
derivate risulta molto utile quando si a che fare con spettri di miscele con bande
sovrapposte. In questi casi, per poter attribuire la banda ad un dato composto, si può anche
far ricorso al calcolo del valore del cosiddetto quoziente di assorbanza. Tale valore si
22
ottiene facendo il rapporto tra il valore Amax e valore di A relativo al valore della
lunghezza d’onda corrispondente a metà altezza : composti con bande molto simili
presentano, per tali bande, quozienti di assorbanza chiaramente diversi.
b) Scelta del valore di λ da usare nell’analisi quantitativa
Qualsiasi lunghezza d’onda in cui si ha un discreto assorbimento è utilizzabile come
valore fisso per una misura spettrofotometrica finalizzata al dosaggio di una sostanza ; in
genere si preferisce il valore di λ nei dintorni di un massimo assoluto o relativo ma nulla
vieta di riferirsi ad un minimo quando si ha a che fare con miscele in cui il componente
che si sta dosando evidenzia massimi sovrapposti con bande di altre sostanze mentre il
minimo è isolato. È bene tener presente comunque che le zone più ripide delle bande sono
da evitare in quanto in queste zone bastano piccoli variazioni di valori di λ per avere
consistenti oscillazioni di A.
c) Purezza di un composto
Quando una impurezza presenta una caratteristica banda di assorbimento è possibile
seguire l’andamento della purificazione misurando ad ogni stadio (ad ogni
cristallizzazione, ad esempio), così come si fa con il punto di fusione, la relativa
assorbanza : quando il valore di A dell’impurezza si stabilizza ad un valore minimo vuol
dire che è stato raggiunto un soddisfacente grado di purezza.
d) Determinazione del peso molecolare
Qualora un composto incognito sia in grado di legarsi ad un altro composto contenente un
cromoforo di ε noto è possibile risalire alla molarità dell’addotto e quindi anche della
parte incognita. Da tale dato si può ricavare il peso molecolare di quest’ultima :
Dalla legge di Lambert-Beer si sa che A = ε ⋅ b ⋅ c dove c è la molarità e b lo spessore :
ma
c=p/PM
si ottiene : PM =
dove p è la concentrazione in g/l
ε ⋅b ⋅p
A
e) studio di cinetiche
23
quindi A = ε ⋅ b ⋅
p
PM
da cui
Si è già detto che con spettrofotometri a doppio raggio è possibile misurare nel tempo i
valori dell’assorbanza ad una ben precisa lunghezza d’onda. Ciò è di notevole utilità
quando si stanno studiando gli aspetti cinetici di una reazione. Se durante il
raggiungimento dell’equilibrio si va formando qualche prodotto con una banda di
assorbimento caratteristica oppure va scomparendo un componente anch’esso con una
banda tipica, misurando in tempi diversi il valore di A della banda in crescita o della
banda in attenuazione, è possibile avere importanti informazioni sulla velocità della
reazione. Ovviamente se la reazione è molto lenta si può operare anche con un
monoraggio in quanto la misura può essere effettuata senza troppa fretta. Sempre con gli
strumenti a doppio raggio, ma dotati di sistemi di registrazione computerizzati, è possibile
anche studiare la cinetica di reazioni che raggiungono l’equilibrio in qualche frazione di
secondo.
• analisi quantitativa
La tecnica spettrofotometrica UV-VIS può essere usata per il dosaggio di sostanze anche
a concentrazioni piccolissime ; si tratta quindi di un metodo molto sensibile. Però,
affinché ciò sia possibile è necessario che siano verificate certe condizioni e rispettare
certe procedure :
-
La specie chimica
deve essere un “cromoforo naturale” deve cioè presentare un
cromoforo nella sua struttura
-
La specie chimica, pur non presentando un cromoforo nella sua struttura, deve poter
dare, trattata con un opportuno reagente (cromogeno), una nuova specie chimica
presentante un cromoforo
-
Scegliere una opportuna λ di lavoro, come già spiegato parlando della interpretazione
degli spettri
-
Attenersi alle temperature stabilite e rispettare, spesso rigorosamente, i tempi di
reazione (tempi richiesti dalla cinetica di sviluppo del colore), in quanto misure
effettuate prima o dopo il tempo stabilito possono dare valori erronei di assorbimento
Tutti i metodi di analisi quantitativa per via spettrofotometrica si basano sulla legge di
Lambert-Beer però si può procedere in modi diversi . Teoricamente si potrebbe applicare
direttamente la suddetta legge A = ε ⋅ b ⋅ c in quanto A viene misurato, b è generalmente
24
noto per una data cuvetta ed ε è caratteristico per ogni cromoforo, per cui si può risalire a
c. In realtà il valore di ε dipende da molti fattori, chimici e strumentali, per cui raramente è
noto con precisione. Per quanto detto, i metodi normalmente usati per l’analisi quantitativa
sono :
• metodo del confronto con uno standard
• metodo grafico della retta di taratura (o di lavoro)
• metodo delle aggiunte multiple di standard
• metodo dell’additività delle assorbanze (per analisi di miscele di sostante aventi
cromofori diversi)
a) Metodo del confronto con uno standard
È il più semplice dei metodi di analisi quantitativa in assorbimento. Si realizza applicando
la seguente procedura :
-
si fissa la lunghezza d’onda desiderata
-
si azzera e si tara lo spettrofotometro con il “bianco “
-
si manda in lettura una soluzione standard (concentrazione nota) della specie in esame
e si registra il valore AST di assorbanza
-
si sostituisce rapidamente la cuvetta dello standard con un’altra contenente la
soluzione incognita in esame e si registra il valore misurato di assorbanza Ax
Sapendo dalla legge di Lambert-Beer che
A x = a ⋅ b ⋅ cx
si avrà
che
e
Ax
a ⋅ b ⋅ cx
=
A ST a ⋅ b ⋅ c ST
A ST = a ⋅ b ⋅ c ST
e quindi
c x = c ST
Ax
A ST
Questo metodo è molto accurato e preciso se la concentrazione cx del campione in esame e
quella cST dello standard sono abbastanza prossime. Solo in questo caso, infatti, si ha la
certezza che i valori di assorbività siano veramente uguali e si possono semplificare. Se
invece le concentrazioni sono molto diverse, ciò non è garantito, per le inevitabili
deviazioni della legge di Lambert-Beer (vedi argomento successivo) a concentrazioni più
elevate (quindi a c molto diverse, pendenze diverse della retta A=f(c) e, di conseguenza,
valori di a diversi).
b) Metodo grafico della retta di taratura (o di lavoro)
25
Si procede nel seguente modo :
-
Si preparano diverse soluzioni a concentrazione nota della specie chimica da
analizzare tali da dare valori di A compresi tra 0,2 e 0,8
-
Si riportano su grafico i valori di A in funzione della concentrazione e si traccia la
retta passante per i punti : è la retta di lavoro. Essa dovrebbe passare per l’origine ma
non sempre ciò si verifica.
-
Si misura quindi l’assorbanza Ax del campione a concentrazione incognita cx
-
Dalla retta di lavoro, riportando il valore di Ax si può ricavare graficamente cx
Il tutto si può visualizzare mediante la figura che segue.
Si è già detto che gli standard per la costruzione della curva di A
taratura devono avere una concentrazione tale che l’assorbanza sia,
preferibilmente, compresa tra 0,2 e 0,8. Le ragioni di ciò stanno nel
fatto che in tal modo viene ridotto al minimo l’errore fotometrico,
Ax
cx
intendendo con questo termine l’errore associato alla grandezza A o
c
T a causa del diverso comportamento del rivelatore nei confronti di luce molto intensa e di
luce poco intensa. Tale errore si minimizza per A=0,4343 o T%=36,8. È evidente che
anche il campione incognito deve avere una concentrazione tale che la sua assorbanza
rientri nel suddetto ambito di valori di A ; se necessario vanno effettuate delle diluizioni.
Un aspetto importante del metodo della retta di taratura, di cui occorre tener conto, è che
spesso la legge di Lambert-Beer non presenta un andamento lineare ma evidenzia delle
deviazioni sia positive (valori di A superiori al previsto) A
che negative, come espresso dalla figura a fianco. È
ovvio che in tali casi non è possibile ottenere una retta
Deviazione positiva
Deviazione negativa
che passi per i punti trovati. In sostanza tutto ciò sta a
significare che l’assorbività molare della specie che si
c
sta esaminando non è costante per soluzioni a diversa concentrazione, ad una stessa
lunghezza d’onda. Da notare inoltre che le deviazioni si manifestano man mano che cresce
il valore della concentrazione.
Una delle ipotesi più accreditate circa queste deviazioni è che all’aumento della
concentrazione corrisponde un aumento della probabilità di urto tra le particelle in
soluzione e, nel caso di specie ioniche, una variazione anche delle forze interioniche con
conseguente formazione di strutture più complesse, da cui consegue uno spostamento del
26
massimo di assorbimento. Se, inoltre, ad esempio la specie cromofora deriva da un
equilibrio dissociativo è evidente che la linearità della legge si potrà riscontrare solo a
diluizione infinita. Si comprende quindi che la legge di Lambert-Beer è pienamente
rispettata solo in soluzioni molto diluite e questo è pertanto il suo migliore campo di
applicazione, compatibilmente però con la sensibilità dei sistemi di rivelazione ; questa
condizione però è un vantaggio in quanto, considerando che l’assorbanza dovrà assumere
valori compresi tra 0,2 e 0,8 , si può facilmente dimostrare che per valori di ε abbastanza
grandi è possibile misurare concentrazioni fino a 10-8 M. La non linearità della legge di
Lambert-Beer all’aumentare della concentrazione dipende anche da fattori strumentali
come l’ampiezza della banda passante e il fenomeno della luce diffusa.
-
In caso di picchi piuttosto stretti, piccole variazioni nel sistema ottico dello strumento
possono far variare la λ incidente e quindi il valore di ε. Sarà quindi opportuno
operare in modo tale da vere bande passanti strette. Se invece il picco è largo, piccole
variazioni di λ non hanno alcun effetto per cui è consigliabile allargare un po’ la
banda passante in quanto se ne avvantaggia il sistema di rivelazione, venendo infatti
così a ricevere più energia.
-
Il fenomeno della luce diffusa consiste nel fatto che a causa delle imperfezioni
costruttive della strumentazione, della inevitabile presenza di un po’ di luce
ambientale, delle cosiddette armoniche superiori dei monocromatori e della non
perfetta limpidezza delle soluzioni una frazione di luce a lunghezza d’onda variabile
raggiunge il sistema di rivelazione, alterando così leggermente il risultato della
misura.
Per migliorare la precisione di un’analisi con il metodo della retta di taratura è opportuno
preparare i campioni a concentrazione nota in modo tale che contengano non solo il soluto
da dosare ma anche tutte le altre sostanze estranee alla misura presenti nel campione
incognito : standard e campione incognito devono cioè avere, possibilmente, la stessa
matrice. Per quanto riguarda, infine, l’aspetto grafico del diagramma, se i punti non sono
ben allineati, è possibile elaborarli con il metodo dei minimi quadrati in modo da ottenere
così l’equazione della retta ottimizzata :
A = k ⋅ c + z Una volta ottenuti i valori di k e
di z con il suddetto metodo, senza ricorrere al diagramma, per ogni valore di A letto si può
ricavare il valore della concentrazione c .
27
c) metodo delle aggiunte multiple di standard
Questo metodo è di uso generale in quanto è applicabile a tutte le tecniche in cui si misura
una grandezza proporzionale alla concentrazione di una soluzione (o al suo log in taluni
casi). È sicuramente da preferirsi agli altri metodi quando si tratta di determinare la
concentrazione di un analita presente in tracce all’interno di una matrice complessa, perché
consente di eliminare o minimizzare le interferenze chimico-fisiche da matrice. Infatti il
valore della concentrazione di un analita presente in una matrice complessa, ricavato
misurando l’assorbanza e risalendo ad essa attraverso una retta di taratura, ottenuta invece
utilizzando soluzioni pure di standard primari, sarà sicuramente poco accurato proprio per
le interferenze da matrice presente nella soluzione incognita, fisicamente e chimicamente
diversa dalle soluzioni standard. Il metodo delle aggiunte multiple di standard invece,
parte proprio dalla soluzione della matrice complessa a concentrazione incognita cui si
aggiungono quantità note e diverse dell’analita in esame che si troverà così a
concentrazioni diverse ma sempre dentro la stessa matrice. Da un punto di vista pratico il
metodo si esegue con la seguente procedura :
• si prelevano 3-4 volumi uguali Vx della soluzione in esame avente concentrazione Cx e
si trasferiscono in altrettanti matracci tarati aventi un volume Vm
• si porta a volume il matraccio n.1 con acqua deionizzata
• si aggiungono invece agli altri matracci, volumi crescenti (V2, V3, V4 ) di una soluzione
standard a concentrazione nota CST dell’analita da determinare
• si portano a volume questi matracci con acqua deionizzata
• dopo aver azzerato e tarato con il “bianco” lo spettrofotometro, si sottopongono i 3-4
matracci alla misura dell’assorbanza
• si costruisce, con i valori ottenuti, una retta di taratura che presenta il valore
dell’assorbanza della soluzione n.1 (quella senza aggiunte di standard) come ordinata
all’origine, le assorbanze delle altre come ordinate e i volumi di soluzione standard
aggiunti come ascisse.
A
Estrapolando la retta ottenuta fino ad
incontrare
il
semiasse
negativo
dei
Vaggiunte, si individua un valore negativo Vo , come si può vedere nella figura a
P
-Vo
28
V2
V3
V4
Vaggiunte
destra.
Per i calcoli si ragiona così :
-
la concentrazione Ci dell’analita nella soluzione iesima, dopo l’aggiunta di standard e
la diluizione con acqua fino al volume Vm dei matracci, sarà data da :
Ci =
C x ⋅ Vx Vi ⋅ CST
+
Vm
Vm
nel punto P si avrà A=0 quindi :
A = a ⋅b ⋅
C x ⋅ Vx + CST (− Vo )
Vm
=0
poiché a e b sono ≠ 0 risulterà che :
C x ⋅ Vx + CST ( − Vo )
Vm
=0
cioè
C x = CST
Vo
Vx
si giunge quindi facilmente alla concentrazione incognita dell’analita, conoscendo
CST, il valore del volume Vx di campione prelevato inizialmente e determinando
graficamente il valore -Vo.
Se invece di riportare sull’asse delle ascisse i valori Vi dei volumi di soluzione standard
aggiunti si calcolano e si riportano i valori Ci delle concentrazioni dell’analita relative alle
sole aggiunte (dopo diluizione con acqua) cioè :
Ci =
Vi ⋅ CST
Vm
al matraccio n.1 (senza aggiunta) spetterà il valore C1=0 .
Procedendo alle misure, si traccerà una retta A=f(Ci aggiunte) che, estrapolata,
individuerà sul semiasse negativo delle C aggiunte il valore -Cx corrispondente proprio alla
concentrazione cercata (naturalmente
il segno meno non ha nessun significato).
A
P
-Cx
0
C2
C3 C4
Caggiunte
e) metodo dell’additività delle assorbanze (per analisi di miscele di sostante aventi
cromofori diversi)
29
Spesso si incontrano campioni contenenti più specie chimiche assorbenti nella stessa zona
di lunghezza d’onda, i cui spettri risultano essere la somma dell’assorbimento dei singoli
spettri. In questi casi vale la regola che l’assorbimento complessivo per ciascun valore di
λ sarà uguale alla somma dei singoli assorbimenti cioè Atot=A1+A2+A3+.... . Nel caso più
semplice di due specie chimiche, per poterle analizzare quantitativamente, è necessario
misurare l’assorbanza del campione a due diversi valori di λ.
Per λ1 si ha :
A tot 1 = ε xλ 1 ⋅ b ⋅ c x + ε λy 1 ⋅ b ⋅ c y
mentre per λ2 si a :
A tot 2 = ε xλ 2 ⋅ b ⋅ c x + ε λy 2 ⋅ b ⋅ c y
dove i quattro valori di ε sono le assorbività molari delle due specie da dosare alle due
diverse lunghezze d’onda prescelte e cx e cy le concentrazioni dei soluti da determinare.
Dalle due equazioni si ha quindi il sistema :
{
A tot 1 = ε xλ 1 ⋅ b ⋅ c x + ε λy 1 ⋅ b ⋅ c y
A tot 2 = ε xλ 2 ⋅ b ⋅ c x + ε λy 2 ⋅ b ⋅ c y
In pratica si misurano i valori delle due Atot alle lunghezze d’onda λ1 e λ2, quindi, essendo
b noto, se sono noti anche i quattro valori delle assorbività molari, è possibile risolvere il
sistema in cui le due incognite sono cx e cy .
30