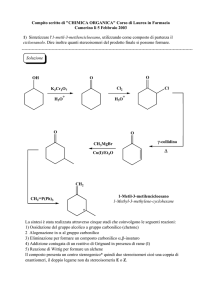
Introduzione alla chimica organica
Daniele Dondi
[email protected]
Il carbonio nelle sue ibridazioni
C
C
C
C
sp3
sp2
sp
Il carbonio è un elemento fondamentale per la chimica organica.
La stabilità del legame C-C permette la formazione di strutture
anche molto complesse
I più semplici composti del carbonio,
gli IDROCARBURI
Gli idrocarburi, come dice il nome, sono composti contenenti solo carbonio e
idrogeno.
Gli idrocarburi si dividono in saturi (alcani), insaturi (alcheni e alchini) e aromatici.
Gli idrocarburi saturi (ALCANI) contengono solo legami semplici carbonio-carbonio:
H
H
H
H
H
C
H
H
C
H
C
H
metano
H
etano
H
H
H
H
H H
H H
C
C
C
H
H
propano
H
H
C
H
H
C
C
C
H
H H
butano
I termini successivi hanno nomi più regolari ad esempio pentano, esano,
eptano, ottano, nonano …
H
Idrocarburi saturi,
gli ALCANI
Formula generale: CnH2n+2
CH2
CH3
CH2
CH2
CH2
CH3
CH3
CH3
CH3
CH
CH3
lineare
C5H12
CH3
C
H3C
CH3
ramificati
C5H12
Isomeri di struttura
C5H12
Idrocarburi saturi,
i CICLOALCANI
CH2
H2C
H2C
CH2
CH2
CH2
H2C
CH2
CH2
CH2
CH2
H2C
ciclopropano
CH
CH2
CH
C
H2
cicloesano
CH2
CH2
H2C
ciclobutano
CH3
H2C
H2C
CH2
CH2
CH2
CH2
CH
CH2
CH2
Idrocarburi insaturi,
gli ALCHENI
Gli alcheni contengono almeno un legame doppio carbonio-carbonio
H
L’alchene più semplice è l’etilene:
H
C
C
H
CH3
H
Cis
Trans
H2C
H
H
CH2
C
H
H
H
C
H
H
H
CH3
1-pentene
H
H
H H
H
H
H
H
H H
Isomeri geometrici
Idrocarburi insaturi,
gli ALCHINI
Gli alcheni contengono almeno un triplo legame carbonio-carbonio (ibridazione sp)
R
HC
C
CH2
CH3
R'
propino
CH3
CH2
CH2
C
Acetilene o etino
CH
HC
C
CH2
CH2
CH2
CH2
1-decino
C
CH
.. Ovviamente anche alcheni e alchini possono avere i corrispondenti
derivati ciclici
Idrocarburi aromatici, il benzene
=
C6H6
4n+2 elettroni pi greco
Aromaticità
=
naftalene
=
…
I vertici sono atomi di
carbonio saturati da
idrogeni
O
Gli atomi diversi dal
carbonio, chiamati
eteroatomi sono indicati
Le linee
rappresentano legami
singoli, doppi o tripli
H2C
CH2
O
HC
CH2
CH
C
HC
C
H
In assenza di cariche formali (indicate in tal caso vicine all’atomo) il
carbonio ha sempre 4 legami, l’ossigeno 2 e l’azoto 3.
O
O
NH
N
Cl-
N
NH2
N
N
HO
N
N
O
H
H
O
H
H
O
H
P
O-
O-
In assenza di cariche formali (indicate in tal caso vicine all’atomo) il
carbonio ha sempre 4 legami, l’ossigeno 2 e l’azoto 3.
H
C
Metano
CH4
H
H
H
H
H
C
Metanolo
CH3OH
O
H
H
H
H
H
H
O
H
H
C
C
C
H
C
C
H
H
H
CH3CH2CH2CH2CH2OH
H
H
H H
H
H
H
H
C
CH2
C
C
H
CH2
C
C
H
CH
C
H
CH
H
CH2
CH2
Equivalenza di formule di struttura
H
H
H
H
O
H
H
C
H
C
C
H
H
H
H
OH
C
C
CH3CH2CH2CH2CH2OH
H
H H
H
H
H
H
C
CH2
C
C
H
CH2
CH2
C
C
H
CH
CH2
C
H
CH
H
I gruppi funzionali
Alcoli
R-OH
R rappresenta un gruppo
generico, solitamente
contenente atomi di carbonio
(residui di alcani alcheni ecc.)
esempi
CH3OH
Metanolo
CH3CH2OH
Etanolo
Gli alcoli sono
un’importante classe
di composti organici,
le caratteristiche
fisiche (elevato p.eb.)
sono legate al
legame ad idrogeno
O
Isopropanolo
OH
R
R
H
O
H
I gruppi funzionali
Eteri
R-O-R’
R e R’ rappresentano gruppi
generici, solitamente
contenente atomi di carbonio
esempi
CH3OCH3
dimetiletere
CH3CH2OCH2CH3 dietiletere
Gli eteri presentano
punti di ebolizione
più bassi dei
corrispondenti alcoli,
non potendo formare
legami ad idrogeno
I gruppi funzionali
O
Gruppo carbonilico
C
O
O
aldeidi
C
R
H
Formaldeide o metanale
C
H
H
O
O
chetoni (R,R’≠ H)
C
R
R'
C
H3C
CH3
Acetone o
propanone
I gruppi funzionali
O
Acidi
R-COOH
R
OH
esempi
COOH
HCOOH
Acido formico
CH3COOH
Acido acetico
Acido benzoico
I gruppi funzionali
O
Esteri
R-COOR’
R'
R
O
Derivati dalla reazione tra un acido e un alcool
R-COOH
+
R’-OH
R-COOR’
+
H2O
I gruppi funzionali
Ammine
R-NH2
primarie
R2-NH
secondarie
R3-N
terziarie
NH2
N
trimetilammina
butilammina
I gruppi funzionali
Ammidi
R-CONH2
o R-CO-NHR’
Importante gruppo funzionale presente ad
esempio nelle proteine.
O
H2N
CH
CH3
C
O
H
N
CH
C
O
H
N
H
CH
C
CH2
N
NH
OH
I gruppi funzionali
Ammidi
R-CONH2
o R-CO-NHR’
Derivano dalla reazione tra un acido e un’ammina
R-COOH
+
R’-NH2
R-CONHR’
+
H2O
Composti
I gruppipolifunzionali,
funzionali
gli aminoacidi
Gli aminoacidi sono composti che hanno sia un gruppo amminico (basico) che un
gruppo carbossilico (acido). Gli aminoacidi più importanti sono gli alfa-aminoacidi
poiché presenti negli organismi viventi
CH
NH2
COOH
Formula generale
R
CH2
NH2
COOH
Glicina, l’aminoacido più semplice
CH
NH3+
R
COO-
Sale interno o zwitterion