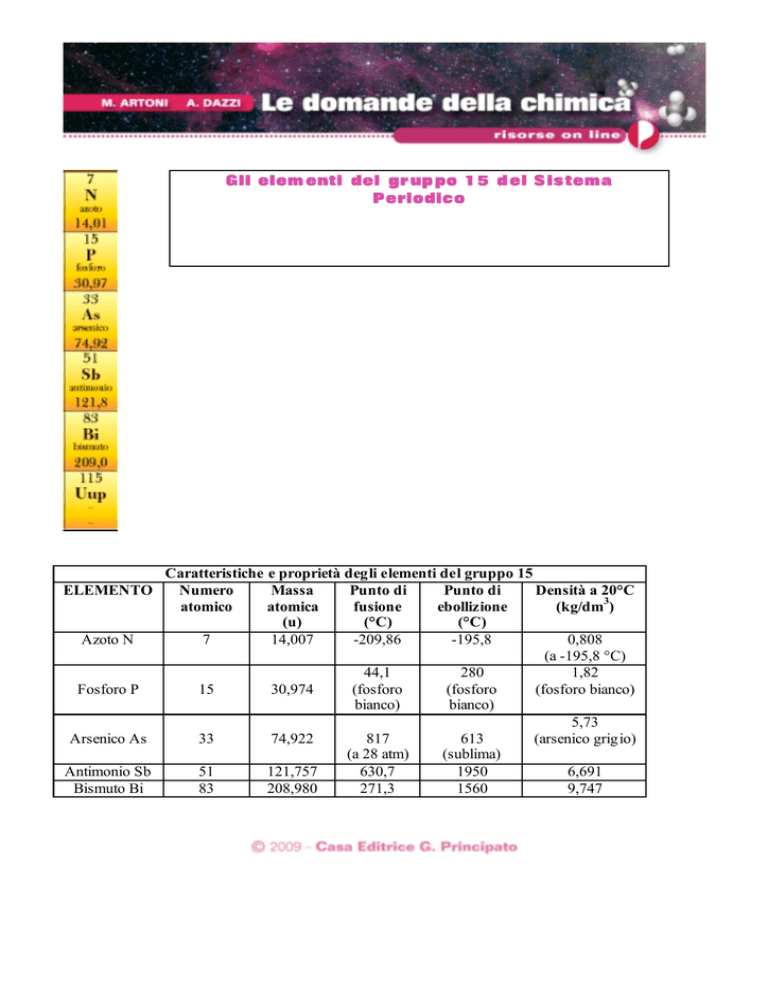
Gli elem enti del gr up po 1 5 d el S is tema
P eriodic o
Caratteristiche e proprietà degli elementi del gruppo 15
ELEMENTO
Numero
Massa
Punto di
Punto di
Densità a 20°C
atomico
atomica
fusione
ebollizione
(kg/dm3)
(u)
(°C)
(°C)
Azoto N
7
14,007
-209,86
-195,8
0,808
(a -195,8 °C)
44,1
280
1,82
Fosforo P
15
30,974
(fosforo
(fosforo
(fosforo bianco)
bianco)
bianco)
5,73
Arsenico As
33
74,922
817
613
(arsenico grigio)
(a 28 atm)
(sublima)
Antimonio Sb
51
121,757
630,7
1950
6,691
Bismuto Bi
83
208,980
271,3
1560
9,747
Anche nel gruppo 15 la variazione di proprietà è forte lungo il gruppo e il carattere metallico cresce con
l’aumentare del numero atomico: così, mentre l’azoto è un tipico non metallo, il bismuto è un
elemento in cui prevalgono le caratteristiche metalliche.
La configurazione elettronica degli elementi del gruppo 15 presenta 5 elettroni nell’ultimo guscio:
npx
npy
npz
ns
↑
↑
↑
↑↓
Il raggiungimento di una configurazione stabile presuppone quindi l’acquisto di 3 elettroni. Questa
configurazione viene raggiunta formando sia composti in cui l’elemento assume numero di ossidazione
– 3 come i fosfuri, ad esempio il fosfuro di calcio, Ca3P2, e gli arseniuri, ad esempio l’arseniuro di
gallio, GaAs, sia formando composti in cui l’elemento assume numeri di ossidazione positivi +3, ad
esempio gli ossidi N2O3, P2O3, As2O3. La presenza dei doppietti elettronici non condivisi degli orbitali
s permette anche la formazione di legami dativi; per questa ragione gli elementi del gruppo 15 non
sono solo trivalenti ma possano presentare anche altri numeri di ossidazione.
Degli elementi del gruppo 15 i più diffusi sono l’azoto e il fosforo. L’azoto, N2, è il componente più
abbondante dell’atmosfera terrestre; è, con il carbonio, l’ossigeno e l’idrogeno, un componente
fondamentale della materia vivente; in particolare è presente nelle proteine, le molecole di base della
struttura cellulare e negli acidi nucleici, le molecole depositarie del codice della vita. L’azoto nei suoi
composti assume una grande varietà di numeri di ossidazione come mostra la tabella che segue.
n° di ossidazione
1
2
3
4
5
Composti ossigenati dell’azoto
ossido
N2O
Ossido di diazoto
NO
Ossido d’azoto
N2O3
Triossido di diazoto o anidride
nitrosa
N2O4
Tetrossido di diazoto
N2O5
Pentossido di diazoto o
anidride nitrica
acido
HNO2
Acido nitroso
HNO3
Acido nitrico
Ecco le caratteristiche di alcuni importanti composti:
• Ossido di diazoto, N2O: è chiamato anche protossido, ossidulo di azoto, gas esilarante, è
utilizzato in medicina come anestetico.
• Acido nitroso, HNO2: è un acido debole, instabile, che esiste solo in soluzione diluita.
• Acido nitrico, HNO3: È un acido forte. A temperatura ambiente è un liquido incolore che
spesso assume una colorazione giallastra a causa delle impurità che vi sono disciolte; puro e in
soluzione concentrata si decompone lentamente liberando vapori di diossido di azoto, NO2, da
cui il nome di acido nitrico “fumante” che viene dato alle soluzioni con concentrazione
superiore all’85%, al di sopra della quale si manifesta tale fenomeno.
I sali dell’acido nitrico, i nitrati, sono quasi tutti solubili in acqua.
Oltre a questi, un altro importante composto dell’azoto è l’ammoniaca, NH3: è un gas incolore,
dall’odore pungente e irritante; disciolta in acqua forma una soluzione basica:
NH3 + H2O NH4+ + OHL’ammoniaca reagisce con gli acidi formando dei sali di ammonio, in cui è presente lo ione ammonio,
NH4+ , in sostituzione di uno ione metallico:
HCl
acido cloridrico
+
NH3
ammoniaca
NH4Cl
cloruro di ammonio
Il cloruro di ammonio, ad esempio, è una sostanza ionica formata dallo ione cloruro Cl- e dallo ione
NH4+ .
Il fosforo, P, è un elemento abbastanza diffuso in natura: è il dodicesimo per abbondanza tra gli
elementi della crosta terrestre. Allo stato elementare è presente in due forme: la più stabile è il fosforo
bianco costituito da molecole di formula P4. Si presenta come una sostanza solida che sprigiona fumi
in presenza di aria e si incendia ad una temperatura di poco superiore ai 35 °C; è una sostanza molto
tossica, che, soprattutto nel XIX secolo, fu causa di gravi intossicazioni tra gli operai delle fabbriche di
fiammiferi. La seconda forma di fosforo elementare è il fosforo rosso, costituito da macromolecole
formate da catene di atomi di fosforo legati fra di loro; è molto meno tossico del fosforo bianco e si
incendia all’aria solo a temperature superiori ai 250 °C.
Nei suoi composti il fosforo presenta principalmente numeri di ossidazioni +3 e +5: ciò è
particolarmente evidente nei suoi ossidi:
•
•
P4O6 esaossido di tetrafosforo (numero di ossidazione +3)
P4O10 decaossido di tetrafosforo (numero di ossidazione +5)
Tra i composti del fosforo, il più importante è l’acido (orto)fosforico H3PO4 (in cui il fosforo presenta
numero di ossidazione +5); è solido a temperatura ambiente perché fonde a 42 °C,; in soluzione
acquosa si comporta da acido triprotico, può cioè cedere in successione tutti i tre atomi di idrogeno
della sua molecola, formando gli ioni diidrogenofosfato, H2PO4-, idrogenofosfato, HPO42- e fosfato,
PO43-, ed i rispettivi sali. Del più importante di questi, il fosfato di calcio, Ca3(PO4)2 si è già detto
parlando degli elementi del II gruppo.
Tra gli altri elementi del V gruppo una breve menzione merita l’arsenico, As, soprattutto per essere
noto come un potente veleno: il comportamento chimico dell’arsenico è infatti assai simile a quello del
fosforo, tanto da sostituire quest’ultimo in reazioni e processi biologici provocando, in tal modo, effetti
tossici per l’organismo.












