CLASSIFICAZIONE E NOMENCLATURA DEI COMPOSTI CHIMICI
Come sappiamo, i composti attualmente conosciuti sono circa 6 milioni ed il loro numero aumenta
ad un ritmo di circa 6000 alla settimana. E’ chiaro quindi che una tale massa di sostanze ha bisogno di
essere organizzata secondo regole chiare, semplici ed universalmente condivise. Lo scopo della
nomenclatura è quindi proprio quello di fornire una serie di regole che permettano di individuare un
composto, attribuendogli in modo univoco e chiaro un nome preciso ed una formula, attraverso l’impiego
del minor numero possibile di parole. Le prime basi di questo lavoro vennero gettate alla fine del ‘700 dal
chimico francese A. L. Lavoisier (1743 - 1794), il quale nel suo Traité élémentaire de chimie, pone le
basi per quella che viene tuttora chiamata nomenclatura tradizionale. A partire dagli anni ’70 del ‘900 a
tale nomenclatura se ne affianca un’altra, chiamata nomenclatura ufficiale, elaborata dalla IUPAC (sigla
derivante dalle iniziali dell’International Union of Pure ad Applied Chemistry, l’organismo scientifico
internazionale preposta alla definizione della nomenclatura chimica), il cui uso sta lentamente
soppiantando quello della nomenclatura tradizionale. E’ tuttavia importante ricordare che le regole della
nomenclatura, affidate a Commissioni permanenti nell’ambito della IUPAC, sono in continua evoluzione
e seguono di pari passo lo sviluppo stesso della chimica..
In questo capitolo esamineremo quindi le regole per assegnare i nomi ad alcune delle principali
classi di composti, di cui analizzeremo inoltre le caratteristiche più importanti. Ricordiamo che i composti
chimici sono sostanze costituite da due o più atomi di elementi differenti legati tra loro; se gli atomi
appartengono a due diversi elementi i composti si dicono binari, se gli atomi appartengono invece a tre
elementi diversi i composti si dicono ternari. Per ricordare le caratteristiche e le proprietà delle sostanze
che adesso descriveremo, basterà osservare quali atomi o gruppi di atomi sono presenti al loro interno e
quali sono le reazioni caratteristiche di ciascun gruppo di sostanze a cui essi appartengono. Tuttavia,
prima di entrare nel merito di questi problemi, dobbiamo introdurre un nuovo concetto che ci sarà di
fondamentale aiuto, sia in questa parte del programma, che in quella finale, relativa all’elettrochimica.
Il numero di ossidazione: è una carica positiva o negativa che viene attribuita formalmente a
ciascun elemento in un composto; detta carica è determinata dal numero di elettroni che l’elemento
possiede in più (carica negativa) o in meno (carica positiva) rispetto all’atomo neutro, quando gli elettroni
di legame vengono attribuiti all’elemento più elettronegativo del composto stesso.
Dalla prima lettura di questa definizione, il numero di ossidazione potrà sembrare un’entità di
difficile comprensione oppure del tutto astrusa, andando avanti vedremo invece che esso è uno strumento
indispensabile per orientarsi nel mondo delle ossidoriduzioni. Queste reazioni, a loro volta, sono
importantissime, non tanto perché hanno contribuito in modo determinante a diffondere tra gli studenti
l’idea che la chimica fosse “difficile”, quanto perché la stragrande maggioranza dell’energia prodotta
dall’uomo sulla Terra deriva da reazioni di questo tipo, mentre anche altri importantissimi fenomeni
chimici, come ad esempio la corrosione dei metalli, derivano da processi ossidoriduttivi. La definizione
del numero di ossidazione sopra riportata diventerà nei prossimi paragrafi talmente utile, che è
consigliabile impararla a memoria; inoltre, prima di poter specificare meglio il significato e l’utilità del
numero di ossidazione stesso, è opportuno imparare le regole per il suo calcolo. Tuttavia dobbiamo
specificare che il numero di ossidazione non è una carica vera e propria, bensì una carica “fittizia”, che
viene “attribuita” ad ogni elemento di un qualsiasi composto, quando gli elettroni di legame sono
assegnati all’elemento più elettronegativo presente nel composto medesimo. Tutti gli elementi di qualsiasi
composto hanno quindi un numero di ossidazione; in ogni composto si deve innanzitutto stabilire quale
elemento è più elettronegativo, ad esso si attribuiscono tutti gli elettroni dei legami che esso forma con
altri atomi ed infine si vede quali cariche gli atomi assumono dopo questa attribuzione fittizia. In ogni
caso, se si impara ad applicare le regole sotto riportate, il calcolo del numero di ossidazione diventa una
procedura piuttosto semplice.
Regole per il calcolo del numero di ossidazione:
1) Tutte le sostanze allo stato elementare hanno numero di ossidazione zero. In tal caso infatti tutti gli
atomi sono identici tra loro e non esiste dunque nessun elemento più elettronegativo degli altri cui
attribuire gli elettroni di legame.
composti1
2) Negli ioni monoatomici gli elementi hanno numero di ossidazione uguale alla carica ionica. Ad
esempio lo ione Ca2+ ha numero di ossidazione +2, mentre lo ione Cl ha numero di ossidazione –1.
3) Alcuni elementi mantengono costante il loro numero di ossidazione in tutti i composti che formano,
mentre altri lo variano da un composto all’altro.
In generale i numeri di ossidazione seguono il seguente schema:
a) L’idrogeno ha sempre +1 oppure –1;
b) I metalli hanno solo numeri di ossidazione positivi;
c) I non metalli possono avere numeri di ossidazione positivi o negativi;
d) Tranne alcune eccezioni gli elementi di gruppi pari hanno solo numeri di ossidazione pari, mentre
quelli dei gruppi dispari hanno solo numeri di ossidazione dispari;
e) Per tutti gli elementi, tra i numeri di ossidazione positivi il più alto corrisponde al numero del gruppo
cui l’elemento appartiene. Per quanto detto alla lettera precedente, gli altri numeri di ossidazione si
ottengono riducendo di 2, 4 o 6 unità il numero di ossidazione più alto.
Per quanto detto finora risulta che:
I.
Gli elementi del primo gruppo hanno sempre +1;
II.
Gli elementi del secondo gruppo hanno sempre +2;
III.
Gli elementi del terzo gruppo hanno sempre +3;
IV.
Nel quarto gruppo il carbonio ha –4, +4 e +2; il silicio –4 e +4; stagno e piombo +4 e +2;
V.
Nel quinto gruppo l’azoto ha –3, +1, +2, +3, +4 e +5; il fosforo –3, +3 e +5; l’antimonio +3 e +5;
VI.
Nel sesto gruppo l’ossigeno ha praticamente sempre –2, lo zolfo ha –2, +4 e +6;
VII. Nel settimo gruppo il fluoro ha sempre –1; gli altri elementi hanno –1, +1, +3, +5 e +7.
VIII. Per i metalli di transizione non esistono regole così chiare;
4) La somma algebrica dei numeri di ossidazione di tutti gli atomi di tutti gli elementi presenti in un
composto è uguale a zero, se il composto è neutro, oppure è uguale alla carica ionica, se il composto è
uno ione poliatomico.
5) In ogni composto l’elemento più elettronegativo di tutti ha sempre numero di ossidazione negativo,
mentre tutti gli altri elementi hanno numero di ossidazione positivo.
Esempi di calcolo del numero di ossidazione degli elementi di alcuni composti
Cl2O l’elemento più elettronegativo è l’ossigeno che ha sempre numero di ossidazione –2; il cloro deve
avere invece numero di ossidazione positivo e la somma algebrica dei numeri di ossidazione dei tre atomi
deve essere uguale a zero, essendo il composto neutro. Applicando questi presupposti scriviamo
un’equazione considerando come incognita il numero di ossidazione del cloro.
2 x X (Cl) –2 (O) = 0 risolvendo si trova che X (numero di ossidazione del cloro) è +1.
HCl l’elemento più elettronegativo è il cloro, che quindi deve avere numero di ossidazione negativo,
questo non può essere inoltre che –1. Poiché il composto è neutro, la somma algebrica dei numeri di
ossidazione di tutti gli atomi del composto deve essere zero. L’idrogeno ha pertanto numero di
ossidazione +1.
H2SO4 l’elemento più elettronegativo è l’ossigeno, il cui numero di ossidazione è –2. Zolfo e idrogeno
devono quindi avere numeri di ossidazione positivi e per l’idrogeno il numero di ossidazione non può che
essere +1. Resta da determinare il numero di ossidazione dello zolfo, che si ottiene risolvendo la seguente
equazione:
+2 x 1 (H) + X (S) – 4 x 2 (O) = 0 risolvendo si trova che X=6
2CO3 l’elemento più elettronegativo è l’ossigeno, il cui numero di ossidazione è –2. Il composto è un
anione bivalente e pertanto la somma algebrica dei numeri di ossidazione deve essere pari a –2;
risolviamo quindi la solita equazione, assegnando l’incognita al numero di ossidazione del carbonio
X (C) – 3 x 2 (O) = -2 risolvendo troviamo che x = 4
Regole per la scrittura delle formule dei composti binari
Una volta noto il numero di ossidazione degli elementi che formano un composto binario non è
difficile scriverne la formula, basta ricordare che la somma dei numeri di ossidazione di tutti gli atomi di
2
composti1
un elemento deve essere uguale, in valore assoluto, alla somma dei numeri di ossidazione di tutti gli
atomi dell’altro elemento1.
Esempi
Trovare la formula del composto che si forma tra ossigeno e potassio. Si scrivono l’uno
+1
accanto all’altro i simboli dei due elementi, avendo cura di scrivere per primo quello meno
elettronegativo, si scrive poi sopra ognuno di essi il rispettivo numero di ossidazione. Poiché il
potassio ha numero di ossidazione +1 e l’ossigeno 2, per pareggiare la somma dei numeri di ossidazione
sono necessari due atomi di potassio ed uno di ossigeno. La formula del composto sarà allora K2O.
Trovare la formula del composto che si forma tra calcio e ossigeno. Si ripetono
+2
innanzitutto i passaggi iniziali. Poiché i due atomi hanno numero di ossidazione,
rispettivamente, +2 e 2, per pareggiare la somma dei numeri di ossidazione bastano un atomo
di calcio ed uno di ossigeno: la formula del composto sarà dunque CaO.
Trovare la formula del composto che si forma tra alluminio ed ossigeno. Poiché
+3
l’alluminio ha numero di ossidazione +3, mentre l’ossigeno ha numero di ossidazione 2, per
bilanciare la somma dei numeri di ossidazione sono necessari due atomi di alluminio e tre di
ossigeno: la formula del composto sarà allora Al2O3.
La regola di Zaza
In alcuni casi gli studenti più furbini usano semplificare le cose, ricavando il deponente di ogni
elemento dal valore assoluto del numero di ossidazione dell’elemento che gli sta accanto. In pratica si
incrociano gli indici ed i numeri di ossidazione, scrivendo a destra del primo elemento valore assoluto del
numero di ossidazione del secondo e viceversa. Tale sistemino è ammesso, ricordando però che:
l’indice 1 non si indica mai;
gli indici, tranne che in alcune formule molecolari, debbono essere ridotti ai minimi termini.
Così, ad esempio, applicando la regola di Zaza al composto che si forma tra calcio ed ossigeno, che
hanno, rispettivamente, numero di ossidazione +2 e 2, si otterrebbe la formula Ca2O2, mentre la formula
corretta è CaO.
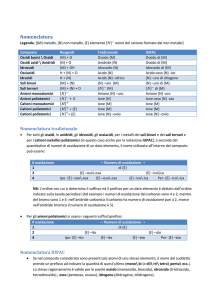
Nomenclatura dei composti chimici
Le formule chimiche hanno valore universale, nel senso che sono le stesse in ogni parte del mondo.
Per quanto riguarda invece i nomi dei composti esistono ancora delle discrepanze, dovute all’uso dei due
diversi sistemi di nomenclatura già citati2. Il primo, denominato nomenclatura tradizionale, prevede
l’uso di prefissi e suffissi, in basa al numero di ossidazione dei vari elementi. Il secondo sistema,
denominato nomenclatura ufficiale o nomenclatura IUPAC, si basa sul numero di atomi di ogni
elemento presenti all’interno del composto, che sono evidenziati tramite i
n° atomi prefisso
prefissi di origine greca indicati nella tabella a fianco; quando è presente
2
bi (o di)
un solo atomo di un elemento non si utilizza alcun prefisso. Inoltre,
quando un elemento ha poi più di un numero di ossidazione, la
3
tri
nomenclatura IUPAC prevede che questo venga indicato tra parentesi a
4
tetra
fianco del nome del composto. Nella trattazione che segue utilizzeremo
5
penta
come base la nomenclatura tradizionale, specificando poi per ogni gruppo
di sostanze anche la nomenclatura ufficiale.
6
esa
7
epta
OSSIDI (METALLO +OSSIGENO)
Sono composti binari formati dall’unione di un metallo con
l’ossigeno; poiché l’ossigeno è molto più elettronegativo dei metalli, tutti gli ossidi sono composti ionici e
1
In un composto binario uno dei due elementi avrà ovviamente numero di ossidazione negativo, mentre l’altro lo avrà
positivo
2
Nella realtà molti composti continuano a mantenere anche dei nomi commerciali, che possono variare da paese a
paese. L’acido cloridrico (HCl), ad esempio, è conosciuto commercialmente come acido muriatico, l’ossido di calcio (CaO) è
conosciuto col nome commerciale di calce (o calce viva), l’idrossido di calcio [Ca(OH)2]è conosciuto come calce spenta,
l’ossido di magnesio (MgO) è conosciuto come magnesia, l’idrossido di sodio (NaOH) è noto come soda caustica, l’acido
solforico (H2SO4) è noto come vetriolo ecc. Inoltre, alcuni nomi tradizionali, fortemente radicati nell’uso comune, sono stati
accettati come internazionalmente validi. Si pensi ad esempio all’acqua, all’ammoniaca (NH3) o al metano (CH4).
3
composti1
quindi solidi a temperatura ambiente. La formula di questi composti si ottiene applicando le regole
indicate in precedenza.
Nomenclatura tradizionale:
a) se il metallo ha un solo numero di ossidazione: ossido di nome metallo (es. ossido di sodio
Na2O)
b) se il metallo ha due numeri di ossidazione: ossido + nome metallo con desinenza OSO per il
numero di ossidazione minore; ossido + nome metallo con desinenza ICO, per il numero di ossidazione
maggiore. Ad es. ossido piomboso PbO (numero di ossidazione +2); ossido piombico PbO2 (numero di
ossidazione +4).
Nomenclatura ufficiale:
Si contano il numero di atomi di ogni elemento e si utilizzano i relativi prefissi, avendo cura di
scrivere inizialmente il termine “ossido di”. Ad es. Na2O ossido di disodio; PbO ossido di piombo (+2);
PbO2 biossido di piombo (+4).
ANIDRIDI (NON METALLO + OSSIGENO)
Sono composti binari formati dall’unione di non metalli ed ossigeno; dato che la differenza di
elettronegatività tra l’ossigeno e gli altri non metalli è sempre piccola, le anidridi sono composti covalenti
più o meno polari, che a temperatura ambiente possono essere solidi, liquidi o gassosi.
Nomenclatura tradizionale
a) se il non metallo ha un solo numero di ossidazione: anidride + nome non metallo terminante in
ICA. Ad es. anidride carbonica CO2
b) se il non metallo ha due soli numeri di ossidazione: anidride + nome non metallo terminante in
OSA, per il numero di ossidazione minore; anidride + nome non metallo terminante in ICA, per il numero
di ossidazione maggiore. Ad es. anidride solforosa SO2 (numero di ossidazione +4), anidride solforica
SO3 (numero di ossidazione +6);
c) se il non metallo ha quattro numeri di ossidazione, come avviene per gli elementi del 7° gruppo
che hanno numeri di ossidazione +1,+3,+5,+7, si hanno i seguenti quattro casi:
anidride IPO nome non metallo terminante in OSA per il numero di ossidazione +1. Es. Cl2O
anidride ipoclorosa;
anidride + nome non metallo terminante in OSA per il numero di ossidazione +3. Es. Cl2O3
anidride clorosa;
anidride + nome non metallo terminante in ICA per il numero di ossidazione +5. Es. Cl2O5 anidride
clorica;
anidride PER nome non metallo terminante in ICA per il numero di ossidazione +7. Es. Cl2O7
anidride perclorica.
Nomenclatura ufficiale
Nella nomenclatura ufficiale anche i composti tra ossigeno e non metalli sono chiamati ossidi e si
utilizzano come sempre i prefissi relativi al numero di atomi degli elementi.
Ad esempio: SO2 biossido di zolfo (+4); SO3 triossido di zolfo (+6)¸ Cl2O ossido di dicloro (+1);
Cl2O3 triossido di dicloro (+3); Cl2O5 pentaossido di dicloro (+5); Cl2O7 eptaossido di dicloro (+7).
IDROSSIDI (METALLO + GRUPPO OSSIDRILE OH)
Sono composti ternari di ossigeno, idrogeno e metalli, in essi compare il gruppo ossidrile (OH), che
si comporta come se avesse numero di ossidazione 1. Gli idrossidi sono tutti composti ionici e sono
pertanto tutti solidi a temperatura ambiente.
Essi derivano dalla reazione tra ossidi e acqua, in cui il metallo mantiene sempre lo stesso numero
di ossidazione. Ecco un esempio:
+1
-2
2
+1
+ H2
4
→ 2 Na
-1
composti1
Per scrivere la formula del composto si utilizzano le regole già fornite per i composti binari,
compresa la regola di Zaza, e si considera l’ossidrile come un elemento a numero di ossidazione 1.
Successivamente si deve bilanciare la reazione, in quanto, in accordo con la legge di Lavoisier, la somma
delle masse (e quindi il numero di atomi) dei vari elementi, deve essere uguale a destra ed a sinistra della
reazione. Per far ciò basta aggiungere davanti alla formula dell’idrossido un coefficiente uguale all’indice
del metallo nell’ossido; inoltre si deve eventualmente aggiungere un coefficiente davanti alla formula
dell’acqua, in modo tale da bilanciare anche l’idrogeno e l’ossigeno.
Facciamo un altro esempio:
+3
-2
2
+3
3
+ H2
-1
→ Fe
3
In questo caso, una volta scritto il coefficiente 2 davanti alla formula dell’idrossido, si vengono ad
avere a destra 6 atomi di idrogeno e 6 di ossigeno; per bilanciare questi due elementi si deve mettere
allora un 3 davanti alla molecola dell’acqua.
+3
-2
2
3
+3
+ 3H 2
→ 2 Fe
-1
3
Nomenclatura tradizionale
a) se il metallo ha un solo numero di ossidazione: idrossido di nome metallo. Ad es. idrossido di
sodio Na (OH).
b) se il metallo ha due numeri di ossidazione: idrossido + nome metallo terminante in OSO, per il
numero di ossidazione minore; idrossido + nome metallo terminante in ICO, per il numero di ossidazione
maggiore. Ad es. idrossido rameoso Cu(OH) (+1); idrossido rameico Cu(OH)2 (+2).
Nomenclatura ufficiale
Si indica il numero dei gruppi ossidrile ponendo i soliti prefissi davanti al termine “idrossido”:
Na(OH) idrossido di sodio; Fe(OH)3 triidrossido di ferro (+3).
IDRACIDI o acidi binari (IDROGENO + NON METALLO)
Sono composti binari formati dall’unione dell’idrogeno con uno dei sei seguenti non metalli: F; Cl;
Br; I; S; Se. Gli idracidi sono composti covalenti polari ed a temperatura ambiente sono tutti gassosi,
tranne HF, che è liquido a causa del legame a ponte di idrogeno.
Negli idracidi gli elementi del 7° gruppo hanno sempre numero di ossidazione 1, mentre gli
elementi del 6° gruppo hanno sempre numero di ossidazione 2;
Nomenclatura tradizionale:
acido + nome non metallo terminante in IDRICO: HF acido fluoridrico; HCl acido cloridrico; HBr
acido bromidrico; HI acido iodidrico; H2S acido solfidrico; H2Se acido selenidrico.
Nomenclatura ufficiale
Si scrive il nome del non metallo, terminate in URO, e si indica il numero degli atomi di idrogeno
coi soliti prefissi: HF fluoruro di idrogeno; HCl cloruro di idrogeno; HBr bromuro di idrogeno; HI
ioduro di idrogeno; H2S solfuro di diidrogeno; H2Se seleniuro di dididrogeno.
OSSIACIDI o acidi ternari (IDROGENO + NON METALLO + OSSIGENO)
Sono composti ternari in cui è presente idrogeno, ossigeno ed un non metallo; data la piccola
differenza di elettronegatività esistente tra questi elementi, gli ossiacidi sono composti covalenti polari
solidi o liquidi a temperatura ambiente. Gli ossiacidi derivano dalla reazione tra anidridi e acqua, in cui il
non metallo mantiene sempre lo stesso numero di ossidazione; inoltre nella formula dell’ossiacido il non
metallo è presente, tranne qualche eccezione, sempre con un solo atomo. Ad esempio
+4
-2
2
+1
+ H2
-2
+1
→ H2
+4 -2
3
Per calcolare il numero di ossidazione del non metallo si deve innanzi tutto ricordare che l’idrogeno
ha sempre numero di ossidazione +1, mentre l’ossigeno ha sempre numero di ossidazione −2; inoltre la
somma dei numeri di ossidazione di tutti gli atomi di ossigeno deve essere uguale alla somma della
5
composti1
numero di ossidazione del non metallo e degli atomi di idrogeno. Nell’esempio sopra riportato si hanno
ad esempio 3 atomi di ossigeno, la somma delle cui numeri di ossidazione è pari a −6, si hanno inoltre 2
atomi di idrogeno, la somma delle cui numeri di ossidazione è +2; la numero di ossidazione del carbonio
deve essere pertanto +4, come era del resto nella relativa anidride.
Per trovare la formula dell'ossoacido si deve scrivere a destra nell'ordine idrogeno, non metallo e
ossigeno, mettendo per ognuno di questi elementi tanti atomi quanti ce ne sono a sinistra.
Es. Cl2O7 + H2O H2Cl2O8
2 HClO4. Il composto H2Cl2O8 non esiste; per trovare la vera
formula dell'acido dobbiamo ricordare che negli ossiacidi il non metallo ha sempre 1 come indice, è
necessario quindi dividere tutti gli indici del composto intermedio per l’indice del non metallo, 2 in
questo caso, ed aggiungere davanti all'acido stesso un coefficiente stechiometrico pari al numero per cui
ho diviso.
In questo tipo di reazioni le anidridi si fanno reagire sempre con una sola molecola di acqua, fanno
eccezione quelle del boro e del fosforo, che reagiscono con tre molecole di acqua, e l'anidride silicica, che
reagisce con due molecole di acqua.
B2O3 + 3H2O H6 B2O6 2H3 B O3
P2O3 + 3H2O
H6 P2O6 2H3 P O3
P2O5 + 3H2O
H6 P2O8 2H3 P O4
Si O2 + 2H2O
H4 SiO4
Nomenclatura tradizionale
a) se il non metallo ha un solo numero di ossidazione: acido + nome non metallo terminante in ICO. Ad
esempio H2CO3 acido carbonico.
b) Se il non metallo ha 2 numeri di ossidazione: acido + nome non metallo terminante in ICO, per il
numero di ossidazione maggiore; acido + nome non metallo terminante in OSO, per il numero di
ossidazione minore. Ad es.
H2SO4 acido solforico (numero di ossidazione +6); H2SO3 acido
solforoso (numero di ossidazione +4).
c) se il non metallo ha quattro numeri di ossidazione, come avviene per gli elementi del 7° gruppo che
hanno numeri di ossidazione +1,+3,+5,+7, si hanno i seguenti quattro casi:
acido IPO nome non metallo terminante in OSO, per il numero di ossidazione +1. Es. HClO acido
ipocloroso
acido + nome non metallo terminante in OSO, per il numero di ossidazione +3. Es. HClO2 acido
cloroso
acido + nome non metallo terminante in ICO, per il numero di ossidazione +5. Es. HClO3 acido
clorico
acido PER nome non metallo terminante in ICO, per il numero di ossidazione +7. Es. HClO4 acido
perclorico
Nomenclatura ufficiale
Al temine acido si attribuisce un aggettivo, che contiene l’indicazione del numero di atomi di ossigeno
presenti nell’acido ed il nome del non metallo, terminante in ICO; a ciò si fa seguire poi, tra parentesi, il
numero di ossidazione del non metallo. Ad esempio: HClO acido ossoclorico (1) (in questo caso è
presente un solo atomo di ossigeno ed il prefisso mono si omette); HClO2 acido diossoclorico (3); HClO3
acido triossoclorico (5); HClO4 acido tetraossoclorico (7).
DECOMPOSIZIONE IN ACQUA DEGLI ACIDI
Tutti gli acidi fin qui elencati sono composti che contengono idrogeno; negli ossiacidi tale elemento
O
O
H
H
C
O
H2CO3
O
H
Cl
O
O
O
HClO4 6
Cl
H
HCl
S
H
H
H2S
composti1
è legato all’ossigeno da un legame covalente polare, mentre negli idracidi è legato da un legame covalente
polare ad un non metallo molto elettronegativo.
Quando questi composti vengono disciolti in acqua, l’acqua, che è un solvente polare, rompe il
legame tra ossigeno ed idrogeno, oppure tra idrogeno e non metallo, mandando in soluzione ioni H+ ed
anioni costituiti da tutti gli altri atomi della molecola di partenza.
Decomposizione in acqua degli acidi ternari
Negli acidi ternari gli anioni che vanno in soluzione sono anioni poliatomici, formati dal non
metallo ed dall’ossigeno legati da legame covalente, ed hanno tante cariche negative quanti sono gli ioni
H+che si liberano. Esempio:
HClO4
H++ ClO4H2CO3
2H++ CO32H3 B O3
3H++ B O33-
H4 S iO4
4H++ SiO44-
Anione
poliatomico
Acido ternario
Nomenclatura tradizionale degli anioni poliatomici
La nomenclatura tradizionale degli anioni
Ipo…….oso
Ipo……..ito
poliatomici, derivanti dalla dissociazione in acqua degli
acidi ternari, è simile a quella degli acidi di origine.
..…….oso
……….ito
Quando l’acido di origine ha desinenza ico, l’anione che ne
deriva avrà desinenza ato, mentre quando l’acido ha
……….ico
………ato
desinenza oso, l’anione derivante avrà desinenza ito. Per i
non metalli con 4 numeri di ossidazione si utilizzano inoltre
Per……..ico
Per…….ato
anche i prefissi ipo ed per, come per i relativi ossiacidi3.
Riassumiamo la situazione:
a) se il non metallo ha un solo numero di ossidazione: ione + nome non metallo terminante in ATO. Ad
2esempio CO3 ione carbonato.
b) Se il non metallo ha 2 numeri di ossidazione: ione + nome non metallo terminante in ATO, per il
numero di ossidazione maggiore; ione + nome non metallo terminante in ITO, per il numero di
22ossidazione minore. Ad es. SO4 ione solfato (numero di ossidazione +6); SO3 ione solfito (numero
di ossidazione +4).
c) se il non metallo ha quattro numeri di ossidazione, come avviene per gli elementi del 7° gruppo che
hanno numeri di ossidazione +1,+3,+5,+7, si hanno i seguenti quattro casi:
ione IPO nome non metallo terminante in ITO, per il numero di ossidazione +1. Es. ClO ione
ipoclorito
ione + nome non metallo terminante in ITO, per il numero di ossidazione +3. Es. ClO2 ione clorito
-
ione + nome non metallo terminante in ATO, per il numero di ossidazione +5. Es. ClO3 ione
clorato
ione PER nome non metallo terminante in ATO, per il numero di ossidazione +7. Es. ClO4 ione
perclorato
Nomenclatura ufficiale degli anioni poliatomici
Il nome dell’anione si ottiene precisando, coi soliti prefissi, il numero degli atomi di ossigeno
presenti, attribuendo la desinenza ato al nome del non metallo ed indicando tra parentesi il suo numero di
ossidazione. Ad esempio: ClO anione ossoclorato (1); ClO2 anione diossoclorato (3); . ClO3 anione
-
triossoclorato (5); ClO4 anione tetraossoclorato (7).
Decomposizione degli acidi binari
Negli acidi binari gli anioni che vanno in soluzione sono anioni monoatomici, formati dal non
metallo, ed hanno tante cariche negative quanti sono gli ioni H+che si liberano. Esempio:
3
Per ricordare la corrispondenza tra le desinenze si può tenere a mente la frase: Federico malato, valoroso e ferito.
7
composti1
2H++ S2HCl
H++ ClH2S
Nomenclatura degli anioni monoatomici
Sia la nomenclatura tradizionale, che quella ufficiale, stabiliscono che il nome dell’anione
monoatomico si ottiene aggiungendo la desinenza uro al nome del non metallo. Ad esempio F anione
-
-
-
2-
fluoruro; Cl anione cloruro; Br anione bromuro; I anione ioduro; S
seleniuro.
anione solfuro; Se
2-
anione
DECOMPOSIZIONE IN ACQUA DEGLI IDROSSIDI
Tutti gli idrossidi sono composti ionici; in acqua essi si dissociano liberando gli ioni OH- ed un
catione metallico con tante cariche positive quanti sono gli ioni OH- liberati.
Esempi: NaOH
Na++ OHCa(OH)2
Ca2++ 2OHPb4++ 4OHAl(OH)3
Al3++ 3OH- Pb(OH)4
SALI BINARI (METALLO + NON METALLO)
Sono composti ionici, che derivano dalla reazione tra acidi binari e idrossidi (idrossido + acido
binario
sale binario + acqua).
Per trovare la formula del sale binario che si forma dalla reazione tra un idrossido ed un acido
binario, si deve innanzi tutto scrivere le reazioni di decomposizione in acqua dei due composti. Facciamo
ad esempio reagire idrossido di sodio [Na(OH)] ed acido cloridrico [HCl]. Le reazioni di decomposizione
sono quelle indicate. Per trovare la formula del sale binario si unisce graficamente il catione metallico con
l’anione non metallico; unendo poi graficamente l’ossidrile con
+
Na(OH) Na + OH- lo ione H+ si trova l’acqua. In questo specifico esempio, dopo
che si sono trovate nel modo indicato le formule dei prodotti, non
HCl
H+ + Clsi deve fare altro, in quanto la reazione è già bilanciata. La
reazione totale è dunque:
Na(OH) + HCl
NaCl + H2O.
Ecco ora un caso più complesso, che si ottiene facendo reagire l’acido solfidrico (H2S) con l’idrossido
ferrico [Fe(OH)3]. Le reazioni di dissociazione sono quelle
H2S
2H+ + S2indicate. In questo caso le cose sono più complicate che
3+
nell’esempio
precedente, in quanto l’anione solfuro è bivalente,
Fe(OH)3 Fe + 3OH
mentre lo ione ferrico è trivalente ed il sale deve essere un
composto elettricamente neutro. Analogamente a quanto avveniva con i numeri di ossidazione, nella
regola della scrittura dei composti binari (vedi pag.2), anche in questo caso la somma delle cariche
positive dei cationi del ferro dovrà essere uguale alla somma delle cariche negative degli anioni dello
zolfo. E’ evidente che per soddisfare tale condizione sono necessari due ioni del ferro e tre dello zolfo.
Anche qui è possibile utilizzare una forma modificata della regola di Zaza, assegnando a ciascuno dei due
elementi un indice uguale al numero delle cariche ioniche dell’altro. Questo primo passaggio può essere
così riassunto:
Fe(OH)3+ H2S
Fe2S3+H2O
La reazione a questo punto non è però bilanciata, in quanto a destra si hanno 2 atomi d ferro e 3 di
zolfo, mentre a sinistra si ha un solo atomo di entrambi. Nel bilanciamento degli elementi si segue sempre
l’ordine seguente:
a) per primo si bilancia il metallo;
b) poi si bilancia il non metallo;
c) quindi si bilancia l’idrogeno;
d) a questo punto, se il bilanciamento è corretto, l’ossigeno deve essere già bilanciato. Se ciò non accade
vuol dire che si è sbagliato e si deve ricominciare da capo.
Nel nostro esempio i primi due passaggi si eseguono mettendo un 2 davanti all’idrossido ed un 3
davanti all’acido.
8
composti1
2Fe(OH)3+ 3H2S
Fe2S3+H2O
A questo punto abbiamo a sinistra 12 atomi di idrogeno, per bilanciare i quali sono necessarie a
destra 6 molecole di acqua.
2Fe(OH)3+ 3H2S
Fe2S3+6H2O
Adesso anche l’ossigeno è bilanciato, perché sia a sinistra che a destra ne abbiamo 6 atomi, ed il
bilanciamento è dunque corretto.
Nomenclatura tradizionale:
a) se il metallo ha una sola numero di ossidazione: nome non metallo terminante in URO + di nome
metallo (es. cloruro di sodio [NaCl], fluoruro di potassio [KF]);
b) se il metallo ha due numeri di ossidazione: nome non metallo terminante in URO + nome metallo
terminate in OSO, per il numero di ossidazione più basso; nome non metallo terminante in URO + nome
metallo terminate in ICO per il numero di ossidazione più alto. Ad es. FeCl2 cloruro ferroso (numero di
ossidazione +2); FeCl3 cloruro ferrico(numero di ossidazione +3)
Nomenclatura ufficiale
Si scrive prima il nome del non metallo, terminante in URO, poi si aggiunge di ed il nome del
metallo; ciascun nome viene preceduto dai soliti prefissi che indicano il numero di atomi presenti per
ciascun elemento. Ad esempio: FeCl2 dicloruro di ferro; FeCl3 tricloruro di ferro; NaCl cloruro di
sodio; Al2S3 trisolfuro di dialluminio. Li2S solfuro di dilitio.
SALI TERNARI (METALLO + NON METALLO + OSSIGENO)
Sono composti ionici, e pertanto solidi a temperatura ambiente, che derivano dalla reazione tra acidi
ternari e idrossidi (idrossido + acido ternario
sale
+ acqua).
Ca(OH)2 Ca2+ + 2OH- ternario
Anche in questo caso, per trovare la formula del
sale, si deve innanzi tutto scrivere le reazioni di
H3BO3 3H+ + BO33decomposizione in acqua dei due composti. Facciamo ad
esempio reagire idrossido di calcio [Ca(OH)2] ed acido borico [ H3BO3]. Le reazioni di decomposizione
sono quelle indicate sopra. Per trovare la formula del sale ternario ancora una volta si unisce graficamente
+
il catione metallico con l’anione non metallico; unendo poi graficamente l’ossidrile con lo ione H si
trova l’acqua. In questo specifico il catione è bivalente, mentre l’anione poliatomico e trivalente, per
ottenere quindi la formula del sale, che è elettricamente neutro, occorrono 3 cationi e due anioni. Anche
in questo caso è possibile utilizzare la forma modificata della regola di Zaza; nella formula del sale si
assegna dunque a ciascuno dei due ioni, un indice uguale al numero delle cariche ioniche dell’altro. La
Ca(OH)2 + H3BO3
Ca3(BO3)2 + H2O
reazione a questo punto diventa:
La reazione deve essere poi bilanciata, seguendo le solite regole. A destra si hanno 3 atomi di
calcio, per cui a sinistra si dovrà mettere un 3 davanti alla formula dell’idrossido; a destra si hanno inoltre
2 atomi di boro (il 2 alla sinistra della parentesi si comporta come tutti gli indici e moltiplica tutto ciò che
sta dentro alla parentesi), per cui a sinistra si dovrà mettere un 2 davanti alla formula dell’acido. Questi
passaggi si riassumono come segue:
3Ca(OH)2 + 2H3BO3
Ca3(BO3)2 + H2O
Dobbiamo infine bilanciare l’idrogeno, di cui a sinistra si hanno 12 atomi (6 dalle 3 molecole
dell’idrossido e 6 dalle 2 molecole dell’acido), a destra dovremo pertanto mettere un 6 davanti alla
formula dell’acqua.
9
composti1
3Ca(OH)2 + 2H3BO3
Ca3(BO3)2 + 6H2O
Anche l’ossigeno risulta bilanciato: a destra se ne hanno infatti 12 atomi (6 dalle 3 molecole
dell’idrossido e 6 dalle 2 molecole dell’acido) ed anche a destra ne abbiamo 12 (6 dalla molecola del sale
e 6 dalle molecole di acqua). Il bilanciamento è dunque correttamente concluso.
Nomenclatura tradizionale:
La nomenclatura di un sale ternario si ottiene indicando per primo il nome dell’anione poliatomico,
ricavabile dalla reazione di decomposizione in acqua dell’acido, e poi quello del catione metallico. Come
sempre, se il metallo ha un solo numero di ossidazione nel nome lo si indica con di + nome metallo,
mentre se il metallo ha due numeri di ossidazione di utilizzano le solite desinenze OSO, per il numero di
ossidazione minore ed ICO per il numero di ossidazione maggiore. Ecco alcuni esempi: CaCO3 carbonato
di calcio (il calcio ed il carbonio hanno un solo numero di ossidazione); FeCO3 carbonato ferroso e
Fe2(CO3)3 carbonato ferrico (il ferro ha due numeri di ossidazione); Na2SO4 solfato di sodio e Na2SO3
solfito di sodio (lo zolfo ha due numeri di ossidazione ed il sodio uno solo); Cu2SO4 solfato rameoso e
CuSO4 solfato rameico (sia zolfo che rame hanno due numeri di ossidazione); KClO ipoclorito di potassio
e KClO4 perclorato di potassio (il cloro ha quattro numeri di ossidazione ed il potassio solo uno);
Sn(BrO)2 ipobromito stannoso e Sn(BrO4)4 perbromato stannico (il bromo ha quattro numeri di
ossidazione e lo stagno due).
Nomenclatura ufficiale
Si scrive per primo il nome del non metallo, terminante in ATO, con l’indicazione, tra parentesi,
del suo numero di ossidazione; quindi si aggiunge di ed il nome del metallo, avendo cura di indicare, con
le solite desinenze, il numero di atomi di ossigeno presenti nell’anione ed il numero di atomi del metallo.
Ecco alcuni esempi:
CaCO3 triossocarbonato (4) di calcio; Fe2(CO3)3 triossocarbonato (4) di diferro¸ Na2SO4
tetraossosolfato (6) di disodio; Na2SO3 triossosolfato (4) di disodio.
Numeri di ossidazione dei metalli di transizione da usare negli
esercizi
Cromo
+2; +3; +6
Zinco
+2
Manganese
+2; +3; +6; +7
Oro
+1; +3
Ferro
+2; +3
Mercurio
+1; +2
Rame
+1; +2
Argento
+1
Nomi di composti particolari da usare nella nomenclatura
Azoto: nitroso e nitrico
Stagno: stannoso e stannico
Oro: auroso e aurico
Rame: rameoso e rameico
Mercurio: mercurioso e mercurico
10
composti1
COMPOSTO
NOMENCLATURA TRADIZIONALE
Un solo numero di ossidazione
Ossido di nome metallo
Due numeri di ossidazione
OSSIGENO +
Ossido
Ossido + metallo terminante in OSO
METALLO
(numero di ossidazione minore)
Ossido + metallo terminante in ICO
(numero di ossidazione maggiore)
Un solo numero di ossidazione
Anidride + nome non metallo in ICA
Due numeri di ossidazione
Anidride + nome non metallo in OSA (numero
di ossidazione minore)
OSSIGENO +
Anidride + nome non metallo in ICA (numero
Anidride
NON
di ossidazione maggiore)
METALLO
Quattro numeri di ossidazione
Anidride IPO nome non metallo in OSA (+1)
Anidride nome non metallo in OSA (+3)
Anidride nome non metallo in ICA (+5)
Anidride PER nome non metallo in ICA (+7)
IDROGENO
+
NON METALLO
F, Cl, Br, I (numero
Idracido
ACIDO + nome non metallo in IDRICO
di ossidazione +1)
S, Se (numero di
ossidazione +2)
Un solo numero di ossidazione
Idrossido di nome metallo
Due numeri di ossidazione
GRUPPO OH +
Idrossido
Idrossido + metallo terminante in OSO
METALLO
(numero di ossidazione minore)
Idrossido + metallo terminante in ICO
(numero di ossidazione maggiore)
Un solo numero di ossidazione
Acido + nome non metallo in ICO
Due numeri di ossidazione
Acido + nome non metallo in OSO
(numero di ossidazione minore)
IDROGENO
Acido + nome non metallo in ICO
+ NON
Ossiacido
(numero di ossidazione maggiore)
METALLO +
OSSIGENO
Quattro numeri di ossidazione
Acido IPO nome non metallo in OSO (+1)
Acido nome non metallo in OSO (+3)
Acido nome non metallo in ICO (+5)
Acido PER nome non metallo in ICO (+7)
11
IUPAC
Ossido
+
nome
metallo con prefissi a
seconda del numero
di atomi dei vari
elementi
Ossido + nome non
metallo con prefissi a
seconda del numero
di atomi dei vari
elementi
Idruro
Nome non metallo in
URO
+
di
IDROGENO
(con
prefissi)
Idrossido + prefissi a
seconda del numero
di gruppi OH + di
nome metallo
ACIDO + prefisso a
seconda del numero
di atomi di ossigeno
+ OSSI + nome non
metallo in ICO
(+
numero
di
ossidazione)
composti1
SUGGERIMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI
1) Data la formula di un sale ternario trovarne il nome tradizionale
Formula
n° di ossidazione
nome
Il primo passaggio da compiere è quello di ricavare il numero di ossidazione del non metallo e del
metallo; in proposito dobbiamo ricordare che i sali sono composti ionici, dati dall’unione di un catione
metallico monoatomico e di un anione poliatomico contenente un non metallo. Proviamo quindi a fare la
dissociazione in acqua del sale, ricordando che il prodotto della carica ionica del metallo, moltiplicato
per il suo indice stechiometrico, è uguale al prodotto della carica ionica dell’anione, moltiplicato per il
suo indice stechiometrico complessivo, dove tutti i numeri si considerano in valore assoluto.
1)
Carica ionica del metallo
X
indice stechiometrico del metallo
Carica ionica dell’anione poliatomico
X
indice stechiometrico dell’anione poliatomico
=
Esempio: Fe2(CO3)3
2Fe3+ + 3 CO32–
in questo caso l’espressione diventa:
Carica ionica del
ferro
(3x2) = (2x3)
Indice stechiometrico
del ferro
Indice
stechiometrico
dell’anione
Carica
dell’anione
2) Per calcolare il numero di ossidazione del metallo basta dire che esso corrisponde alla carica del
catione (nell’esempio la numero di ossidazione del ferro è infatti +3).
3) Per calcolare invece il numero di ossidazione del non metallo dobbiamo fare un calcolo ulteriore
(vedi regole di pag. 2), che consiste nel moltiplicare per due il numero di atomi dell’ossigeno presenti
nell’anione poliatomico e sottrarre a tale numero il valore della carica dell’anione medesimo.
Nell’esempio di CO32– per calcolare il numero di ossidazione del carbonio dobbiamo fare:
Numero atomi
di ossigeno
(3x2) –2= 4.
Numero di
ossidazione
ossigeno
Carica
anione
Numero di
ossidazione
carbonio
Abbiamo quindi i seguenti casi:
a) Il metallo ed il non metallo hanno un solo numero di ossidazione: in questo caso non ci sono
problemi e il numero di ossidazione del metallo e del non metallo saranno solo quelli che
rispettivamente gli competono. Prendiamo come esempio CaCO3: il calcio ha solo numero di
ossidazione +2, mentre il carbonio ha solo numero di ossidazione +4. Questi saranno pertanto i
rispettivi numeri di ossidazione dei due elementi e, in base alle regole sulla nomenclatura dei sali
ternari, il composto si chiamerà carbonato di calcio.
b) Il metallo ha un solo numero di ossidazione, mentre il non metallo ne ha più di uno: il numero di
ossidazione e la carica ionica del metallo, per quanto abbiamo detto sopra, coincidono e quindi
possono immediatamente sapere la carica ionica del metallo medesimo. Dall’uguaglianza 1) posso
quindi ricavarmi il numero di ossidazione del non metallo ed arrivare così a determinare il nome del
composto. Prendiamo come esempio NaNO3: il sodio, essendo del primo gruppo, può avere solo
numero di ossidazione +1; la decomposizione del sale sarà quindi: NaNO3 Na+ + NO3–. Da quanto
abbiamo detto al precedente punto 2), il numero di ossidazione dell’azoto risulta da:
Numero atomi
di ossigeno
(3x2)–1=5.
Numero di
ossidazione
ossigeno
12
Carica
anione
Numero
di
ossidazione
carbonio
composti1
Il composto si chiamerà dunque nitrato di sodio.
c) Il non metallo ha un solo numero di ossidazione, mentre il metallo ne ha più di uno: questo è il caso
opposto al precedente. Nota il numero di ossidazione del non metallo, mi ricava la carica dell’anione
poliatomico utilizzando la regola 3); applicando poi l’uguaglianza 1) arrivo a poter scrivere la
dissociazione del sale ed a ricavare il numero di ossidazione del metallo. Prendiamo ad esempio il
caso di FeCO3; il carbonio ha solo numero di ossidazione +4 ed applicando in modo inverso la regola
3) ottengo la carica dell’anione dal calcolo seguente:
Numero atomi
di ossigeno
(3x2) – 4=2
Carica anione
Numero di
ossidazione
carbonio
Numero di
ossidazione
ossigeno
La dissociazione del sale pertanto sarà FeCO3 Fe2+ + CO32– e il numero di ossidazione del ferro,
per la regola 2), è +2. Il nome del sale conseguentemente è carbonato ferroso.
d) Sia il metallo, che il non metallo, hanno più di un numero di ossidazione: in questo caso si deve
procedere per tentativi, utilizzando le tre regole date in precedenza, senza dimenticare che il numero
dei valori assunti dal numero di ossidazione di ogni elemento è limitato (massimo due per i metalli,
massimo quattro per i non metalli del 7° gruppo).
Consideriamo ad esempio Fe(ClO4)3. Il ferro può avere solo numero di ossidazione +2 oppure numero di
ossidazione +3; ipotizziamo che, in questo caso, il ferro abbia numero di ossidazione +2 e quindi sia
presente nel sale sotto forma di ione Fe2+, applichiamo quindi la relazione 1) che diventa:
Carica ipotetica del ferro
(2x1) = (2/3x3)
Indice stechiometrico
del ferro
Indice stechiometrico
dell’anione
Carica ipotetica
dell’anione
Da ciò si vede l’ipotesi è sbagliata, in quanto le cariche ioniche debbono essere sempre quantità intere.
Riproviamo quindi ipotizzando stavolta che la numero di ossidazione del ferro sia +3 e che quindi tale
elemento sia presente nel sale sotto forma di catione Fe3+. In questo caso la uguaglianza 1) diventa:
Carica ipotetica del ferro
(3x1) = (1x3)
Indice stechiometrico
del ferro
Indice stechiometrico
dell’anione
Carica ipotetica
dell’anione
In questo l’ipotesi è corretta e la dissociazione del sale sarà quindi: Fe(ClO4)3
Applichiamo quindi la regola 3) all’anione ClO4–:
Numero atomi
di ossigeno
(4x2) – 1=7
Numero di
ossidazione
ossigeno
Carica
anione
Fe3+ + ClO4–.
Numero
di
ossidazione
cloro
Il sale si chiama quindi perclorato ferrico.
2) Dato il nome tradizionale di un sale ternario trovarne la formula
Nome
numero di ossidazione
Formula
In questo caso le cose sono relativamente semplici, perché dal nome è sempre possibile ricavare
univocamente i numeri di ossidazione del metallo e del non metallo. Prendiamo ad esempio il solfato
rameico: le desinenze dei nomi dei due elementi ci dicono che lo zolfo ha il suo numero di ossidazione
massimo (+6), così come il rame (+2). A questo punto diventa però difficile scrivere direttamente la
13
composti1
formula del sale, dobbiamo prima infatti scrivere la formula dell’acido ternario e dell’idrossido da cui
esso deriva, che, rispettivamente, sono: acido solforico e idrossido rameico. La scrittura della formula
dell’idrossido non presenta grosse difficoltà: basta infatti ricordare che il gruppo ossidrile si comporta
come se avesse numero di ossidazione +1. Applicando quindi la regola del prodotto in croce si arriva a
scrivere Cu(OH)2. Più complesso è invece scrivere direttamente la formula dell’acido ternario, conviene
infatti risalire alla relativa anidride e far successivamente reagire quest’ultima con l’acqua. Dalla regola
del prodotto in croce ricaviamo che la formula dell’anidride solforica è SO3, facendola successivamente
reagire con l’acqua, secondo le note regole, ricaviamo che la formula dell’acido solforico è H2SO4. Infine,
dalla reazione tra l’acido e l’idrossido, i cui passaggi saltiamo per brevità, risulta che la formula del sale
in esame è: Cu SO4.
3) Dato il nome ufficiale di un sale ternario trovarne la formula
Proviamo a scrivere la formula del triossonitrato (5) di ferro (3). L’anione contiene tre atomi di
ossigeno ed uno di azoto con numero di ossidazione +5. Con le regole già viste nella pagina precedente
possiamo calcolare la carica dell’anione
Numero atomi
di ossigeno
(3 x 2) +5 = 1
Numero
di
ossidazione
ossigeno
Carica anione
Numero di
ossidazione azoto
La formula dell’anione è quindi NO3 . Poiché il ferro ha numero di ossidazione +3, il catione
metallico è Fe3+. La formula del composto è pertanto Fe(NO3)3
14
I
Numero
atomico
1
H
II
2
Be
Peso
atomico
K
+1
39,10
6
5
9
Be
B
C
N
O
+2
+3
10,81
F
-1
12
magnesio
13
alluminio
Mg
+2
24,30
26
Ca
+2
40,08
29
ferro
Fe
+2, +3
55,85
zinco
Cu
Zn
+1, +2
63,55
5
+4, -4
12,01
16
fosforo
zolfo
Al
Si
P
S
+3
26,98
+4
28,09
33
arsenico
As
±3, +5
74,92
+2
65,38
argento
stagno
51
antimonio
Ag
Sn
Sb
+1
107,87
+2, +4
118,69
80
oro
Au
+1, +3
196,97
82
mercurio
Hg
+1, +2
200,59
Pb
+2, +4
207,2
Ne
20,18
cloro
Cl
18
argon
Ar
±1, +3, +5,
-2, +4, +6
+7
32,06
35,45
39,95
35
34
selenio
bromo
Br
36
cripton
Se
±1, +3, +5, Kr
-2, +4, +6
+7
83,80
78,96
+3, +5
121,75
83
piombo
neon
17
16
±3, +5
30,97
10
19,00
16,00
silicio
50
79
-2
±3, +5
14,00
15
30
rame
47
6
8
7
fluoro
calcio
He
4,00
ossigeno
20
elio
VII
9,01
9,01
+1
22,99
VI
azoto
+1
Na
V
carbonio
Li
19
potassio
Simbolo
IV
boro
berillio
sodio
III
+2
4
litio
11
4
2
berillio
Numeri di
ossidazione
6,94
3
Nome
-
+1, -1
1,00
3
VIII
4
idrogeno
1
legenda
bismuto
Bi
+3, +5
208,98
7
NUMERI DI OSSIDAZIONE DA UTILIZZARE NELLO SVOLGIMENTO DEGLI ESERCIZI
79,90
53
iodio
I
±1, +3, +5,
+7
126,90
54
xeno
Xe
131,29
86
radon
Rn
222