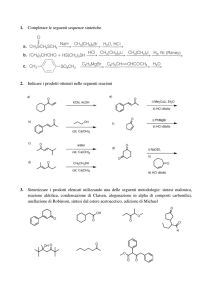
CHIMICA ACIDOACIDO-BASE DI COMPOSTI CARBONILICI
Acidità: Acidità di acidi, ammidi, ammine. Effetti induttivi e di
risonanza. Acidità CH
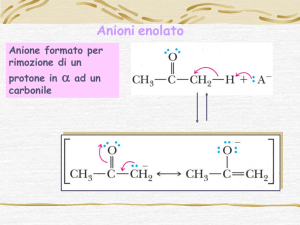
Enoli/enolati
Enoli/
enolati
Tautomeria cheto enolica (acido o base catalizzata)
(isomerizzazioni zuccheri, racemizzazioni)
AlfaAlfa
-alogenazioni (sintesi aloformio)
aloformio)
Sintesi enolati di chetoni con basi forti: (regiochimica)
regiochimica)
Alchilazione enolati (alogenuro alchilico)
Enolati di aldeidi, esteri, nitrili, acidi
Enolati di derivati con metileni attivati
Eliminazione di CO2, equivalente sintetico, enolato equivalente
CONDENSAZIONI ALDOLICHE
Addizioni Nucleofile di Enolati a Composti Carbonilici:
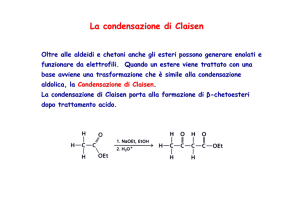
Condensazione Aldolica o Condensazione di Claisen
Condensazioni aldoliche base catalizzate: meccanismo di
eliminazione unimolecolare, base coniugata (E1cb) nella
deidratazione del prodotto di una condensazione aldolica
Meccanismi di eliminazione E1 e E2
Condensazione aldolica acido catalizzata
Retroaldolica
Condensazione aldolica di chetoni
Condensazione aldolica mista: aldeidi/chetoni non enolizzabili
Condensazione aldolica catalizzata da acidi di Lewis
Condensazione aldolica con enolati di esteri
FruttosioFruttosio
-1,6
1,6-difosfato aldolasi (FDP
(FDP-aldolasi)
1
Stereoselettività, Stereospecificità, Relazioni di Isomeria
Unità stereogeniche
Descrittori di unità stereogeniche
La condensazione di Claisen (sintesi di β-cheto esteri)
Bassa concentrazione di enolato, 1 equiv. di base
RetroRetro
-Claisen
(beta-cheto esteri ciclici))
Ciclizzazione di Dieckmann ((betaCondensazione di Claisen Mista
Reazione di Knoevenagel: nucleofilo: metilene attivato
Reazione di Henry: nucleofilo: nitroalcano
Reazione di Perkin: nucleofilo: anidride di un acido
Reazione di Danzen: nucleofilo estere di un acido α-alocarbossilico
2
L’ addizione coniugata
Sintesi di sistemi carbonilici α,β-insaturi:
Eliminazione del gruppo in α al carbonile
Formazione enolati e utilizzo di fenil selenio o fenilsolfuro derivati
Eliminazione del gruppo in β al carbonile
Condensazione aldolica
Riduzione di un β-cheto estere
Reazione di Mannich
L’ addizione coniugata
AddizioneAddizione
-1,2 verso addizioneaddizione-1,4
Addizione coniugata di acqua
Addizione di HCN
addizione di ammine
addizione di alcoli e tioli
addizione di idroperossidi
La reazione di Michael (addizione di un enolato)
Addizione tandem (enolato + agente alchilante, stereochimica)
Polimerizzazioni anioniche
L’annullazione di Robinson
3
AddizioneAddizione
-1,2 verso addizioneaddizione-1,4
Litio alchili/Grignard
Organo Cuprati
Addizioni di idruro (NaBH4 e CeCl3; AlH3 e DIBAL,
DIBAL [(Ph3P)CuH]6 )
Addizioni di elettroni
Eterocicli saturi
Nomenclatura degli eterocicli saturi
Eterocicli saturi: cicli a 3,4,5 e 6 atomi
Eterocicli a 3 atomi; apertura ad opera di nucleofili:
stereochimica
Eterocicli a 4 atomi
Eterocicli a 5/6 atomi: basicitò pirrolidina, pirazina e
morfolina
La reazione di BaylisBaylis-Hillmann (Michael Addition catalizzata
dal DABCO)
1,31,3
-ditiani (acil anioni equivalenti) - Umpolung della
reattività
4
Eterocicli aromatici
Piridina:
Basicità/nucleofilicità
Legante (cromo; osmio)
Difficili sostituzioni elettrofile aromatiche (anello elettronelettronpovero, azoto nucleofilo. Reattività più elevata meglio in
presenza di sostituenti elettronelettron-donatori - posizione 3 più
attivata
Buona reattività nei confronti dei nucleofili: analogia con
derivati carbonilici e sistemi alfa,beta coniugati.
Sostituzione con specie organometalliche e basi forti.
forti
NAD+/NADH
Diazine: basi più deboli: meno reattive nei confronti di
elettrofili e più reattive nei confronti di nucleofili. Diazine
come leganti chirali
Eterocicli aromatici
Chinolina e isochinolina:
Confronto con naftalene. Sostituzioni con elettrofili.
Pirrolo: sintesi di porfirine. sostituzione in 2
Tiofene e furano: aromaticità: reattività come diene vs sistema
aromatico
Indolo: confronto con il pirrolo, sostituzione in 3. Triptofano.
Benzotiofene; benzofurano.
benzofurano
Azoli: imidazolo. Basicità; acidità. Regiochimica; reattività:
sostituzioni elettrofiliche aromatiche, generazione di carbanioni.
5