Corso di laurea in Scienze Biologiche
Corso di Chimica Organica e Laboratorio
Docente: Prof. Daniela Montesarchio
Esperienza:
REAZIONE DI CARBANIONI
COMPOSTI CARBONILICI
DERIVANTI
DA
Scopo della presente esperienza è la preparazione del dibenzalacetone, ottenuto mediante una reazione
di condensazione aldolica incrociata fra la benzaldeide e l'acetone. Il prodotto della reazione è
purificato per cristallizzazione; il grado di purezza del campione ottenuto è controllato mediante TLC.
LA CONDENSAZIONE ALDOLICA INCROCIATA
PREPARAZIONE DEL
dibenzalacetone
Premesse Teoriche
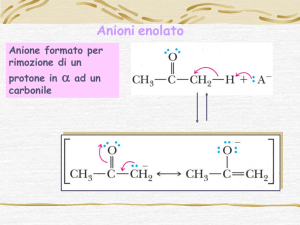
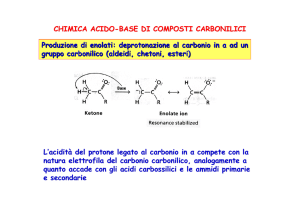
Il protone (o i protoni) legati ad un atomo di carbonio in ad un carbonile (sia esso di
un’aldeide o di un chetone) sono relativamente acidi, per cui il trattamento con una base
forte porta alla formazione di uno ione enolato, stabilizzato per risonanza. Tipicamente,
uno ione enolato, oltre a comportarsi da base, può funzionare da nucleofilo.
La formazione di ioni enolato a partire da un composto carbonilico richiede l'uso di una
base forte.
O
O
Ka
C
R
-
H+
(aq)
CH3
+
C
R
CH2
Ione enolato
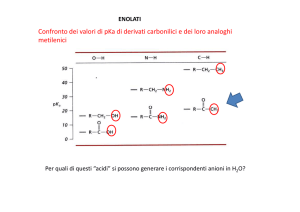
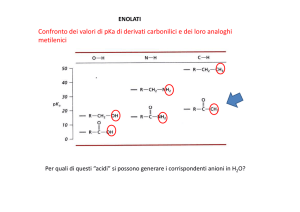
Sperimentalmente i valori di pK a per l’estrazione di un protone da carboni in all'atomo di
carbonio carbonilico di aldeidi e chetoni sono compresi nell'intervallo 18-20: si tratta di
valori notevolmente bassi in confronto ai corrispondenti valori di pK a degli idrocarburi
saturi, che sono mediamente maggiori di 50.
Il fortissimo effetto acidificante del gruppo carbonilico è principalmente legato alla sua
abilità nel delocalizzare, e quindi stabilizzare, la carica negativa presente sullo ione
enolato, che può essere descritto come un ibrido fra le seguenti due strutture limite di
risonanza:
O
C
R
O
-
CH2
C
R
CH2
Poiché i valori di pK a per l’estrazione di un protone da carboni in all'atomo di carbonio
carbonilico di aldeidi e chetoni non sono molto superiori a quelli dell'acqua (pK a = 15,7) e
degli alcoli (pK a = 16-18), è possibile generare all’equilibrio una percentuale apprezzabile
di ioni enolato anche utilizzando basi non eccezionalmente forti, come ioni idrossido (OH-)
o alcossido (RO-).
Una importante reazione degli ioni enolato è l'addizione nucleofila all'atomo di carbonio
carbonilico elettrofilo dell'aldeide o del chetone dai quali si origina l'enolato. In tal modo si
ottiene un anione dimerico che può essere successivamente neutralizzato e quindi
formare un composto -idrossicarbonilico. Se la reazione è eseguita in solventi protici
quali l'acqua o un alcol, la fonte di protoni può essere il solvente, la cui deprotonazione
rigenera la base richiesta per formare l'anione enolato. Il processo globale è pertanto
catalitico rispetto alla base impiegata.
O
-
O
C
R
C
CH2
R
O
CH2
+
O
ROH
C
R
OH
C
C
CH3
R
C
H
R
CH3
H
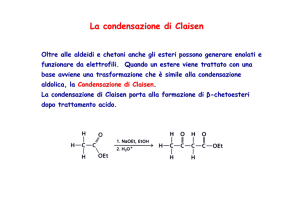
Il composto -idrossicarbonilico è detto aldolo. Non sempre è possibile isolare simili
prodotti di addizione, e ciò dipende fortemente dalle condizioni di reazione scelte. Se
l'aldolo presenta ancora un atomo di idrogeno sul carbonio a caldo può infatti verificarsi
spontaneamente una reazione di disidratazione (eliminazione di una molecola di acqua)
O
OH
C
C
R
C
H
R
CH3
-OR
R
H
O
R
C
C
C
+ ROH + HOCH3
H
con formazione di un composto carbonilico -insaturo.
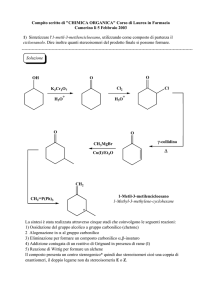
La reazione complessiva, descritta precedentemente, è detta condensazione aldolica.
Se i reagenti sono due composti carbonilici diversi la reazione è indicata come
condensazione aldolica incrociata.
Un esempio è la reazione di doppia condensazione alcolica incrociata dell'acetone con la
benzaldeide per dare il dibenzalacetone secondo lo schema qui descritto:
O
O
O
OH-
+
H
2 eq
H3C
CH3
1 eq
CH3CH2OH
Materiale occorrente:
1 beuta codata da vuoto da 250/500 mL
1 beuta da 50 mL
1 imbuto Büchner
1 filtro di carta
1 pipetta graduata da 5 mL
capillari
1 vaschetta cromatografica
1 lastrina TLC
benzaldeide
acetone
etanolo 95%
idrossido di sodio (soluzione al 10% in H 2 O)
etere di petrolio 40-60
etere dietilico
carta da filtro
pompa da vuoto a membrana
Parafilm
Esecuzione:
Introdurre 1.5 mL (pari a 15 mmol) di benzaldeide e 0.5 mL (pari a 7.0 mmol) di
acetone in una beuta da 50 mL.
Aggiungere 10 mL di etanolo al 95% ed agitare la beuta per mescolare i
reagenti.
Aggiungere alla soluzione 15 mL di NaOH (soluzione in H 2 O al 10 % in peso).
Agitare la beuta per facilitare il mescolamento dei reagenti.
Sigillare la beuta con una striscetta di Parafilm.
Lasciare che la soluzione riposi, a temperatura ambiente, per circa 10 minuti, o
comunque fino a comparsa di un precipitato cristallino giallo.
O
O
H
O
H3 C
CH3
NaOH EtOH
Aiutandosi con una spatola, trasferire il precipitato in un imbuto di Büchner,
recante sul fondo un filtro di carta preparato in precedenza, e filtrare sotto
vuoto.
Lavare i cristalli con pochi millilitri di etanolo freddo e farli asciugare all'aria.
Prelevare una piccola aliquota di materiale cristallino, trasferirlo in una
provetta di vetro e discioglierlo in circa 2 mL di cloroformio (CHCl 3 ).
Con la matita, tracciare delicatamente sulla TLC, facendo attenzione a non
staccare la silice dal supporto in vetro, una linea parallela al lato più stretto e
distante 1-2 centimetri dal bordo. Sempre con la matita tracciare tre piccoli
segni (tre “x”, per esempio), sulla linea già tracciata, dove in sequenza caricate
con un capillare:
A) Il prodotto della reazione.
B) La benzaldeide.
C) Sia il prodotto della reazione sia la benzaldeide (miscela).
Attendere alcuni secondi affinchè il solvente utilizzato per il caricamento
evapori. Nel frattempo aggiungere nella camera di sviluppo una piccola quantità
(circa 10 mL) del sistema eluente: cloruro di metilene (CH 2 Cl 2 ) - etere di
petrolio in rapporto 4:1 (v/v).
Inserire la lastrina all’interno della camera di sviluppo verticalmente, con il
bordo dove sono stati caricati i campioni rivolto verso il basso, fino ad adagiarla
sul fondo in modo che l’eluente, per capillarità, cominci a salire sulla lastra.
Quando il fronte dell’eluente raggiunge circa 1 o 2 cm dal bordo superiore
aprire il barattolo, prelevare la lastrina e, con la matita, segnare rapidamente
(tracciando una linea) il fronte raggiunto dall’eluente prima che questo evapori.
Attendere l’evaporazione dell’eluente e poi esporre la TLC alla lampada UV.
Segnare con la matita i bordi esterni delle macchie visibili.
Fronte
L' Rf è il rapporto
tra la distanza percorsa
dalla sostanza ed la distanza
raggiunta dal fronte
b
Rf = a/b
a
A = Dibenzalacetone
B = Benzaldeide
C = Miscela di A + B
A B C
Linea dove si effettua il caricamento
il livello dell'eluente non deve superare questo punto
Per la relazione finale:
Calcolate gli R f dei composti iniziale e finale (e di eventuali composti
intermedi).
Commentare,
sulla
base
dell’analisi
TLC
della
miscela
di
reazione,
l’andamento della reazione ed il grado di purezza del prodotto ottenuto.