I LEGAMI CHIMICI
I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno.
1.
LEGAME IONICO
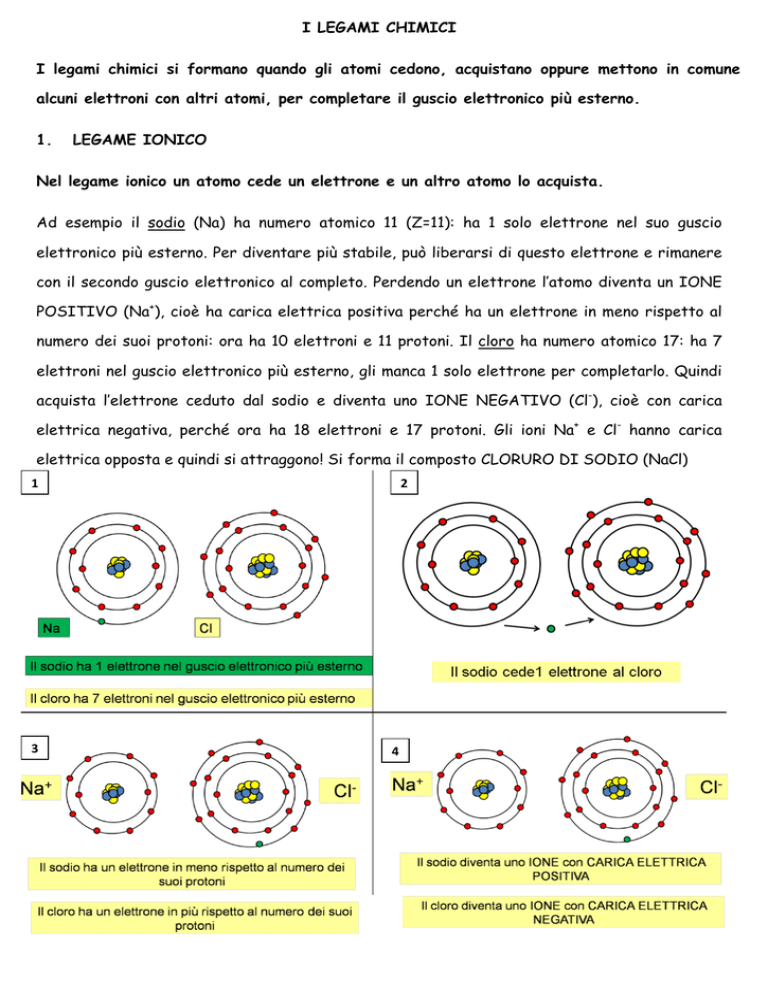
Nel legame ionico un atomo cede un elettrone e un altro atomo lo acquista.
Ad esempio il sodio (Na) ha numero atomico 11 (Z=11): ha 1 solo elettrone nel suo guscio
elettronico più esterno. Per diventare più stabile, può liberarsi di questo elettrone e rimanere
con il secondo guscio elettronico al completo. Perdendo un elettrone l’atomo diventa un IONE
POSITIVO (Na+), cioè ha carica elettrica positiva perché ha un elettrone in meno rispetto al
numero dei suoi protoni: ora ha 10 elettroni e 11 protoni. Il cloro ha numero atomico 17: ha 7
elettroni nel guscio elettronico più esterno, gli manca 1 solo elettrone per completarlo. Quindi
acquista l’elettrone ceduto dal sodio e diventa uno IONE NEGATIVO (Cl-), cioè con carica
elettrica negativa, perché ora ha 18 elettroni e 17 protoni. Gli ioni Na+ e Cl- hanno carica
elettrica opposta e quindi si attraggono! Si forma il composto CLORURO DI SODIO (NaCl)
1
3
2
4
2.
LEGAME COVALENTE
Nel legame covalente gli atomi mettono in comune alcuni elettroni del loro guscio
elettronico più esterno.
Ad esempio l’ossigeno (O) ha numero atomico 8 (Z=8), quindi ha 2 elettroni nel primo guscio e 6
elettroni nel secondo. Per completare il guscio elettronico più esterno ha bisogno di altri due
elettroni.
L’idrogeno ha numero atomico 1 (Z=1), quindi ha un solo elettrone nel suo unico guscio
elettronico. Per completarlo ha bisogno di un altro elettrone (il primo guscio elettronico può
contenere al massimo due elettroni).
Ecco che si forma la molecola di acqua: un atomo di ossigeno mette in comune due elettroni con
due atomi di idrogeno, i quali a loro volte mettono in comune il loro elettrone. “Mettere in
comune” significa che gli elettroni condivisi ruotano “per un po’ di tempo intorno al nucleo
dell’ossigeno e per un po’ intorno ai nuclei degli atomi di idrogeno.
1
2
3
3.
LEGAME METALLICO
I metalli tendono a cedere i loro elettroni più esterni,
diventando così ioni positivi.
Gli elettroni hanno molta libertà di movimento e formano una
nuvola di elettroni intorno agli ioni.
Si chiama legame metallico l’attrazione elettrica che tiene
insieme gli ioni positivi e la nube di elettroni.
I metalli sono buoni conduttori della corrente elettrica proprio per la presenza di questi
elettroni molto mobili.
La valenza è il numero di elettroni che un atomo mette in gioco per completare il proprio guscio
elettronico più esterno.
Es. ossigeno: ha valenza 2 perché tende ad acquistare 2 elettroni
Es. carbonio: ha valenza 4 perché tende ad acquistare 4 elettroni
Es. sodio: ha valenza 1 perché tende a cedere 1 elettrone
I gas nobili o inerti hanno valenza zero, perché non acquistano né cedono elettroni: non
formano legami chimici perché il loro guscio elettronico più esterno è completo.
LE REAZIONI CHIMICHE
Una reazione chimica è un processo in cui partendo da alcune sostanze, I REAGENTI, se
ne ottengono altre, I PRODOTTI, diverse da quelle di partenza.
Le reazioni possono essere:
•
Esotermiche: una reazione esotermica libera energia (ad esempio tutte le combustioni)
•
Endotermiche: una reazione endotermica ha bisogno di energia per avvenire (sottrae
energia all’ambiente). Ad esempio la fotosintesi è una reazione endotermica, per avvenire ha
bisogno dell’energia luminosa del sole:
6 H 2 O + 6 CO 2 + ENERGIA LUMINOSA
REAGENTI
C 6 H 12 O 6 + 6 O 2
PRODOTTI
Le reazioni chimiche non avvengono tutte alla stessa velocità, vi sono reazioni lente, altre sono
più veloci, altre sono velocissime, cioè esplosive.
Negli esseri viventi ci sono speciali proteine chiamate enzimi che fanno aumentare la velocità
delle reazioni chimiche che avvengono nelle cellule e che sono indispensabili per la vita.
LE LEGGI FONDAMENTALI DELLA REAZIONI CHIMICHE
Tra il Settecento e l’Ottocento, grazie a numerosi studiosi francesi e inglesi, tra cui Lavoisier,
Proust e Dalton, vengono individuate le leggi fondamentali che regolano le reazioni chimiche.
Legge di Lavoisier: “In una reazione chimica nulla si crea e nulla si distrugge”
Legge di Proust: “Le quantità dei diversi elementi che si combinano a formare un dato composto
stanno sempre tra loro in una proporzione ben precisa e fissa”
Il chimico inglese John Dalton spiega queste affermazioni formulando meglio la TEORIA
ATOMICA: afferma che la materia è fatta da tantissime particelle indivisibili, gli ATOMI, che
sono tipici di ciascun elemento chimico. Dalton riformula le leggi di Lavoisier e Proust in questo
modo:
La legge di Lavoisier: “In una reazione chimica nulla si crea e nulla si distrugge”
per Dalton diventa:
“ Nelle reazioni chimiche gli atomi non scompaiono e non si creano dal nulla: essi passano
soltanto da un composto ad un altro.”
La legge di Proust: “Le quantità dei diversi elementi che si combinano a formare un dato
composto stanno sempre tra loro in una proporzione ben precisa e fissa”
per Dalton diventa:
“Ogni molecola di un dato composto è sempre formata dallo stesso numero di atomi dei diversi
elementi che lo compongono.”
L’OSSIGENO E I SUOI COMPOSTI
L’ossigeno è l’elemento più abbondante sulla terra: è presente nell’aria, nell’acqua, nelle rocce,
negli esseri viventi. È un elemento molto reattivo e si combina facilmente con molti elementi
attraverso reazioni chiamate ossidazioni.
1. LE OSSIDAZIONI
Quando l’ossigeno si lega con un metallo (la maggior parte degli elementi della tavola periodica)
si forma un OSSIDO BASICO.
metallo + ossigeno
ossido basico
Es. il ferro se viene esposto all’aria arrugginisce: la ruggine è l’ossido di ferro (FeO), il
composto che si forma quando gli atomi del ferro si legano agli atomi dell’ossigeno dell’aria.
Gli ossidi basici sono solidi e se sciolti nell’acqua formano composti chiamati BASI.
Quando l’ossigeno si lega con un non metallo si forma un OSSIDO ACIDO o ANIDRIDE.
non metallo + ossigeno
ossido acido
Es. l’anidride carbonica è un ossido acido (CO 2 )
Gli ossidi acidi sono generalmente gassosi e se sciolti nell’acqua formano composti chiamati
ACIDI.
2. LE COMBUSTIONI
Si chiamano combustioni tutte le reazioni in cui si ha ossigeno tra i reagenti e anidride
carbonica tra i prodotti.
Es. la carta per bruciare ha bisogno di un po’ di calore iniziale e di ossigeno. La parte della
carta che brucia è la cellulosa (C 6 H 10 O 5 ), il resto rimane dopo la reazione sotto forma di
cenere. La cellulosa reagisce con l’ossigeno dell’aria, producendo anidride carbonica (CO 2 ) e
vapore acqueo (H 2 O), che formano il fumo. Questa reazione libera moltissimo calore che rende
incandescente il fumo, creando la fiamma. Per avviare una combustione è necessaria un po’ di
energia chiamata energia di attivazione.












