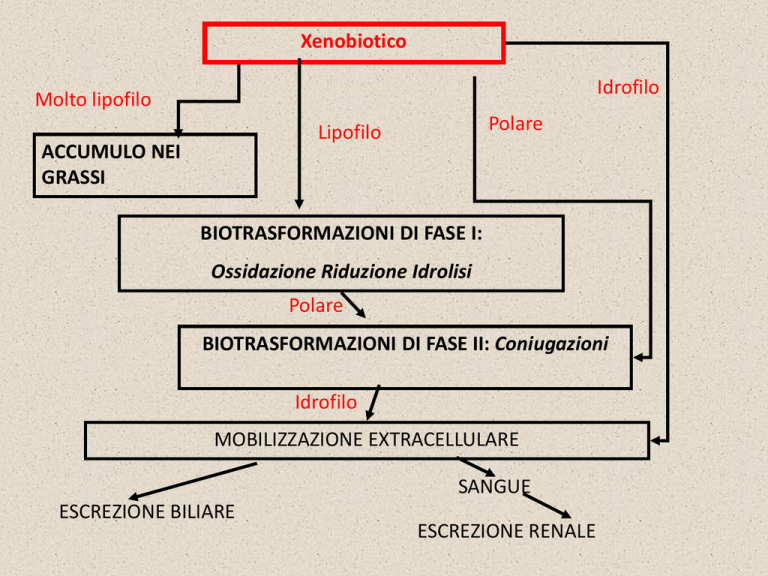
Xenobiotico
Idrofilo
Molto lipofilo
Polare
Lipofilo
ACCUMULO NEI
GRASSI
BIOTRASFORMAZIONI DI FASE I:
Ossidazione Riduzione Idrolisi
Polare
BIOTRASFORMAZIONI DI FASE II: Coniugazioni
Idrofilo
MOBILIZZAZIONE EXTRACELLULARE
SANGUE
ESCREZIONE BILIARE
ESCREZIONE RENALE
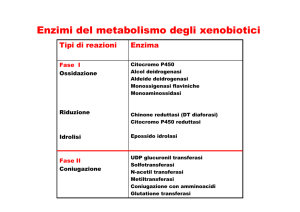
Processi enzimatici di biotrasformazione
• Processi di fase I
Processi di fase II (di solito
(aumentano la polarità):
aumentano la solubilità in acqua):
– Ossidazioni
– Riduzioni
– Idrolisi
• Coniugazioni con:
– Acido glucuronico
– Solfato
– Glutatione
– Amino acidi
• Acetilazione
• Metilazione
L’espressione di enzimi che metabolizzano gli xenobiotici è diversa tra i
tessuti.
La loro localizzazione è principalmente nel fegato o in analoghe
ghiandole ma sono presenti anche nei reticoli endoplasmatici lisci
(REL)* e nei citosol di quasi tutti i tessuti, alcuni hanno localizzazione
mitocondriale.
La specificità degli enzimi è relativa.
Alcuni enzimi metabolizzanti sono costitutivi mentre altri possono essere indotti
da farmaci e vari xenobiotici.
Gli enzimi metabolizzanti possono anche essere inibiti dagli xenobiotici.
L’esposizione contemporanea a due o più sostanze può influenzare la velocità di
metabolismo di una o più di esse
*detti anche frazione microsomale
Le reazioni di biotrasformazione in particolare,
soprattutto quelle di Fase I, possono comportare
l’attivazione della molecola trasformando una
molecola inerte in un tossico!!!
IDROLASI:Sono presenti in vari tessuti sia animali sia vegetali.
Si dividono in:
CARBOSSILESTERASI (nel REL e citosol)
PEPTIDASI (in sangue e lisosomi)
EPOSSIDO IDROLASI (nel REL e citosol)
Le CARBOSSILESTERASI catalizzano
1.
2.
Idrolisi di:
esteri di acidi carbossilici
•
amidi
•
tioesteri
•
esteri di acidi fosforici
•
anidridi acide
Transesterificazioni ( es sostituzione di etanolo con metanolo)
A-esterasi
Idrolisi di organofosforici con cisteina
B-esterasi
sono inibite da organofosforici
C-esterasi
non interagiscono con organofosforici
R-CH2-CO-O-CH2-R’ + H2O
esterasi
R-CH2-CO-OH + OH-CH2-R’
Acido
Alcol
R-CH2-CO-NH-CH2-R’ + H2O
amidasi
R-CH2-CO-OH + NH2-CH2-R’
Acido
Amina
Peptidasi:
1.
Aminopeptidasi
2.
Carbossipeptidasi
3.
Endopeptidasi
Le EPOSSIDO IDROLASI contengono un residuo basico di istidina
O
C
OH
CH2 +H2O
H
Stirene Epossido
H
H
Stirene Glicol
OH
H
O
-H
+H2O
Naftalene 1,2ossido
CH2OH
C
H
OH
Naftalene 1,2diidrodiolo
Resistenza ad ulteriori
biotrasformazioni
Legame al DNA e
mutazione
Tumore a polmone e
cute
Ruolo dell’Epossido idrolasi nel metabolismo e nella tossicità del Benzo(a)pirene
RIDUZIONI
Per:
•Metalli (As pentavalente a Trivalente)
•Aldeidi e Chetoni
•Disulfidi e Sulfossidi
•Chinoni
•N-Ossidi
•Alcheni
•Azo e Nitrogruppi
I cofattori riducenti, donatori di elettroni sono le forme ridotte di:
FAD, FNM NADH e NAPH
Glutatione ridotto (GSH
)Ascorbato ecc.
I sistemi enzimatici che operano riduzioni sono:
Riduzione di:
Enzima e Reazione
Localizzazione
Azo e Nitro
gruppi
NAD(P)H chinone ossidoriduttasi
(flavoproteina)
Citocromo P450
DT Diaforasi
Citosol e REL
Chetoni e
Aldeidi
Alcoldeidrogenasi
Carbonil riduttasi
Aldeide
Alcol
Citosol
Disulfidi
GSH + Glutatione riduttasi
R’S-SR
R’SH +RSH
Citosol
Sulfossidi e Nossidi
Sistema del citocromo P450
Monossigenasi Flaviniche
REL
Citosol
Chinoni
Diaforasi
Chinone
Citosol
Idrochinone
Dealogenazioni Sistema del citocromo P450
REL
Dealogenazione riduttiva
Tratto da A. Parkinson in “Casarett & Doull’s Toxicology”
De-alogenazioni riduttive e ossidative nel REL e conseguenze tossicologiche
Tratto da A. Parkinson in “Casarett & Doull’s Toxicology”
I Sistemi Ossidativi Per gli Xenobiotici
1. Sistema ossidativo per Alcol, Aldeidi e Chetoni
2. Monoamino ossidasi; Di-amino ossidasi; Poli-amino
ossidasi
3. Aromatizzazione
4. Perossidasi (coossidazioni dipendente da
Perossidazioni)
5. Sistema monossigenasico contenente FMO
6. Sistema ossido-riduttivo del P450
Ossidazioni
Gruppo
P450
FMO
MAO
POP
PGS
ADH
ADLH
Alcani
+
-
-
-
-
-
-
Alcheni
+
-
-
-
-
-
-
Benzeni
+
-
-
-
+
-
-
Policiclici aromatici
+
-
-
-
+
-
-
Alcoli
+
-
-
-
-
+
-
Aldeidi
+
-
-
-
-
-
+
Fenoli
+
-
-
+
+
-
-
Amine primarie
+
(+)
+
+
+
-
-
Amine secondarie
+
+
-
+
+
-
-
Amine terziarie
+
+
-
-
-
-
-
N-metilamine
+
-
-
-
+
-
-
Idrazine
+
+
?
-
-
-
-
Tiocomposti
+
+
-
+
+
-
-
ADH=Alcol deidrognesi; ALDH=Aldeide deidrogenasi FMO=Monossigenasi Flavino
dipendente; MAO=monoami-nossidasi; P450=Monossigenasi P450 dipendente; POP=perossidasi dipendente da H2O2; PGS=Prostaglandina sintetasi
Alcol-DH sono enzimi citosolici contenenti Zn il cofattore è il NAD+, sono
inducibili
Aldeide-DH1 enzima citosolico per xenobiotici e Acetaldeide il cofattore è il
NAD+
AldeideDH2 enzima mitocondriale per Acetaldeide il cofattore è il NAD+
AldeideDH3 enzima citosolico per xenobiotici
cofattori sono NAD+ e NADP+
O
R-CH2OH
ADH
R-C
ADLH
ma non per Acetaldeide i
O
R-C
H
NAD+ NADH + H+
OH
NAD+ NADH + H+
+ H2O
Le aldeidi possono anche essere ossidate da una Aldeide ossidasi e dalla
Xantina ossidasi e: l’ossigeno è fornito dall’acqua
Tappe dell’ossidazione dell’etanolo: in condizioni di non eccessivo carico di etanolo
funziona essenzialmente l’ADH citosolica e non si ha accumulo tossico di Acetaldeide
Le amino ossidasi sono implicate nella
deaminazione di amine primarie, secondarie e
terziarie.
La deaminazione delle primarie produce
ammoniaca e una aldeide
RCH2NH2 +FAD
RC=NH +FADH2
RC=NH +H2O
RCOH + NH3
FADH2 +O 2
FAD +H2O2
Dalla reazione in presenza di ossigeno si genera anche
acqua ossigenata.
FMO monossigenasi contenente FAD è un enzima inducibile presente nel
REL è inibito dagli IPA e catalizza: 1) N-ossidazioni 2) S-ossidazioni
Dopo che la FAD è stata ridotta dal NADPH il NADP+ resta legata
all’enzima che si combina con l’ossigeno per generare un perossido.
Durante l’ossidazione del substrato la perossiflavina è convertita in
idrossiflavina.
Infine questa è disidratata con perdita di H2O e NADP+
Esempi di N-ossidazioni ad opera del sistema FMO
Tratto da A. Parkinson in “Casarett & Doull’s Toxicology”
Esempi di S-ossidazioni ad opera del sistema FMO
Tratto da A. Parkinson in “Casarett & Doull’s Toxicology”