BIOFILM MICROBICI
1
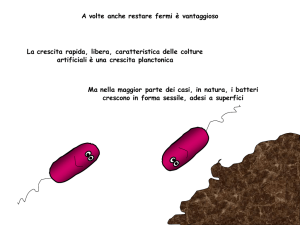
Per decenni i batteri sono stati visti come
esseri viventi molto individualisti
che conducono
la loro esistenza come singole cellule
libere in un mezzo, alla costante ricerca di
nutrienti per sopravvivere e, se ci sono le
possibilità, riprodursi.
2
Scaricato da Sunhope.it
dagli esami su popolazioni batteriche presenti in una grande varietà di sistemi
naturali e patologici hanno mostrato che
la maggior parte di questi microorganismi
cresce sotto forma di BIOFILM 3
BIOFILM
Il termine biofilm è usato per descrivere comunità strutturate di cellule batteriche (microcolonie) racchiuse in matrici polimeriche (polisaccaridica “slime” )
extracellulari autoprodotte e aderenti ad una superficie INERTE o VIVENTE
all‘interfaccia con una fase liquida
4
Scaricato da Sunhope.it
Il 65% e l’80% delle infezioni batteriche è
causata da batteri che crescono in biofilm
Tutte le infezioni batteriche associate all’uso di dispositivi medici impiantabili sono da biofilm
5
superficie INERTE:
Dispositivi medici
impiantabili
Lenti a contatto
Valvole cardiache
Protesi ortopediche
Cateteri vascolari
Impianti dentali etc
superficie VIVENTE:
Tutti i
tessuti
dell’ospite
6
Scaricato da Sunhope.it
Protesi dentarie
Cateteri vascolari
Protesi ortopediche
Formazione di biofilm da superfici inerti impiantabili 7
Immagini al microscopio elettronico delle superfici di presidi medici (cateteri, protesi ecc.) che sono stati focolai di infezioni, mostrano la presenza di comunità batteriche sessili inserite in una matrice polimerica.
8
Scaricato da Sunhope.it
Con la CLSM (microscopia confocale laser a scansione) le osservazioni in vivo dei biofilm hanno indicato che la struttura base del biofilm è universale, descrivibile come una foresta di torrette gelatinose fissate alla superficie. 9
Donlan and Costerton, 2002.
Le caratteristiche strutturali dei biofilm incidono
sull’istaurarsi di infezioni batteriche croniche,
quale l'endocardite valvolare e la tendenza delle
microcolonie a distaccarsi dal biofilm può
produrre emboli infettivi che, attraversando i
capillari, possono portare a gravi conseguenze
10
Scaricato da Sunhope.it
Biofilm di S.epidermidis su corpi estranei
pacemaker
catetere
11
Biofilm di S.epidermidis su corpi estranei
12
Scaricato da Sunhope.it
FORMAZIONE DEL BIOFILM
Si ritiene che la formazione del biofilm sia
un processo che si svolge in due fasi che
richiede :
1.ADESIONE dei batteri su un substrato
solido ( sup. inerte) anche mediante attacco alle
proteine dell’ospite
2.ADESIONE INTERCELLULARE, che
determina la formazione degli strati
multipli del biofilm.
13
Attacco dei batteri alle proteine dell’ospite
Proteine dell’ospite che favoriscono l’adesione
dei batteri
• Fibrinogeno
• Fibronectina
• Vitronectina (p - adesiva)
• Fattore Von Willebrand (coagulazione)
14
Scaricato da Sunhope.it
r1
OSPITE
Risposta dell,’organismo all’inserimento di un
dispositivo :
FILM PROTEICO
Le proteine possono promuovere (fibronectina)
o inibire (albumina) l’adesione microbica,
adsorbendosi alle superfici polimeriche del
catetere o interagendo con le strutture di
superficie dei microrganismi influenzandone le
capacità adesive.
Microfotografia ottenuta mediante
SEM del film proteico depositato
sulla superficie interna di un
Catetere Venoso Centrale a poche
ore dall’impianto in un paziente
15
FORMAZIONE DEI BIOFILM
1
Attacco dei
batteri
al dispositivo
medico
impiantato
3
Formazione di
multistrati di cellule batteriche
2
Adesione dei batteri alle proteine
dell’ospite depositate sul dispositivo
16
Scaricato da Sunhope.it
Diapositiva 15
r1
rosaria; 23/05/2004
Scaricato da Sunhope.it
migrazione batteri
cutanei residenti o
transienti nel tratto
sottocutaneo in
corrispondenza del
sito di inserzione del
catetere;
colonizzazione
microbica della punta
del catetere.
Biofilm sulla superfice
In seguito all’inserimento del catetere nel sistema venoso, le
proteine plasmatiche in circolo si legano rapidamente al
biomateriale. In pochi minuti si attiva la cascata della
coagulazione e il sistema del complemento. Vengono attirate le
piastrine e i polimorfonucleati sul sito d’inserzione che insieme
alle proteine plasmatiche formano un reticolo in grado di
inglobare batteri facilitando la formazione di colonie
Scaricato da Sunhope.it
Biofilm sulla superfice
Bastano anche pochi batteri per cominciare a formare il
biofilm.
In pochi minuti avvengono cambiamenti fenotipici che
facilitamo l’adesione del microrganismo; dopo 12 minuti circa
sono indotti i geni che inducono la produzione di polisaccaridi e
di proteine che fanno aderire saldamente il batterio alla
superficie e tra di loro.
Comincia la crescita esponenziale
Biofilm sulla superfice
La formazione del biofilm è una strategia
universale per la sopravvievnza microbica allo
scopo di colonizzare tante superficie diverse
Dal biofilm maturo le cellule si possono staccare e
disseminare. L’eccessiva densità cellulare induce un segnale
cellulare che determina la degradazione degli esopolimeri e
l’invio in circolo di microcolonie. Si parla di infezione
metastatica a distanza, tipo endocarditi o osteomieliti (casi di
endocarditi da S. aureus)
Scaricato da Sunhope.it
Rappresentazione schematica della formazione di un biofilm su un
dispositivo medico.
• (A) Le cellule planctoniche sono suscettibili all’azione di antibiotici, anticorpi e fagociti.
• (B) I batteri formano biofilm preferenzialmente su una superficie inerte, la comunità sessile diventa
resistente agli antibiotici e all’azione di anticorpi e fagociti.
• (C) I fagociti sono attratti dal biofilm. La fagocitosi è impedita, ma sono rilasciati enzimi proteolitici.
• (D) Gli enzimi proteolitici danneggiano il tessuto che circonda il biofilm. Batteri in forma planctonica
lasciano il biofilm e possono causare infezioni acute nei tessuti circostanti
21
Danno dell’infezione da biofilm
Le cellule batteriche sessili rilasciano antigeni e stimolano la risposta immune e quindi la produzione di anticorpi, ma gli anticorpi non sono efficaci nell’uccidere i batteri all’interno del biofilm e possono causare un danno complesso ai tessuti circostanti.
Persino in individui con eccellenti reazioni immunitarie umorali e cellulari, le infezioni da biofilm raramente sono risolte da parte dei meccanismi di difesa dell’ospite
22
Scaricato da Sunhope.it
L’ adesione dei batteri
alla superficie dipende:
Tipo e natura del
dispositivo
Proteine di superficie del
batterio
AtlE
SSP1 – SSP2
CflA – CflB
AAP
BAP
Bhp
•Acidi teicoici
Trattato o non con rivestimento
idrofilo o idrofobo
Presenza di microfratture e
microcavità
23
CATETERE
Una superficie perfettamente liscia si
presta in minor misura all’attacco
microbico rispetto ad una superficie che
presenti irregolarità, quali microcavità
e/o microfratture: queste fornendo
altrettante nicchie protette, consentono
ai microbi sia di rendere
stabile la loro adesione alla superficie
mediante adesine e/o sostanze
esocellulari in grado di
favorirne la persistenza, che di metterli
a riparo dall’azione di fagociti e
agenti antimicrobici
Catetere Venoso Centrale colonizzato da
Staphylococcus epidermidis osservato
mediante SEM in corrispondenza di un’area
superficiale caratterizzata dalla presenza di
microfratture.
È evidente la matrice esocellulare di natura
polisaccaridica prodotta dai batteri stessi
24
Scaricato da Sunhope.it
Proteine di superficie di S.aureus
Adesine proteiche della famiglia MSCRAMM
(Microbial surface components recognizing adhesive matrix molecules)
• Proteina legante il Fibrinogeno
• Proteina legante la Fibronectina
• Proteina legante il Collagene
• Fattori agglutinanti
(FnBPA – FnBPB)
(Cna)
(CflA – CflB)
25
Meccanismo in S. aureus
La prima fase è mediata da forze chimico-fisiche non specifiche
(interazioni elettrostatiche, forze di Van der Waals, legami idrofobici, ecc.), l'adesina
capsulare (PS/A) ed una o più proteine di superficie.
La seconda fase è mediata da un altro antigene stafilococcico
denominato adesina polisaccaridica intercellulare (PIA).
Studi recenti hanno dimostrato che il locus ICA di S. epidermidis è
coinvolto nella produzione sia dell'antigene 1 che dell'antigene PIA.
Una volta inattivati questi geni, il batterio perde la capacità di
formare biofilm in provetta e, a quanto pare, anche nei tessuti di
animali di laboratorio.
26
Scaricato da Sunhope.it
Ceppi PIA positivi
Resistenti all’azione del
sistema di difesa dell’ospite
Slime
Ceppi PIA negativi
Sensibili al sistema di difesa
dell’ospite
27
Gli enterococchi
Enterococcus faecalis, sono emersi negli ultimi anni quali importanti agenti di infezioni nosocomiali, tratto urinario, ma anche di batteriemie ed endocarditi.
Solo recentemente la capacità di questo organismo di formare biofilm è stata identificata e caratterizzata; l’80% di ceppi di E. faecalis, vs. il 20% di E. faecium, isolati da fonti diverse è stata trovata in grado di formare biofilm, ma solo in risposta a stimoli precisi, quali la presenza di fonti aggiuntive di carboidrati e condizioni di stress.
28
Scaricato da Sunhope.it
Polmonite
associata a fibrosi
cistica
Biofilm
di Pseudomonas
aeruginosa
Caratteristiche cliniche dell’infezione
1. L’agente eziologico è ubiquitario e spesso risulta
patogeno per un particolare gruppo di individui
2. I biofilms crescono lentamente e le infezioni sono spesso
lente nel produrre sintomi evidenti
3. Raramente sono risolte dai meccanismi di difesa
dell’ospite
4. I biofilms possono agire da focolai di infezioni acute
5. La terapia antibiotica convenzionale risulta inefficace
29
Biofilm sulla superfice
Formazione di biofilm da parte di microrganismi patogeni:
adesione
colonizzazione e formazione di microcolonie
maturazione
Costerton et al., Science, 2002
Scaricato da Sunhope.it
Adesine Pili tipo I
Processo di formazione del biofilm in Pseudomonas aeruginosa
I biofilm prodotti da P. aeruginosa.
Le cellule attaccate producono polisaccaride extracellulare e migrano dalla superficie in
maniera modesta. Le cellule poi si aggregano a pilastro e in strutture a forma di fungo.
La presenza di canali pieni di acqua tra queste microcolonie, fa pensare a sistemi
circolatori primitivi, che rilasciano nutrienti e rimuovono prodotti di scarto .
31
La struttura di un biofilm maturo varierà con:
• la localizzazione
• la natura dei microrganismi costituenti
• la disponibilità dei nutrienti.
La struttura di un biofilm può variare da densi strati confluenti di
cellule (placche dentali o biofilm di catetere urinario) a microcolonie disperse o
cumuli di cellule che fuoriescono da uno strato basale sottile
(biofilm che si formano sulle superfici nelle acque naturali oligotrofiche).
32
Scaricato da Sunhope.it
Molti sono i batteri capaci di formare il BIOFILM, sia Gram negativi che Gram positivi.
A questi aggiungiamo anche i miceti 33
Le infezioni da biofilm sono generalmente caratterizzate da: Una lenta comparsa
Sintomi lievi Cronicità
Risposta refrattaria alla terapia antibiotica
le infezioni batteriche croniche sono state attribuite al fatto che i microorganismi causali vivono in biofilm
34
Scaricato da Sunhope.it
Dove si riscontrano i BIOFILM nelle
infezioni croniche e ricorrenti
Pneumologia:
fibrosi
cistica,
COPD
(Chronic
Obstructive Pulmonary Disease), ventilazione
polmonare assistita
Respiratorio:faringiti, otiti, rino-sinusiti
Urologia: prostatiti, uretriti, cistiti
Cardiologia: endocarditi
Infezioni associate a dispositivi medici
Biofilm e infezioni su superfici viventi:
tessuti dell’ospite
Infezioni o malattia
Biofilm (specie batterica principale)
Carie dentali
Cocchi Gram-positivi acidofili
(es., Streptococcus)
Periodontite
Flora batterica anaerobica orale
Gram-negativa
Otite media
Ceppi di Haemophilus influenzae
Infezioni muscoloscheletriche
Cocchi Gram-positivi (es., stafilococchi)
Fascite necrotica
Streptococchi Gruppo A
Infezioni del tratto biliare
Batteri enterici (es., Escherichia coli)
Osteomielite
Varie specie batteriche e fungine
Endocardite
Streptococchi gruppo viridans
Polmonite associata a fibrosi cistica
P. aeruginosa e Burkholderia cepacia
I biofilm crescono lentamente, in una o più localizzazioni, e le infezioni da biofilm
36
sono spesso lente nel produrre sintomi evidenti.
Scaricato da Sunhope.it
Biofilm su superfici inerti :
contaminanti di strumenti e presidii medici
Dispositivi contaminati
Biofilm (specie batterica principale)
Lenti a contatto
Cocchi Gram-positivi e P. aeruginosa
Dispositivi per dialisi peritoneale
Flora batterica e fungina mista
Cateteri urinari
E. coli e altri bacilli Gram-negativi
Dispositivi intrauterini (IUD)
Actinomyces israelii
Dispositivi endotracheali
Flora batterica e fungina mista
Cateteri venosi
S. epidermidis
Valvole cardiache meccaniche
S. aureus e S. epidermidis
Inneschi vascolari
Cocchi Gram-positivi
Dispositivi ortopedici
S. aureus e S. epidermidis
Protesi di vari organi
S. aureus e S. epidermidis
Le infezioni da biofilm condividono comuni caratteristiche cliniche: si sviluppano
preferibilmente su superfici inerti o su tessuto morto; si presentano comunemente
su dispositivi medici e frammenti di tessuto morto o di osso in necrosi
37
La formazione di queste comunità sessili e la loro
resistenza naturale agli agenti antimicrobici, sono
causa di molte infezioni batteriche persistenti e
croniche.
Solo dagli anni 70 si è capito che i batteri organizzati in comunità
sessili, costituiscono la maggiore componente della biomassa batterica in
natura
Solo dagli anni ottanta e novanta abbiamo iniziato a comprendere
che i batteri adesi erano organizzati in comunità molto elaborate.
38
Scaricato da Sunhope.it
oggi sappiamo
che i batteri fanno parte di
una società piuttosto complessa
e che sono in grado di
“comunicare fra loro”
39
Nella società dei batteri
(ambiente in cui una certa popolazione microbica è inserita)
corrono costantemente dei segnali chimici, molecole di piccole dimensioni simili agli anticorpi e chiamati autoinduttori.
40
Scaricato da Sunhope.it
autoinduttori
Le molecole di autoinduttori si accumulano al di fuori delle singole cellule microbiche; finché la carica microbica è bassa e diluita nell’ambiente esterno non succede nulla.
Quando la popolazione si accresce e supera un certo livello
(un quorum) le molecole che si sono accumulate possono innescare una serie di eventi che si succedono per lo più con effetto “a cascata”
determinando qualche reazione o qualche effetto. Questo sistema di comunicazione è chiamato “quorum sensing”
41
Il “quorum sensing” è un sistema complesso di comunicazione
“cellula-cellula” con il quale i batteri sono in grado di
comunicare fra loro.
Grazie a questo sistema i batteri sono capaci di mettere in atto
attività coordinate,
una capacità che un tempo si riteneva propria soltanto degli esseri
viventi superiori
Xavier e Bassler : « quorum sensing è un processo di
comunicazione tra cellule batteriche che comporta la sintesi, la
liberazione e la captazione di“molecole segnale” extracellulari
chiamate autoinduttori».
42
Scaricato da Sunhope.it
“quorum sensing”
“quorum sensing” ci fa comprendere che le popolazioni microbiche
non sono dei
semplici aggregati più o meno caotici di
microrganismi che vivono ciascuno per
proprio conto, bensì una comunità coordinata
al cui interno fluiscono costantemente
informazioni che permettono alla
comunità stessa di
resistere alle condizioni
avverse e di avvantaggiarsi per il
loro fine.
43
Sfruttando il quorum sensing i batteri
possono regolare :
1) l’emissione di bioluminescenza
2) la formazione di biofilm sulle superfici di lavoro nelle industrie alimentari
3) la crescita competitiva tra differenti popolazioni e la sporulazione
4) la sintesi di antibiotici e di batteriocine
5) l’induzione di fattori di virulenza nelle piante o negli umani
6) i processi di infezione degli organismi superiori
44
Scaricato da Sunhope.it
alcuni di questi fenomeni microbici come la sporulazione dei batteri
e altri aspetti di fisiologia microbica prima non erano ben spiegabili, oggi conoscendo il meccanismo del quorum sensing si giustificano questi fenomeni
45
QUORUM SENSING Nei batteri gram-negativi
Una domanda importante è come le cellule di
P. aeruginosa comunicano e coordinano il loro
comportamento per costruire biofilm maturi.
Nei batteri gram-negativi, la comunicazione cellulare avviene attraverso l’attività delle molecole
di omoserina lattone acetilata (AHLS
)
Queste piccole molecole segnale, dette autoinduttori,
si accumulano nelle colture in funzione della densità cellulare.
sono rilasciate dalle cellule e
Ad una densità di popolazione soglia, definita “quorum” gli AHLS accumulati
possono interagire con i recettori situati sulla superficie della cellula del batterio che controllano
l’espressione genica
46
Scaricato da Sunhope.it
quando viene raggiunto un livello critico di densità della popolazione (quorum) si
attiva l’espressione di particolari blocchi di geni che modulano vari processi
(sensing) implicati nello sviluppo del biofilm stesso e la liberazione dalla superficie
più esterna di cellule planctoniche destinate a colonizzare altri siti
complicando ed estendendo il processo infettivo
47
FORMAZIONE DEI BIOFILM
48
Scaricato da Sunhope.it
Gram Negativi
AUTOIDUTTORI
Gram Positivi
49
Quorum sensing nei Gram positivi
Anche nei batteri gram-positivi è stato descritto il meccanismo di comunicazione
cellulare e di regolazione dei geni definito quorum-sensing;
è diversa però la natura delle molecole autoinduttori, infatti in questo caso
le molecole segnale sono dei piccoli
peptidi.
50
Scaricato da Sunhope.it
La terapia antibiotica può essere risolutiva verso le cellule planctoniche rilasciate dal biofilm, ma non riesce ad eradicare e uccidere il biofilm. I batteri del biofilm sono 10‐1000 volte più resistenti al trattamento antibiotico rispetto al fenotipo planctonico.
Per questa ragione le infezioni da biofilm mostrano sintomi ricorrenti, dopo cicli di terapia antibiotica, finché
la popolazione sessile non è chirurgicamente rimossa dall’organismo (rimozione di cateteri, di protesi, etc.)
51
Molte infezioni batteriche croniche vedono coinvolti biofilm batterici, che non sono facilmente eradicati
dalla terapia antibiotica
convenzionale
52
Scaricato da Sunhope.it
Lo slime impedisce, con
meccanismo di barriera l’attacco dei
PMN, e riduce la efficacia degli
antibiotici (la matrice li lega prima
del contatto con la parete batterica
rendendoli inefficaci).
53
Biofilm e antibiotici
La scoperta di nuovi agenti
antibatterici attivi anche sui biofilm è
un urgente obiettivo da perseguire.
54
Scaricato da Sunhope.it
MECCANISMI DI RESISTENZA AGLI ANTIBIOTICI : Possono essere regolati dal “quorum sensing”
2. Crescita
lenta per
riduzione
di nutrienti
3. Crescita
lenta per
cambiamenti
chimico-fisici
nel biofilm
4. Sviluppo di
un fenotipo
biofilm specifico
1. Barriera
meccanica
Nel biofilm possono esprimersi meccanismi di resistenza diversa
1. Cellule superificiali
Protette dallo SLIME
2. Cellule intermedie
Crescita rallentata
3. Cellule più profonde
Esprimono un fenotipo biofilm specifico
55
Resistenza antibiotica
Gli antibiotici possono
essere inattivati
dalla produzione di
specifici enzimi
all’interno del biofilm
Scaricato da Sunhope.it
Resistenza Antibiotica
Impermeabilità
I Polimeri che compongono
la matrice impediscono la
diffusione del farmaco ed
altre molecole
Resistenza Antibiotica
Impermeabilità
La carica negativa sui
polimeri impedisce la
penetrazione di molecole
cariche positivamente, come
gli antibiotici. Se
l’antibiotico è inattivato o
legato mediante legami ionici
alla superficie del biofilm, la
sua penetrazione negli strati
profondi è ritardata.
Scaricato da Sunhope.it
Resistenza Antibiotica
Condizioni fisiologiche
peculiari
Ackdfnfng
La bassa tensione di O2 e
la riduzione dei nutrienti
riduce la crescita batterica
nella parte più profonda del
biofilm
La velocità di crescita delle
cellule riduce l’attività di
alcuni antibiotici
Resistenza Antibiotica
La conseguenza è che gli
antibiotici, anche se
penetrano lo strato
superficiale del biofilm, non
sono in grado di uccidere i
batteri intrappolati negli
strati più profondi, per le
cambiate condizioni di
crescita
Ackdfnfng
Scaricato da Sunhope.it
Biofilms:
interazioni con il sistema immune
La forma sessile produce antigeni che stimolano la sintesi di
anticorpi ma questi sono incapaci di raggiungere e uccidere i
batteri intrappolati nel biofilm
a causa dell’ingombro sterico i PMNC non riescono a
raggiungere il sito dell’infezione e svolgere la loro azione, ma
anche se penetrano la barriera fisica del biofilm non riescono
a fagocitare i batteri
la condizione tende a diventare cronica
La resistenza osservata nei biofilm non è
genotipica, cioè portata da plasmidi, trasposoni o legata ad eventi mutazionali, ma piuttosto dovuta a strategie multicellulari e/o alla capacità di singole cellule interne al biofilm di differenziarsi in uno stato fenotipico protetto e tollerante l’azione antibiotica.
62
Scaricato da Sunhope.it
Resistenza Antibiotica
Età del biofilm:
altro aspetto importante da tener presente.
Più è giovane il biofilm più è facile eradicarlo.
Ciò mette in luce l’importanza di
diagnosticare in tempo l’infezione da
catetere
Il biofilm si adatta alle fluttuazioni ambientali
come la temperatura, variazioni di pH, osmolarità
e disponibilità di nutrienti attraverso
l’espressione multipla di geni.
Le alterazioni genetiche non solo asssicurano la
sopravvivenza nella comunità, ma proteggono il
microrganismo dalla risposta immune dell’ospite,
tossine ambientali e antimicrobici.
Scaricato da Sunhope.it
Biofilms
La presenza del biofilm può spiegare le difficoltà che si
incontrano nel tentativo di eradicare le infezioni croniche
Gli antibiotici possono uccidere la forma PLANKTONICA
MA
sono incapaci nell’ ERADICARE il biofilm che persiste come un
focolaio destinato a perpetuare l’ infezione
Guerra tattica
Dovrebbe essere possibile controllare l’impianto e sviluppo del biofilm con farmaci in grado di prendere di mira le loro proprietà specifiche
Alcuni ricercatori notarono (nel 1995) che le fronde di un alga rossa (Delisea pulchra) che cresce a Botany Bay, raramente sono coperte da biofilm.
D. pulchra riesce a restare indenne dai biofilm
producendo certe sostanze chimiche, i furanoni
sostituiti.
66
Scaricato da Sunhope.it
i furanoni sostituiti si legano alle cellule batteriche nei siti normalmente usati dalle molecole di segnalazione (quorum sensing) e così facendo impediscono loro di emettere messaggi che promuovano la formazione di biofilm.
67
FARMACI ANTI‐BIOFILM
Università di Roma “La Sapienza”, Studio dell’attività “anti‐biofilm” di un enzima proteolitico selezionato in base a precedenti studi: la Serratio‐peptidasi (SPEP)
il trattamento combinato di antibiotico più
SPEP riduce drasticamente la formazione del biofilm “in vitro “ in tutti i ceppi batterici.
68
Scaricato da Sunhope.it
BIOMATERIALI A RILASCIO DI AGENTI ANTIMICROBICI PER LO SVILUPPO DI DISPOSITIVI MEDICI ANTI‐BIOFILM
Vengono adsorbiti antibiotici (cefamandolo nafato, rifampicina, amoxicillina e vancomicina) o antimicotici (fluconazolo) su matrici polimeriche con gruppi funzionali diversi (carbossilici, amminici, solfato e idrossilici), allo scopo di instaurare interazioni chimico‐fisiche
specifiche tra matrice polimerica e farmaco
tale sistema è risultato in grado di inibire per 8 mesi la colonizzazione di Staphylococcus epidermidis.
69
Le prospettive
Il controllo della comunicazione batterica nei biofilm è
una prospettiva terapeutica molto interessante nel quadro della lotta ai batteri perché permette di evitare l’uso degli antibiotici, con tutte le sue controindicazioni.
L’aumento dell’attività batterica, viceversa, potrebbe rivelarsi di grande importanza per l’agricoltura, la biotecnologia e l’industria alimentare.
70
Scaricato da Sunhope.it
Molti organismi sessili, sia vegetali che
animali, proteggono se stessi dalla
“sepoltura” all’interno di biofilm microbici,
producendo sostanze chimiche in grado di
bloccarne la formazione.
Queste sostanze sono attualmente utilizzate
a livello industriale
per controllare la crescita dei biofilm
71
72
Scaricato da Sunhope.it
Indagini microbiologiche
Per la diagnosi eziologica delle infezioni
sistemiche a partenza
dal Catetere Vascolare è opportuno l'invio
contestuale al laboratorio di microbiologia
della punta del catetere e dei prelievi per
emocolture prelevate da vena periferica
Procedure di espianto e preparazione del catetere
per l’analisi microbiologica
L’espianto deve essere effettuato:
sterilmente
previa disinfezione della cute pericatetere
(applicazione per 5' di un impacco di garza imbevuto di una
soluzione alcolica allo 0,05% di clorexidina)
Scaricato da Sunhope.it
Procedure di espianto e preparazione del catetere
per l’analisi microbiologica
Al momento della rimozione l’operatore, (facendo particolare
attenzione ad evitare possibili contaminazioni da contatto con superfici non sterili),
deve sezionare con bisturi o tagliare con forbici sterili il
catetere in segmenti di circa 5 cm di lunghezza, in
corrispondenza:
della punta,
del tratto intermedio,
del tunnel e del tratto emergente.
Ciascun segmento, riposto in provetta sterile (senza
aggiunta di alcun tipo di liquido di conservazione o di terreno colturale d’
arricchimento) verrà inviato al laboratorio.
Trattamento di infezioni associate a catetere
Il trattamento dovrebbe seguire immediatamente dopo la diagnosi
Rimozione immediata del catetere, se possibile, in tutti i casi complicati da
infezione metastatica
Per i casi in cui la rimozione è sconsigliata, per aumentato rischio al paziente,
si adotta la tecnica ALT (antibiotic-lock salvage technique). Tale tecnica
consiste nell’installazione di un antibiotico verso cui il microrganismo è
sensibile, associato o meno ad eparina, ad una concentrazione 100 volte
maggiore della concentrazione minima inibente utilizzata per la terapia
sistemica. L’antibiotico miscelato o meno ad eparina e soluzione fisiologica,
viene iniettato nel catetere chiuso, quando non è in funzione (in genere 12 h
over night)
Un altro metodo è quello di trattare il catetere con EDTA. Tale agente
eradica completamente il biofilm ed è anche un anti coagulante, per cui
potrebbe rimpiazzare l’uso di eparina eliminando i rischi di trombocitopeniaeparina associati
Scaricato da Sunhope.it