PROCESSO AI GRANDI TRIAL
Studi sull’efficacia dell’ipotermia post-arresto cardiaco
Massimo Massetti1, Claudio Sandroni2, Alfonso Ielasi3
1
Divisione di Cardiochirurgia, Università Cattolica del Sacro Cuore, Roma
Rianimazione e Terapia Intensiva, Università Cattolica del Sacro Cuore, Roma
3
U.O.C. Cardiologia-Unità di Cura Intensiva Cardio-Coronarica, A.O. Bolognini, Seriate (BG)
2
Background. I sopravvissuti ad un arresto cardiaco extraospedaliero che non riprendono coscienza hanno un
alto rischio di mortalità e di una prognosi neurologica sfavorevole. In questi casi le linee guida internazionali
raccomandano l’ipotermia terapeutica, anche se le evidenze scientifiche sono limitate, ma resta da definire
quale sia la temperatura target ottimale correlata al miglior outcome. Scopo dello studio è stato confrontare
due temperature target, entrambe mirate a prevenire la febbre.
Metodi. Nell’ambito di uno studio condotto a livello internazionale, 950 pazienti adulti, rimasti privi di coscienza dopo un arresto cardiaco extraospedaliero di presunta origine cardiaca, sono stati randomizzati a raffreddamento alla temperatura di 33°C o 36°C. L’endpoint primario dello studio era rappresentato dalla mortalità per tutte le cause nel corso dell’intera durata dello studio. L’endpoint secondario era un composito di
deficit neurologico o decesso a 180 giorni, valutati mediante la scala Cerebral Performance Category (CPC)
e la scala di Rankin modificata.
Risultati. Complessivamente sono stati inclusi nell’analisi primaria 939 pazienti. Alla fine dello studio, nel
gruppo dei pazienti randomizzati alla temperatura di 33°C la mortalità è stata del 50% (235/473) contro il
48% (225/466) nel gruppo dei pazienti randomizzati alla temperatura di 36°C (hazard ratio con una temperatura di 33°C 1.06, intervallo di confidenza [IC] 95% 0.89-1.28, p=0.51). A 180 giorni di follow-up, il 54%
dei pazienti del gruppo 33°C è morto o ha sviluppato deficit neurologici secondo la CPC contro il 52% dei
pazienti del gruppo 36°C (hazard ratio 1.02, IC 95% 0.88-1.16, p=0.78). All’analisi mediante la scala di Rankin modificata, sono stati riscontrati risultati sovrapponibili nei due gruppi (hazard ratio 1.01, IC 95% 0.891.14, p=0.87). Non sono state osservate differenze fra i due gruppi dopo aggiustamento dei risultati delle analisi in base ai fattori prognostici noti.
Conclusioni. Nei pazienti privi di coscienza rianimati da un arresto cardiaco extraospedaliero di presunta origine cardiaca, l’ipotermia ad una temperatura target di 33°C non conferisce alcun beneficio aggiuntivo rispetto ad una temperatura target di 36°C. [N Engl J Med 2013;369:2197-206]
* * *
Importanza. Nella fase successiva ad un arresto cardiaco l’ipotermia terapeutica intraospedaliera determina
un miglioramento della prognosi, ma l’applicazione dell’ipotermia terapeutica in fase preospedaliera subito
dopo il ripristino della circolazione spontanea potrebbe migliorare ulteriormente la prognosi.
Scopo. Verificare se in pazienti rianimati da un arresto cardiaco, con o senza fibrillazione ventricolare (FV) come ritmo di presentazione, l’ipotermia preospedaliera determini un miglioramento dell’outcome.
Disegno, contesto e partecipanti. È stato condotto uno studio clinico randomizzato nel quale i pazienti
adulti con arresto cardiaco preospedaliero sono stati assegnati a trattamento standard con o senza ipotermia
preospedaliera, ottenuta somministrando per via endovenosa fino a 2 litri di soluzione salina a 4°C il più precocemente dopo ripristino della circolazione spontanea. Sono stati arruolati 1359 pazienti (583 con FV e 776
senza FV) con arresto cardiaco preospedaliero rianimati dai paramedici della Contea di King, Washington,
randomizzati tra il 15 dicembre 2007 e il 7 dicembre 2012. Il follow-up è stato ultimato il 1° maggio 2013.
Quasi tutti i pazienti rianimati dopo FV e ricoverati in ospedale sono stati trattati con ipotermia in fase intraospedaliera indipendentemente dal gruppo di assegnazione.
Outcome e misure principali. Gli endpoint primari erano rappresentati dalla sopravvivenza e dallo stato
neurologico alla dimissione dall’ospedale.
© 2014 Il Pensiero Scientifico Editore
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Prof. Massimo Massetti Divisione di Cardiochirurgia, Istituto di Cardiologia, Università Cattolica del Sacro Cuore, Largo F. Vito 1, 00168 Roma
e-mail: [email protected]
Dr. Alfonso Ielasi U.O.C. Cardiologia-Unità di Cura Intensiva Cardio-Coronarica, A.O. Bolognini, Via Paderno 21, 24068 Seriate (BG)
e-mail: [email protected]
138
G ITAL CARDIOL | VOL 15 | MARZO 2014
IPOTERMIA POST-ARRESTO CARDIACO
Risultati. L’intervento preospedaliero ha determinato una diminuzione media della temperatura interna di
1.20°C (IC 95% da -1.33 a -1.07°C) nei pazienti con FV e di 1.30°C (IC 95% da -1.40 a -1.20°C) nei pazienti
senza FV al momento del ricovero ed ha ridotto il tempo necessario per raggiungere una temperatura inferiore a 34°C di circa 1h rispetto al gruppo di controllo. Tuttavia, la sopravvivenza alla dimissione ospedaliera
è risultata sovrapponibile tra i gruppi di intervento e di controllo e tra i pazienti con FV (62.7% [IC 95%
57.0%-68.0%] vs 64.3% [IC 95% 58.6%-69.5%], p=0.69) e senza FV (19.2% [IC 95% 15.6%-23.4%] vs
16.3% [IC 95% 12.9%-20.4%], p=0.30). Inoltre, tale intervento non è risultato associato ad un miglioramento dello stato neurologico in termini di pieno recupero o lieve compromissione alla dimissione sia nei pazienti con FV (il 57.5% [IC 95% 51.8%-63.1%] dei casi che hanno mostrato pieno recupero o lieve compromissione vs il 61.9% [IC 95% 56.2%-67.2%] dei controlli, p=0.69) che in quelli senza FV (il 14.4% [IC
95% 11.3%-18.2%] dei casi vs il 13.4% [IC 95% 10.4%-17.2%] dei controlli, p=0.30). Complessivamente,
nei pazienti del gruppo di intervento si è verificato più frequentemente un nuovo episodio di arresto cardiaco sul campo rispetto ai pazienti del gruppo di controllo (26% [IC 95% 22%-29%] vs 21% [IC 95% 18%24%), p=0.008), così come si è fatto maggiormente uso della terapia diuretica ed è stato riscontrato più
spesso edema polmonare all’Rx iniziale, risoltosi nell’arco di 24h post-ricovero.
Conclusioni e rilevanza. Anche se l’applicazione dell’ipotermia preospedaliera ha determinato una diminuzione della temperatura interna al momento del ricovero nonché una riduzione del tempo necessario per
raggiungere una temperatura inferiore a 34°C, tale intervento non è risultato associato ad un miglioramento della sopravvivenza o dello stato neurologico nei pazienti con o senza FV rianimati da un arresto cardiaco.
[JAMA 2014;311:45-52]
G Ital Cardiol 2014;15(3):138-143
IL PUNTO DI VISTA DI MASSIMO MASSETTI E
CLAUDIO SANDRONI
Malgrado i continui progressi della scienza rianimatoria, la mortalità dopo arresto cardiaco extraospedaliero (out-of-hospital
cardiac arrest, OHCA) resta intorno al 90%1. Dei pazienti inizialmente rianimati, due terzi muore prima della dimissione dall’ospedale2. Molte di queste morti sono dovute al danno cerebrale anossico3, che causa anche grave disabilità neurologica
in oltre un quarto dei sopravvissuti4.
Nel febbraio del 2002 due trial randomizzati pubblicati
sul New England Journal of Medicine5,6 avevano mostrato
che, nei pazienti privi di coscienza dopo essere stati rianimati da OHCA dovuto a ritmo defibrillabile, il mantenimento di
una temperatura corporea di 32-34°C per 12-24h si associava ad una più elevata sopravvivenza e ad una migliore prognosi neurologica sia alla dimissione dall’ospedale che a lungo termine.
Per questa ragione, nel 2003 l’International Liaison Committee on Resuscitation (ILCOR) aveva raccomandato l’uso dell’ipotermia terapeutica a 32-34°C per 12-24h nei pazienti in
coma dopo essere stati rianimati da un OHCA dovuto a fibrillazione ventricolare (FV) ed aveva suggerito che tale trattamento potesse portare beneficio anche nei pazienti rianimati
da un arresto dovuto ad altri ritmi o da un arresto intraospedaliero7. Sulla base di evidenze sperimentali, inoltre, il documento suggeriva che l’ipotermia dovesse essere iniziata il più
presto possibile. Da allora l’ipotermia terapeutica è stata utilizzata con sempre maggiore frequenza nei pazienti rianimati da
arresto cardiaco8,9.
A distanza di 12 anni dagli studi sopra citati, due nuovi trial
recentemente pubblicati pongono in discussione tali raccomandazioni e potrebbero cambiare in modo significativo le
procedure per il controllo della temperatura dopo l’arresto cardiaco.
Il primo di questi studi, noto anche come TTM trial10, ha
randomizzato 939 pazienti adulti privi di coscienza dopo riani-
mazione da OHCA di presunta origine cardiaca e da qualsiasi
ritmo per ricevere una temperatura controllata a 33°C o 36°C
per 24h, impiegando diversi metodi (soluzione salina fredda,
mezzi di superficie ed endovascolari). Nei pazienti che rimanevano privi di coscienza dopo il riscaldamento, la temperatura è
stata mantenuta al di sotto di 37.5°C per almeno 72h dal recupero di attività cardiaca spontanea (ROSC).
Il trial non ha dimostrato alcuna differenza statisticamente significativa né in termini di mortalità (50% nel gruppo 33°C
vs 48% nel gruppo 36°C) né di percentuali di esito neurologico sfavorevole (54% a 33°C vs 52% a 36°C). Questo risultato
non può spiegarsi con una minore durata o un incompleto raggiungimento dell’ipotermia rispetto ai due studi precedenti. Il
confronto con il maggiore di questi ultimi, quello prodotto dall’HACA Study Group5 mostra viceversa come la temperatura di
33°C fosse raggiunta alla 12a ora in quello studio vs l’8a ora nel
TTM trial (Figura 1 in entrambi gli studi), il che si risolveva in un
mantenimento della temperatura target di 16h invece che di
20h. Dal confronto delle due figure e dalla metodologia emerge invece un’altra importante differenza, e cioè che gli studi
precedenti non avevano in realtà comparato pazienti in ipotermia moderata a 33°C con pazienti in normotermia, ma piuttosto pazienti in ipotermia moderata con pazienti senza controllo della temperatura, molti dei quali erano divenuti leggermente ipertermici durante il trial. Infatti, la Figura 1 del trial
HACA mostra come nel braccio di controllo l’estremo superiore del 75% percentile della temperatura vescicale raggiungesse i 38°C. Al contrario, nel braccio di controllo del TTM trial
la temperatura vescicale media è stata attivamente mantenuta a 36°C ed il limite superiore della temperatura nel 95% dei
pazienti superava di poco i 37°C. Per ottenere questo risultato i pazienti sono stati sedati – e all’occorrenza curarizzati –
anche nel braccio di controllo. In sostanza, il TTM trial ha comparato due livelli di temperatura strettamente controllata, entrambi al di sotto dei valori normali di temperatura corporea
centrale.
G ITAL CARDIOL | VOL 15 | MARZO 2014
139
M MASSETTI ET AL
Un’altra ragione dei diversi risultati ottenuti dal TTM trial rispetto agli studi precedenti è che questi ultimi riflettono una
pratica rianimatoria meno avanzata rispetto agli standard di oggi; l’arruolamento dei pazienti in entrambi gli studi era infatti
iniziato nel 1996, ossia 18 anni fa. Da allora sia le linee guida
della rianimazione cardiopolmonare che quelle per il trattamento intensivo dei pazienti comatosi dopo arresto cardiaco
sono molto evolute. Una prova indiretta di questo cambiamento è data dalla diversa facilità di arruolamento nell’HACA
trial e nel TTM trial: benché i criteri di inclusione nei due studi
fossero simili, nell’HACA trial solo il 7.7% dei pazienti eleggibili aveva potuto essere arruolato, contro l’87% dei pazienti nel
TTM trial, il che rende questo studio molto più rappresentativo.
La rappresentatività del TTM trial non deve far tuttavia dimenticare che la popolazione di pazienti arruolati era costituita per il 90% da arresti testimoniati ed in cui i soccorritori occasionali avevano praticato una rianimazione cardiopolmonare
nel 73% dei casi; l’80% degli arresti era sostenuto da un ritmo
defibrillabile e l’intervallo mediano tra l’arresto e la rianimazione avanzata era di 10 min. Queste caratteristiche favorevoli potrebbero limitare la generalizzabilità del TTM trial nei contesti in
cui la maggior parte dei pazienti riceve un soccorso meno immediato sia da parte dei testimoni occasionali che da parte del
sistema sanitario di emergenza.
Il secondo studio, un trial preospedaliero di Kim et al.11, ha
randomizzato 1359 pazienti rianimati da OHCA non traumatico per ricevere o meno subito dopo il ROSC un’infusione endovenosa rapida di 2000 ml di soluzione salina a 4°C mediante spremisacca a pressione, con l’obiettivo di raggiungere una
temperatura corporea inferiore a 34°C prima dell’arrivo in ospedale. Entrambi i gruppi venivano successivamente trattati con
ipotermia. Al termine dello studio non sono state dimostrate
differenze tra i due gruppi in termini di sopravvivenza alla dimissione ospedaliera e di recupero neurologico alla dimissione.
Diversi motivi possono essere addotti per spiegare questo risultato. Una prima spiegazione coinvolge l’utilità stessa dell’ipotermia terapeutica a 34°C, attualmente in discussione dopo la pubblicazione dei risultati del TTM trial. Se abbassare la
temperatura corporea centrale fino a 32-34°C non produce effetti favorevoli sulla prognosi dei pazienti rianimati da arresto
cardiaco, allo stesso modo il raggiungimento più rapido di questo target di temperatura non dovrebbe conferire alcun vantaggio aggiuntivo. Va osservato che, malgrado gli studi sull’animale indichino come un’ipotermia più precoce rispetto al
tempo dell’arresto cardiaco sembri ridurre l’entità del danno
anossico, non esiste ancora prova negli studi sull’uomo che il timing dell’ipotermia influenzi la prognosi.
Nell’opposta ipotesi che un’induzione più rapida dell’ipotermia possa comunque conferire benefici sulla prognosi, la
mancata dimostrazione di questi nel trial di Kim et al. potrebbe essere dovuta ad un’incompleta implementazione dell’intervento: va notato infatti che in questo studio l’intero volume
di 2000 ml di cristalloidi è stato somministrato soltanto nel
50% dei pazienti nel braccio trattamento prima dell’arrivo in
ospedale e che il 4% dei pazienti con OHCA da FV ed il 7% di
quelli con OHCA non da FV non lo ha ricevuto affatto. Questo
si è risolto in un raggiungimento della temperatura target all’arrivo in ospedale solo del 23% in più in termini di percentuale assoluta tra i pazienti nel gruppo trattamento rispetto a
quelli del gruppo di controllo (28 vs 5%). Allo stesso modo, la
differenza di 1.3h (4.2 vs 5.5) nel tempo di raggiungimento
della temperatura target osservata nel braccio trattamento,
140
G ITAL CARDIOL | VOL 15 | MARZO 2014
benché statisticamente significativa, potrebbe essere stata insufficiente a determinare i supposti benefici attesi dell’intervento.
È infine possibile che tali potenziali benefici possano essere stati controbilanciati dagli effetti collaterali legati alle particolari modalità con cui l’intervento si era realizzato: infatti l’infusione rapida di cristalloidi nel trial si era associata ad una
maggiore incidenza di edema polmonare documentato all’Rx
torace ed a deterioramento degli scambi gassosi, verosimilmente legati a sovraccarico idrico. Particolarmente allarmante
è la piccola ma significativa differenza in termini di maggiore incidenza di riarresto nel braccio trattamento (26 vs 21%,
p=0.008), le cui cause non sono note ma che potrebbero essere
anch’esse in qualche modo legate all’intervento. In sostanza,
l’infusione di ampi volumi di cristalloidi freddi nell’immediato
post-ROSC potrebbe non essere il sistema migliore per l’induzione dell’ipotermia in ambito preospedaliero.
In conclusione, quali indicazioni possiamo trarre per la gestione dei nostri pazienti dai due studi appena conclusi? Il messaggio principale è che i protocolli per l’induzione ed il mantenimento dell’ipotermia nei pazienti adulti privi di coscienza dopo essere stati rianimati da un arresto cardiaco extraospedaliero dovrebbero essere rivisti. In particolare, l’induzione preospedaliera di ipotermia mediante l’infusione rapida di grandi volumi di cristalloidi freddi non appare giustificata, in quanto non
ha dimostrato benefici ed è gravata da potenziali effetti collaterali. Una volta in ospedale, lo stretto controllo della temperatura corporea centrale per le prime 24h ad una temperatura
di 36°C è equivalente ad un analogo mantenimento a 33°C.
Sul modello del TTM trial, il mantenimento di un valore centrale della temperatura corporea a 37.5°C fino a 3 giorni dall’arresto nei pazienti che restano in coma dopo il riscaldamento appare consigliabile, in considerazione degli effetti sfavorevoli dell’ipertermia in presenza di danno cerebrale anossico.
BIBLIOGRAFIA
1. McNally B, Robb R, Mehta M, et al.; Centers for Disease Control and Prevention. Out-of-hospital cardiac arrest surveillance Cardiac Arrest Registry to Enhance Survival (CARES), United States,
October 1, 2005–December 31, 2010. MMWR Surveill Summ
2011;60:1-18.
2. Nolan JP, Laver SR, Welch CA, Harrison DA, Gupta V, Rowan K.
Outcome following admission to UK intensive care units after cardiac arrest: a secondary analysis of the ICNARC Case Mix Programme Database. Anaesthesia 2007;62:1207-16.
3. Laver S, Farrow C, Turner D, Nolan J. Mode of death after admission to an intensive care unit following cardiac arrest. Intensive
Care Med 2004;30:2126-8.
4. Stiell IG, Nichol G, Leroux BG, et al.; ROC Investigators. Early
versus later rhythm analysis in patients with out-of-hospital cardiac
arrest. N Engl J Med 2011;365:787-97.
5. Hypothermia After Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002;346:549-56.
6. Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose
survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002;346:557-63.
7. Nolan JP, Morley PT, Hoek TL, Hickey RW. Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life Support Task Force of the International Liaison
Committee on Resuscitation. Resuscitation 2003;57:231-5.
8. Wolfrum S, Radke PW, Pischon T, Willich SN, Schunkert H,
Kurowski V. Mild therapeutic hypothermia after cardiac arrest - a
IPOTERMIA POST-ARRESTO CARDIACO
nationwide survey on the implementation of the ILCOR guidelines
in German intensive care units. Resuscitation 2007;72:207-13.
9. Binks AC, Murphy RE, Prout RE, et al. Therapeutic hypothermia
after cardiac arrest - implementation in UK intensive care units.
Anaesthesia 2010;65:260-5.
10. Nielsen N, Wetterslev J, Cronberg T, et al.; TTM Trial Investigators. Targeted temperature management at 33°C versus 36°C after cardiac arrest. N Engl J Med 2013;369:2197-206.
11. Kim F, Nichol G, Maynard C, et al. Effect of prehospital induction of mild hypothermia on survival and neurological status among
adults with cardiac arrest: a randomized clinical trial. JAMA 2014;
311:45-52.
glioramento della sopravvivenza dopo OHCA (da fibrillazione
ventricolare [FV] o tachicardia ventricolare senza polso) in due
studi randomizzati su 352 e 77 pazienti, pubblicati nel 20029,10.
Seppur l’ipotermia terapeutica avrebbe effetti neuroprotettivi
pleiotropici legati alla riduzione del danno da ischemia-riperfusione ed alla limitazione del danno da stress ossidativo, tuttavia i veri meccanismi con cui produce effetti protettivi sarebbero per lo più poco noti. Inoltre, sono molte altre le domande
che rimangono ancora senza risposta riguardo a questo ausilio
terapeutico, ed in particolare:
•
•
IL PUNTO DI VISTA DI ALFONSO IELASI
In Italia, l’incidenza dell’arresto cardiaco extraospedaliero (outof-hospital cardiac arrest, OHCA) è di 27 casi ogni 100 000 abitanti per anno1 e la sua principale causa è rappresentata dall’ischemia miocardica2. L’OHCA è associato ad un’elevata mortalità, tanto che meno del 10% dei pazienti che lo presentano,
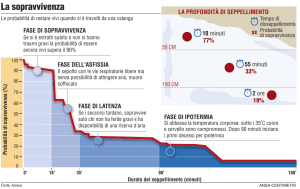
sopravvivono fino alla dimissione ospedaliera (Figura 1)3,4 e tra
questi, circa il 30% presenta danni neurologici post-anossici di
diverso grado di severità5. La drammaticità di eventi associata
all’OHCA e la rapidità della sua evoluzione letale hanno indotto le società scientifiche a sviluppare delle direttive per il trattamento di questa tragica evenienza mediante l’adozione della cosiddetta “catena della sopravvivenza”6,7. In questa, si trovano protagonisti i testimoni dell’OHCA (che dovrebbero attivare i sistemi di soccorso avanzato ed iniziare immediatamente la rianimazione cardiopolmonare di base e l’eventuale defibrillazione esterna con dispositivo semiautomatico ove possibile), ed a seguire i sistemi di soccorso del 118 con il personale
adibito alla rianimazione cardiopolmonare avanzata. Il ritardo
e/o l’inefficacia di una delle sequenze della catena può compromettere l’esito del soccorso e dunque il ripristino del circolo spontaneo (ROSC) che costituisce il target iniziale nel trattamento del paziente con OHCA. Ammesso che si ottenga il
ROSC, a quel punto l’obiettivo fondamentale è costituito dalla
limitazione del danno neurologico ottimizzando il supporto rianimatorio cardiopolmonare8.
L’ipotermia terapeutica, ossia la riduzione indotta e controllata della temperatura corporea a 32-34°C per 12-24h è
l’unico intervento post-ROSC che è stato associato ad un mi-
Δ=60%
Δ=75%
Δ=30%
Figura 1. Curva di sopravvivenza ideale dopo arresto cardiaco extraospedaliero. L’immagine dimostra che la maggior riduzione di sopravvivenza si ha nella fase ospedaliera durante la quale decede il
75% dei pazienti inizialmente rianimati con ripristino di circolo spontaneo (ROSC).
Modificata da Kern4.
•
•
•
siamo certi del reale beneficio dell’ipotermia terapeutica dopo ROSC in pazienti con OHCA da FV?
l’ipotermia terapeutica è altrimenti efficace anche in pazienti con OHCA da asistolia o attività elettrica senza polso?
esiste un metodo di raffreddamento più efficace di un altro?
il beneficio dell’ipotermia terapeutica è maggiore quanto
più è iniziata precocemente e quanto più rapidamente si
raggiunge il target termico?
qual è la durata ottimale ed il target di temperatura del raffreddamento?
In questo contesto i recenti trial clinici di Kim et al.11 e Nielsen et al.12 (TTM trial) contribuiscono a fornire delle risposte e
creare al contempo qualche dubbio.
Nello studio di Kim et al.11, un totale di 1359 pazienti in
stato di incoscienza dopo OHCA non traumatico (di cui 583
con FV e 776 senza FV) sono stati randomizzati al raffreddamento (temperatura target di 34°C) preospedaliero ottenuto
somministrando fino a 2 litri di soluzione salina a 4°C per via
endovenosa il più precocemente dopo ROSC o a controllo (solo raffreddamento ospedaliero). L’obiettivo dello studio è stato quello di verificare l’impatto del raffreddamento preospedaliero sulla sopravvivenza e sullo stato neurologico alla dimissione. I risultati del trial ci dicono che seppur la temperatura
target sia stata raggiunta più rapidamente sia nei pazienti con
FV che in quelli senza, raffreddati già nella fase preospedaliera (4.2 vs 5.5h, p<0.001, 4.0 vs 3.0h, p<0.001), tuttavia questo non si è tradotto in un miglioramento della sopravvivenza
rispetto il gruppo di controllo sia per pazienti con FV (62.7 vs
64.3%, p=0.69) che per quelli senza (19.2 vs 16.3%, p=0.30).
Inoltre, non si sono rilevate differenze significative anche in
termini di stato neurologico alla dimissione tra i due gruppi
confrontati.
Per quale motivo l’induzione dell’ipotermia terapeutica
preospedaliera, seppur più precoce nel determinare il raggiungimento del target termico, non si è associata ad un miglioramento della sopravvivenza? Appare ragionevole che tanto più
rapida possa essere l’induzione dell’ipotermia terapeutica, tanto maggiore possa essere la protezione verso gli effetti dannosi successivi alla riperfusione cerebrale dopo ROSC. Infatti, studi condotti su modelli animali hanno dimostrato gli effetti benefici dell’ipotermia terapeutica quando indotta precocemente dopo ROSC13,14. Tuttavia, in questi modelli, gli effetti positivi dell’induzione precoce erano dimostrabili solo in caso di raffreddamento immediato dopo ROSC13 o addirittura in caso di
raffreddamento già durante l’arresto (ancor prima del ROSC)14
mentre non erano evidenti quando il raffreddamento veniva indotto ad 1h piuttosto che a 4h dopo ROSC. In linea con questi
risultati, lo studio di Kim et al.11 sottolinea come raggiungere il
target termico di raffreddamento a 4h piuttosto che a 5h non
influenza né la sopravvivenza né lo stato neurologico. Altro
G ITAL CARDIOL | VOL 15 | MARZO 2014
141
M MASSETTI ET AL
aspetto da evidenziare di questo studio è l’evidenza di un più
elevato riscontro di segni radiografici di edema polmonare
(p<0.001) nonché di una minore saturazione ematica in ossigeno all’arrivo (p=0.02) nel gruppo di induzione preospedaliera dell’ipotermia terapeutica rispetto al gruppo di controllo.
Questi aspetti potrebbero essere riconducibili più al metodo di
raffreddamento, ossia la rapida infusione e.v. fino a 2 litri di soluzione salina fredda, che essere interpretati come un effetto indesiderato dell’ipotermia terapeutica di per sé. A supporto di
tale ipotesi vi sono dati sul modello animale che documentano
come gli effetti emodinamici negativi siano secondari all’infusione rapida di elevati volumi di soluzione salina raffreddata ma
non all’infusione di volumi di liquidi più contenuti15. A tal proposito è ragionevole ipotizzare che il rapido sovraccarico di volume possa indurre effetti emodinamici negativi in alcuni specifici sottogruppi di pazienti rianimati dopo AHCA con particolare riferimento a quelli con sottostante disfunzione ventricolare sinistra e/o coronaropatia (dato peraltro non riportato nello
studio).
Questa considerazione lascia dunque ancora aperta la questione relativa al miglior metodo di induzione dell’ipotermia
terapeutica. A tal riguardo sono attualmente disponibili diversi dispositivi di raffreddamento come quelli esterni, intravascolare o intranasale, che consentono il raffreddamento senza
determinare un sovraccarico emodinamico improvviso. Tuttavia non è ad oggi noto quale di questi risulti il più efficace e sicuro.
Altro importante trial randomizzato, pubblicato di recente
da Nielsen et al.12, ha avuto come obiettivo quello di provare a
definire se l’ipotermia terapeutica (indotta con metodo intravascolare o di superficie) con un target terapeutico minore
(33°C rispetto 36°C) fosse associata ad una maggiore sopravvivenza nel follow-up, in pazienti comatosi con ROSC dopo
OHCA (indipendentemente dal ritmo) da presunta causa cardiaca. In totale, sono stati randomizzati 939 pazienti (473 nel
gruppo 33°C vs 466 nel gruppo 36°C). Al termine del followup previsto da protocollo non sono state riportate differenze
significative sia in termini di mortalità (50 vs 48%, p=0.51) che
in termini di mortalità e recupero neurologico a 180 giorni (54
vs 52%, p=0.78).
Pur trattandosi di uno studio condotto in maniera meticolosa e moderna, i suoi risultati sembrerebbero tuttavia contraddire quelli di studi precedenti. Rispetto a questi, tuttavia, lo
studio di Nielsen et al.12 aveva pochi criteri di esclusione (20%
circa non OHCA e ritmo non defibrillabile), e considerando
l’eterogeneità della popolazione di pazienti con OHCA ed il fatto che i rischi/benefici dell’ipotermia terapeutica potrebbero
non risultare analoghi per tutti i sottogruppi16, ciò si potrebbe
tradurre in una perdita parziale degli effetti benefici del raffreddamento per uno specifico gruppo di pazienti piuttosto che
per un altro. Tuttavia, un aspetto molto importante che emerge da questo trial è quello relativo al possibile effetto che il controllo attivo della temperatura (ottenuto mantenendo la stessa
al di sotto di 37.5°C fino a 72h dopo ROSC) possa avere sui
buoni risultati ottenuti in termini di sopravvivenza assoluta indipendentemente dal target termico considerato (33° vs 36°C).
L’induzione dell’ipotermia terapeutica potrebbe essere dunque
quantomeno utile nel prevenire gli effetti indesiderati dell’ipertermia ed influenzare in qualche modo l’outcome.
Seppur entrambi i trial siano risultati negativi nel dimostrare un beneficio dell’ipotermia terapeutica in pazienti con ROSC
dopo OHCA, tuttavia è importante sottolineare l’elevata quali-
142
G ITAL CARDIOL | VOL 15 | MARZO 2014
tà ed efficacia delle moderne ed aggressive cure intensive fornite nel contesto dove sono stati effettuati i due studi. La bontà dei protocolli terapeutici dal territorio all’ospedale si è riflessa infatti nel miglioramento, rispetto ai vecchi trial sull’ipotermia terapeutica del 2002, dei risultati in termini di sopravvivenza e recupero neurologico soprattutto per i pazienti con
OHCA da FV. Il 64% circa di questi pazienti è sopravvissuto al
ricovero (rispetto al 51.1%10 e al 59%9) ed il 58% ne è uscito
neurologicamente indenne (rispetto al 34.8%10 e al 55%9).
Questi risultati appaiono molto importanti considerando il tipo
di pazienti trattati.
In attesa che futuri trial forniscano risposte a domande
fondamentali sui potenziali benefici dell’ipotermia terapeutica nell’OHCA, sembra attualmente presto per abbandonare
una metodica per il cui sviluppo ed attuazione sono state investite notevoli risorse umane ed economiche. La cura del paziente con ROSC dopo OHCA continua a rappresentare infatti una delle più complesse terapie da attuare ed il trattamento preospedaliero con o senza ipotermia terapeutica è una parte limitata ma di estrema importanza di quella “catena della
sopravvivenza” su cui è fondamentale investire con l’obiettivo
unico e solo di migliorare ulteriormente la prognosi dei pazienti con OHCA.
BIBLIOGRAFIA
1. Fabbri A, Marchesini G, Spada M, et al. Monitoring intervention programmes for out-of-hospital cardiac arrest in a mixed urban
and rural setting. Resuscitation 2006;71:180-7.
2. Jolly SS, Shenkman H, Brieger D, et al.; GRACE Investigators.
Quantitative troponin and death, cardiogenic shock, cardiac arrest
and new heart failure in patients with non-ST-segment elevation
acute coronary syndromes (NSTE ACS): insights from the Global
Registry of Acute Coronary Events. Heart 2011;97:197-202.
3. Nichol G, Thomas E, Callaway CW, et al.; Resuscitation Outcomes Consortium Investigators. Regional variation in out-of-hospital cardiac arrest incidence and outcome. JAMA 2008;300:142331.
4. Kern KB. Optimal treatment of patients surviving out-of-hospital cardiac arrest. JACC Cardiovasc Interv 2012;5:597-605.
5. Nolan JP. Optimizing outcome after cardiac arrest. Curr Opin Crit
Care 2011;17:520-6.
6. Nolan JP, Hazinski MF, Billi JE, et al. Part 1: Executive summary:
2010 International Consensus on Cardiopulmonary Resuscitation
and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation 2010;81(Suppl 1):e1-25.
7. Peberdy MA, Callaway CW, Neumar RW, et al. Part 9: post-cardiac arrest care: 2010 American Heart Association Guidelines for
Cardiopulmonary Resuscitation and Emergency Cardiovascular
Care. Circulation 2010;122(18 Suppl 3):S768-86.
8. Nolan JP, Neumar RW, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A scientific statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology;
the Council on Stroke. Resuscitation 2008;79:350-79.
9. Hypothermia After Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac
arrest. N Engl J Med 2002;346:549-56.
10. Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose
survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002;346:557-63.
11. Kim F, Nichol G, Maynard C, et al. Effect of prehospital induc-
IPOTERMIA POST-ARRESTO CARDIACO
tion of mild hypothermia on survival and neurological status among
adults with cardiac arrest: a randomized clinical trial. JAMA 2014;
311:45-52.
12. Nielsen N, Wetterslev J, Cronberg T, et al.; TTM Trial Investigators. Targeted temperature management at 33°C versus 36°C after cardiac arrest. N Engl J Med 2013;369:2197-206.
13. Che D, Li L, Kopil CM, Liu Z, Guo W, Neumar RW. Impact of
therapeutic hypothermia onset and duration on survival, neurologic function, and neurodegeneration after cardiac arrest. Crit
Care Med 2011;39:1423-30.
14. Abella BS, Zhao D, Alvarado J, Hamann K, Vanden Hoek TL,
Becker LB. Intra-arrest cooling improves outcomes in a murine cardiac arrest model. Circulation 2004;109:2786-91.
15. Yannopoulos D, Zviman M, Castro V, et al. Intra-cardiopulmonary resuscitation hypothermia with and without volume loading in an ischemic model of cardiac arrest. Circulation 2009;120:
1426-35.
16. Penela D, Magaldi M, Fontanals J, et al. Hypothermia in acute
coronary syndrome: brain salvage versus stent thrombosis? J Am
Coll Cardiol 2013;61:686-7.
G ITAL CARDIOL | VOL 15 | MARZO 2014
143