Classificazione delle proteine (1)
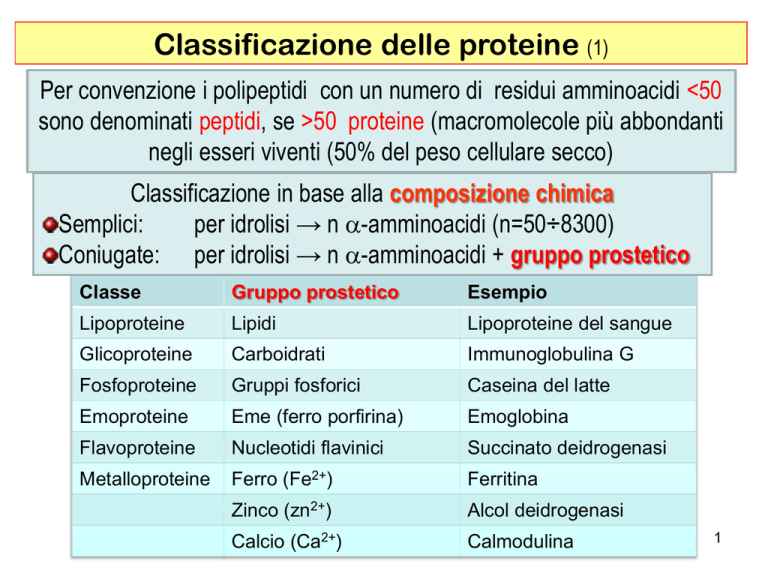
Per convenzione i polipeptidi con un numero di residui amminoacidi <50
sono denominati peptidi, se >50 proteine (macromolecole più abbondanti
negli esseri viventi (50% del peso cellulare secco)
Classificazione in base alla composizione chimica
Semplici:
per idrolisi → n a-amminoacidi (n=50÷8300)
Coniugate: per idrolisi → n a-amminoacidi + gruppo prostetico
Classe
Gruppo prostetico
Esempio
Lipoproteine
Lipidi
Lipoproteine del sangue
Glicoproteine
Carboidrati
Immunoglobulina G
Fosfoproteine
Gruppi fosforici
Caseina del latte
Emoproteine
Eme (ferro porfirina)
Emoglobina
Flavoproteine
Nucleotidi flavinici
Succinato deidrogenasi
Metalloproteine
Ferro (Fe2+)
Ferritina
Zinco (zn2+)
Alcol deidrogenasi
Calcio (Ca2+)
Calmodulina
1
Classificazione delle proteine (2)
Classificazione in base loro funzione biologica e forma
Funzione biologica
Esempio
a) Azione a livello
molecolare
Catalisi enzimatica
Trasporto
Nutrimento e riserva
Difesa
Controllo della crescita
Controllo espressione genica
~ 2000 enzimi diversi
Hb, Mb, permeasi
ovalbumina, caseina
anticorpi, fibrinogeno
ormoni
repressori, attivatori
b) Materiale
strutturale
Tendini e cartilagini
Legamenti
Capelli, unghie, piume
collageno
elastina
a-cheratine
c) Movimento
Muscoli
Microtuboli
actina, miosina
Tubulina
Forma
Esempio
Fibrose
Materiale strutturale (b)
Movimento (c)
collageno, a-cheratine
actina, miosina
Globulari
Azione a livello molecolare (a)
enzimi, anticorpi,ormoni
2
Struttura delle proteine
La struttura primaria è costituita dalla sequenza di amminoacidi legati tra loro
da legami peptidici covalenti e eventualmente, se presenti, da ponti disolfuro.
La risultante catena polipeptidica a causa delle interazioni dei suoi residui
amminoacidici intracatena e intercatena può avvolgersi (folding) e formare
strutture più complesse (struttura secondaria, terziaria e quaternaria)
3
Struttura primaria (1)
I ponti disolfuro possono essere intracatena o intercatena e possono
essere rotti da agenti riducenti (es: b-mercaptoetanolo).
Nel secondo caso la proteina oligomerica si scinde in subunità
S
SH
S
SH
+ 2HS-CH2-CH2-OH →
+
S
SH
S
SH
S-CH2-CH2-OH
S-CH2-CH2-OH
4
Struttura primaria (2)
Mutazioni puntiformi del DNA possono essere conservative o non conservative
Mutazioni conservative
Mutazioni non conservative
Sostituzione di uno o più amminoacidi con
caratteristiche simili (polare con polare o
apolare con apolare) senza nessuna
sensibile conseguenza
Sostituzione di uno o più amminoacidi con
caratteristiche diverse (polare con apolare o
viceversa) con conseguenze positive
(adattamento evolutivo) o negative (anomalie
funzionali, vedi tabella)
Malattia
Effetti fisiologici
Enzima o proteina colpita
Fibrosi cistica
Anormale secrezione nei polmoni
Canali per il cloro
Malattia di Lesch-Nyhan
Deficienze neurologiche, automutilazioni
Ipoxantina-guanina fosforibosil
trasferasi
Immunodeficienza
Mancanza di risposta immunitaria
Adenosina deaminasi
Gotta
Sovrapproduzione di acido urico (artrite)
Fosforibosil pirofosfato sintetasi
Anemia falciforme
Dolori e edemi alle mani e piedi
Emoglobina
5
Struttura primaria (3)
Struttura primaria & evoluzione
Dal confronto delle sequenze
amminoacidiche di proteine
omologhe si è risaliti all’albero
evolutivo delle specie
6
Struttura secondaria (1)
Sulla base delle possibili rotazioni intorno ai legami Ca-N (Y) e Ca-C (F) sono state
determinate teoricamente le conformazioni che conferiscono massima stabilità alla catena
Grafico di Ramachandran
7
Struttura secondaria (2)
Struttura a-elica
Ogni gruppo C=O e NH del legame peptidico si trova nella posizione giusta per formare
legami idrogeno intracatena
I residui laterali R
si trovano
all’esterno dell’a-elica
L’a-elica può essere
destrogira o levogira
8
Struttura secondaria (3)
Asp
-CH2-COO-
Arg
-(CH2)3-NH-C=NH2+
NH2
Restrizioni alla stabilità dell’a-elica
Repulsione (o attrazione) elettrostatica tra i residui
amminoacidici (gruppi laterali R) carichi, adiacenti o
spaziati di 3-4 residui
Impedimento sterico di gruppi R voluminosi
Presenza di prolina
manca la libera rotazione Ca-N
manca l’H libero per formare il legame idrogeno
Interazione tra gruppi R carichi alle estremità dell’elica
e il dipolo elettrico generato dalla struttura
9
Struttura secondaria (4)
Presenza dell’a-elica nelle proteine globulari
Es: mioglobina ed emoglobina (78% di struttura a-elica)
10
Struttura secondaria (5)
Presenza dell’a-elica nelle proteine fibrose
Le a-cheratine
sono prodotte
dalle cellule
epidermiche.
Sono presenti nei
capelli, lana, peli,
unghie,corna,
piume, gusci di
tartaruga
Es: a-cheratina dei capelli
L’ insolubilità è dovuta alla predominanza di gruppi R non polari.
Le a-eliche sono tenute insieme da ponti disolfuro intercatena:
più sono numerosi più la struttura è resistente
(nel guscio di tartaruga e nelle corna di rinoceronte il 18% dei gruppi R
sono cisteine impegnate in ponti disolfuro)
11
Struttura secondaria (6)
Il collageno: una proteina fibrosa costituita da un’a-elica particolare
12
Collagene (1)
E’ la proteina più abbondante nei mammiferi
(30% delle proteine totali)
Tutte le varie forme di collagene hanno una
composizione amminoacidica ripetitiva di glicina
(35%) con alte percentuali di prolina e
idrossiprolina (21%), tutti amminoacidi non
essenziali (basso valore nutrizionale)
Il collagene è composto da tre eliche
sinistrorse (catene a da non
confondere con le a-eliche delle
cheratine) superavvolte a formare
una triplice elica destrorsa.
L’alto contenuto di questi residui
conferisce alla triplice elica
13
Collagene (2)
Struttura è molto compatta e non elastica a causa dei numerosi residui di
glicina che trovano posto all’interno della spirale e della prolina che crea
delle anse che ne impediscono l’allungamento.
La sostituzione di un solo residuo di
Gly con Lys o Ser causa
l‘osteogenesi imperfetta e la
sindrome di Ehlers-Danlos
14
Collagene (3)
*
coda
testa
I legami trasversali tra i
filamenti di tropocollagene aumentano la
resistenza meccanica
della struttura
(superiore a un filo di
acciaio di pari spessore)
Inibita dai semi di
lathyrus odoratus:
latirismo
(anomalie nelle ossa e
giunzioni)
L’entità dei legami dipende dalla funzione
biologica e dall’età del tessuto
Numero legami
Rigidità e fragilità fibrille
Sezione di una molecola di tropocollageno
(unità base del collageno)
Fragilità ossea
Opacità cornea
15
Biosintesi del collagene: un esempio di modificazioni post-traduzionali (1)
Fe2+
L’ascorbato
(vitamina C)
previene
l’ossidazione del Fe2+
Se carente può
causare lo scorbuto
(malattia dei marinai)
Fibroblasto
*Se carente nei bovini causa una
malattia del tessuto connettivo
“la dermatospassia”
*
P. Champe, Zanichelli Editore S.p.A. Copyright © 2006
16
Biosintesi del collagene: un esempio di modificazioni post-traduzionali (2)
P. Champe, Zanichelli Editore S.p.A. Copyright © 2006
17
Struttura secondaria (7)
Struttura b o foglietto ripiegato (b-cheratine)
Ogni gruppo C=O e NH del legame peptidico forma legami idrogeno intercatena
I residui laterali R sono piccoli e idrofobici e si trovano sopra e sotto il piano della molecola
Struttura prevalente nelle proteine fibrose
Legami idrogeno intercatena
Struttura prevalente nelle proteine globulari
Legami idrogeno intracatena
18
Struttura secondaria (8)
Le catene sono più distese rispetto all’a-elica: stirando una catena a-elica si ottiene una
struttura b (la distanza tra due amminoacidi è 3.5 Å contro 1,5 Å dell’a-elica)
Sfruttando questa proprietà si ottiene la
“permanente dei capelli”
a-cheratina
b-cheratina
a-cheratina
19
Struttura secondaria (9)
Le b-cheratine sono prevalentemente proteine insolubili
flessibili e non allungabili
Es: fibroina della seta e della tela di ragno
Residui piccoli e idrofobici
disposti alternativamente sopra e
sotto la struttura a zig zag
Fili di fibroina
estrusi dalla
filiera di un ragno
20
Struttura secondaria (10)
Tabella riassuntiva delle proteine fibrose con struttura secondaria
Struttura
Caratteristiche
Esempi
a-elica,con ponti
disolfuro intercatena
Strutture dure e
insolubili di varie
resistenza e flessibilità
a-cheratine dei capelli,
penne e unghie
Struttura b
Filamenti flessibili
Fibroina della seta
Tripla elica del
collagene
Molto resistente alla
tensione, senza
elasticità
Collagene dei tendini,
della matrice delle ossa
21
Struttura secondaria (11)
La struttura b è presente anche nelle proteine globulari
Le proteine globulari con zone a struttura b
sono possibili grazie ai ripiegamenti b
il gruppo carbonilici del 1°amminoacido
forma un legame idrogeno con il gruppo
amminico del 4° residuo.
I residui coinvolti sono glicina e prolina,
il primo perché piccolo e flessibile, il
secondo perché il legame peptidico con
l’azoto imminico della prolina assume
la configurazione cis, una forma che si
adatta al cambio di direzione.
Il ripiegamento parallelo è meno probabile
22
Struttura terziaria (1)
La struttura terziaria consiste in un ripiegamento della catena (folding)
per formare una struttura tridimensionale ben definita (conformazione)
Esempi di proteine globulari
con domini a struttura a e b
Il folding comporta un compattamento
delle dimensioni (Es: albumina bovina
con 584 residui amminoacidici)
Parti lontane della catena
vengono a trovarsi
spazialmente vicine
creando siti specifici di
riconoscimento per
particolari molecole
Es:
Enzima-Substrato
AnticorpoAntigene
Recettore-Ormone
Emoglobina-Ossigeno
Statisticamente una
proteina
globulare contiene:
50-60% a-elica
25-35% struttura b
15% struttura disordinata
23
Struttura terziaria (2)
La sequenza amminoacidica è la base molecolare dell’attività biologica
Sequenza
(Struttura primaria )
Conformazione
(Struttura terziaria )
Funzione
24
Struttura terziaria (3)
Interazioni che concorrono al folding e alla stabilizzazione delle proteine
Tutti questi legami concorrono alla
formazione della struttura terziaria
In genere i residui polari si
dispongono rivolti verso la superficie
a contatto con H2O, mentre quelli
apolari all’interno della proteina
25
Struttura terziaria (4)
Esperimento di Anfinsen
Denaturazione e
rinaturazione della ribonucleasi
allontanamento del mercapto-etanolo
Stato inattivo con ponti disolfuro
non corretti (es: cys 58 con cys 95)
aggiunta di mercapto-etanolo e successivo
allontanamento di mercapto-etanolo e urea
Questo esperimento dimostra che:
La sequenza specifica la
conformazione e quindi
l’attività biologica
La conformazione è funzione
dell’ambiente
La conformazione nativa è quella
termodinamicamente più stabile (minor
contenuto energetico)
26
Struttura terziaria (5)
Alcune proteine hanno un ripiegamento assistito da chaperoni e chaperonine
I chaperoni (es: DnaK e DnaJ nell’e-coli) si
legano in via transitoria alla proteina non
ripiegata impedendo un folding prematuro
Le proteine parzialmente ripiegate
dai chaperoni vengono
successivamente ripiegate dalle
chaperonine
27
Struttura terziaria (6)
Molte proteine hanno un ripiegamento assistito da due enzimi (PDI e PPI)
La Proteina Disolfuro Isomerasi (PDI)
è un enzima che rimuove ponti disolfuro
non corretti (caso a) e facilita la
formazione di quelli corretti (caso b)
La Peptide Prolil cis-trans Isomerasi (PPI)
catalizza la interconversione dei legami
peptidici cis-trans della prolina
28
Struttura terziaria (7)
Morte per ripiegamento sbagliato: le malattie da “prione”
PrP
PrPSc
I prioni (PrP) sono delle normali proteine presenti nel
cervello degli organismi superiori la cui funzione non è nota.
Per eventi ancora non completamente chiariti la proteina
può modificare un tratto della sua struttura da a-elica a
foglietto b (PrPSc) innescando un processo a cascata che
porta alla completa trasformazione di tutti i PrPc in PrPSc.
Il PrPSc non subisce degradazione proteolitica (turnover
proteico) e si accumula nel tessuto cerebrale determinando
una degenerazione spongiforme che porta a lungo termine a
forme di demenza e morte (BSE o mucca pazza nei bovini,
scrapie negli ovini, morbo di Creutzfeld-Jacob nell’uomo)
Il termine “Prione” è stato introdotta da
Stanley Prusiner nel 1984
Prion (Proteinaceus infections only)
Sc in PrPSc = Scrapie
Sezione colorata
di corteccia
cerebrale
spongiforme
29
Struttura quaternaria delle proteine (1)
L a struttura quaternaria deriva dalle interazioni deboli (identiche a quelle che stabilizzano la
struttura terziaria) che si stabiliscono tra più catene polipeptidiche (subunità) identiche o
diverse per dare complessi proteici tridimensionali chiamati oligomeri o multimeri
se il numero delle subunità è molto elevato
Struttura quaternaria della
emoglobina: oligomero con
quattro subunità a due a due
identiche (a2b2)
Rivestimento proteico
icoesaedrico di molti virus
sferici (poliovirus, rinovirus).
L’icoesaedro è un poliedro
regolare a 12 vertici con 20
facce a triangolo equilatero.
Multimero con subunità
identiche autoaggreganti
(risparmio di materiale
genomico)
30
Struttura quaternaria delle proteine (2)
Vi sono dei limiti alle dimensioni delle proteine
E’ più semplice ed efficace sintetizzare molte copie di una proteina piccola che una sola
copia di una proteina molto grande
La maggior parte delle proteine che hanno massa superiore a 100.000 possiedono più
subunità, uguali o diverse, per evitare la formazione di proteine danneggiate (diminuisce
la probabilità di errori durante la sintesi proteica)
Esempi di proteine con struttura quaternaria
Peso
molecolare
Numero
subunità
Emoglobina
64.000
4
Piruvatochinasi
240.000
4
Istidina decarbossilasi
190.000
10
Glutammina sintetasi E. coli
619.000
12
Proteina del capside del poliovirus
5.500.000
130
Proteina del capside virus mosaico tabacco
40.590.000
2.130
Proteina
31
Struttura & funzione delle proteine
Interazione proteina-legando
Le subunità di molte proteine oligomeriche, per azione di un ligando vanno incontro ad un
adattamento indotto che provoca una modificazione conformazionale che permette
all’intera proteina di svolgere una determinata funzione biologica
(Es: trasporto ossigeno, attività enzimatica, risposta immunitaria, contrazione muscolare)
Sito di
legame
Ligando
Proteina
oligomerica
Adattamento
indotto
Proteine allosteriche
(Emoglobina, enzimi allosterici)
Modificazione
conformazionale
Sistema immunitario
(Antigene-Anticorpo)
Motori molecolari
(Contrazione muscolare)
32
Emoglobina: un esempio di proteina allosterica (1)
La mioglobina (Mb) e le singole catene a e b dell’emoglobina
(Hb) hanno una struttura terziaria molto simile idonea a legare
reversibilmente O2 al Fe+2 senza ossidarlo a Fe+3, grazie alla
tasca idrofobica in grado di alloggiare il gruppo eme
Mb
Hb
Voet, Zanichelli Editore S.p.A. Copyright © 2007
Questa somiglianza fa ipotizzare
che Mb e Hb derivino dallo
stesso gene ancestrale che nel
corso dell’evoluzione ha subito
modifiche indipendenti per
adattarsi alle esigenze
dell’organismo
33
Emoglobina: un esempio di proteina allosterica (2)
Differenze funzionali fra Mb e Hb
Hb rispetto a Mb è una proteina allosterica
Questo è frutto di due tipi di interazioni:
Interazioni omotropiche: il legame O2-Hb
facilita il legame di altro O2 alla stessa molecola
di Hb (legame cooperativo)
Interazioni eterotropiche: il legame con gli
H+, la CO2 (effetto Bohr) e il 2,3 difosfoglicerato
modificano l‘affinità di Hb con O2
Y
Y
siti occupati
siti totali
Champe, Zanichelli Editore S.p.A. Copyright © 2006
Funzione Hb: legare O2 nei polmoni e cederlo
ai tessuti per la fosforilazione ossidativa;
contemporaneamente legare CO2 nei tessuti e
rilasciarla a livello polmonare (600 litri/24 ore di
O2 e 400 litri/24 di CO2 valori che aumentano di
circa 10 volte durante l’attività muscolare)
Funzione Mb: legare O2 in eccesso trasportato
dall’Hb e rilasciarlo all’occorrenza
34
Emoglobina: un esempio di proteina allosterica (3)
Il sito di legame per O2
O2 si lega al 6° legame di coordinazione del Fe+2 in
modo non lineare a causa dell’ingombro sterico della
istidina distale con il vantaggio di rendere più difficile
il legame Hb-CO (nell’eme libero CO è 25.000 più
affine rispetto a O2 mentre nell’eme legato all’Hb è
solo 250 volte più affine)
Istidina distale
(E7-His 64)
Eme
Istidina
prossimale
(F8-His 93)
Istidina
prossimale
(F8-His 93)
35
Emoglobina: un esempio di proteina allosterica (4)
L’Hb deossigenata è irrigidita da otto legami ionici
tra le catene (ponti salini)
L’emoglobina esiste in due conformazioni in equilibrio:
Stato T (Tesa): forma deossigenata a bassa affinità per
O2 irrigidita da otto legami ionici
Stato R (Rilasciata): forma ossigenata ad alta affinità
per O2 senza legami ionici
36
Emoglobina: un esempio di proteina allosterica (5)
Cooperatività tra i siti (interazioni omotropiche)
Quando O2 si lega al Fe+2 nel primo dei quattro siti,
trova difficoltà per la presenza degli otto ponti salini.
In seguito a questo legame il Fe+2 entra nel piano
dell’eme (diminuisce di dimensioni passando da alto
spin a basso spin) e trascina con se la catena F a
cui e legato tramite l’istidina prossimale (His F8)
Questo spostamento provoca
una modificazione della
conformazione che rompe i
ponti salini e sposta l’equilibrio
dallo stato T a quello R.
Ciò favorisce l’ingresso
successivo di O2 negli altri siti
(andamento sigmoide della
curva di saturazione Hb-O2)
Y
30
60
90
pO2 (mm Hg)
37
Emoglobina: un esempio di proteina allosterica (6)
Interazioni eterotropiche tra Hb, H+ e CO2 (Effetto Bohr)
Nei tessuti l’aumento della [CO2] porta ad una diminuzione del pH. I protoni liberati favoriscono
la formazione di coppie ioniche in particolare His 146 - Asp 94 che stabilizzano la forma T
CO2 + H2O → HCO3- + H+
Inoltre la CO2 si lega direttamente ai gruppi
amminici liberi della Hb formando carbammati
che stabilizzano ulteriormente la forma T
38
Stryer, Zanichelli Editore S.p.A. Copyright © 2006
Emoglobina: un esempio di proteina allosterica (2)
Trasporto di O2 e CO2
5%
85%
10%
*Hb-NHCOO-
*
*
39
Emoglobina: un esempio di proteina allosterica (2)
Trasporto di CO2 e lo scambiatore cloruro-bicarbonato
40
Stryer, Zanichelli Editore S.p.A. Copyright © 2006
Emoglobina: un esempio di proteina allosterica (2)
Interazioni eterotropiche tra Hb e 2,3 difosfoglicerato (DPG o BPG)
Il 2,3DPG (un intermedio della glicolisi nel globulo rosso) con le sue 5 cariche negative si lega,
con altrettante cariche positive fornite dalle due subunità b, in una zona centrale dell’Hb
presente solo nello stato T. Per il principio di Le Chatellier l’equilibrio si sposta verso lo stato T
con conseguente diminuzione dell’affinità dell’Hb per O2.
Stato T
Stato R
41
Emoglobina: un esempio di proteina allosterica (4)
Effetto del 2,3-DPG sulla curva di saturazione Hb-O2
Hb “in vitro” (sangue conservato)
(0.5 mM 2,3-DPG)
Hb-O2 + DPG Hb-DPG + O2
Hb “in vivo”
(~4 mM 2,3-DPG)
Lo spostamento dell’equilibrio verso
l’emoglobina deossigenata, a causa
del DPG che si lega solo alla forma
T, diminuisce affinità di Hb per O2 e
aumenta sensibilmente l’efficienza
del trasporto di O2 come dimostrato
dalla curva di saturazione Hb-O2
più sigmoide e spostata verso
destra.
42
Emoglobina: un esempio di proteina allosterica (4)
Adattamento ad alta quota e ipossia
pO2 nei
tessuti
pO2 nei
polmoni
(4500 m)
66%
pO2 nei
polmoni
(0 m)
4mM DPG
8mM DPG
66%
20
60
Aumentando la concentrazione di
2,3-DPG nel sangue, aumenta
ulteriormente l’efficienza del
trasporto. Quando si va in alta
quota (>4000m) dopo poche ore
aumenta [DPG] per adattare la
respirazione alla minore pressione
di ossigeno. Una situazione
analoga si crea in soggetti che
soffrono di ipossia dovuta ad una
minore ossigenazione dei tessuti
periferici per un cattivo
funzionamento dei polmoni o del
sistema circolatorio
100
43
Emoglobina: un esempio di proteina allosterica (4)
Emoglobina fetale (HbF) e DPG
HbF (a2g2) non lega DPG perché His 143 (carica ),
presente nel sito di legame del DPG della catena β, è
sostituita da Ser (neutra) nella catena g.
Ne consegue che il sangue fetale, avendo una affinità
per O2 maggiore del sangue adulto (a2b2), “strappa”
O2 al sangue materno attraverso la placenta
98%
2%
44
Anemia falciforme: un esempio di malattia molecolare
Le proprietà di molte proteine possono
variare in seguito a modificazioni non
conservative della sequenza
amminoacidica e causare malattie
Nell’anemia falciforme questo tipo di
mutazione sulle catene b di Hb ha invece
portato ad un vantaggio. Gli individui con
un solo allele di HbS hanno una maggior
resistenza alla malaria (il plasmodio ha più
difficoltà a nutrirsi e riprodursi nel globulo
rosso con HbS)
Un approccio terapeutico consiste nel
mantenere l’equilibrio dell’HbS verso la
forma R che non polimerizza (aumento del
pH del sangue con bicarbonato e
ossigenazione dei polmoni )
45
Interazioni proteine-ligandi & sistema immunitario (1)
Componenti molecolari del sistema immunitario
Antigene (Ag, Antibody generator): molecola
o parte di molecola in grado di indurre una
risposta immunitaria
Anticorpo (Ab, Antibody): proteina che
riconosce specificamente un antigene
Leucociti (globuli bianchi)
Macrofagi (ingestione per fagocitosi)
Linfociti B (producono e secernono Ab)
Linfociti TC (cellule killer)
Linfociti TH (cellule Helper)
Risposta immunitaria
Anticorpale o Umorale (dal latino humor = fluido)
Produzione di Ab solubili che circolano nel sangue.
Sono immunoglobuline (Ig) prodotte dai linfociti B
nel midollo osseo (Bone marrow).
Ab si lega a Ag e il complesso Ab-Ag precipita la
sostanza estranea (con l’aiuto del complemento) o
la marca per la distruzione (nei macrofagi)
Cellulare
Produzione di cellule T citossiche,TC (così
chiamate in quanto l’ultima fase del loro
differenziamento avviene nel Timo)
46
Interazioni proteine-ligando & sistema immunitario (2)
IgG: immunoproteina più importante e abbondante
del sistema immunitario
Frammento
che lega
l’antigene
(antigen
binding)
Frammento
cristallizzabile
47
Interazioni proteine-ligando & sistema immunitario (3)
Le immunoglubuline G sono molto flessibili
La molecola di IgG è molto flessibile per adattarsi ai diversi determinanti antigenici presenti
sulla superficie dell’antigene e formare aggregati facilmente riconoscibili dai macrofagi.
Per avere risposta immunitaria di piccole molecole (apteni) si aggiunge un coadiuvante
Un determinante
antigenico
Tre determinanti
antigenici
Due determinanti
antigenici
48
Interazioni proteine-ligando & sistema immunitario (4)
Esempi di azione coordinata IgG e macrofagi
Fagocitosi di un virus
Fagocitosi di un batterio
49
Interazioni proteine-ligando & sistema immunitario (5)
Attivazione delle cellule B
Ogni linea di linfociti B
produce un solo tipo di Ig
• Nei linfociti B non attivi
(vergini o memoria), Ig si
presentano nella forma
insolubile nella membrana,
ed hanno la funzione di
recettore per Ag
• Nei linfociti B attivi, Ig si
presentano nella forma
solubile secreta, ed hanno
la funzione di attaccare Ag
50
Interazioni proteine-ligando & sistema immunitario (6)
La selezione clonale
Cellule B effettrici o plasmacellule
producono Ig solubili nel sangue
La cellula staminale si diversifica in
numerose cellule B “vergini”, ognuna
con una Ig diversa, e con il sito
antigenico verso l’esterno
Il contatto con uno specifico Ag genera
la replica di un solo clone e produce
numerose cellule B contenenti solo
quella Ig
51
Interazione tra proteine modulata dall’energia chimica
(1)
Miosina
Filamento spesso
Actina
Filamento sottile
F-actina (Fibrosa)
G-actina
(Globulare)
52
Interazione tra proteine modulata dall’energia chimica
(2)
53
Interazione tra proteine modulata dall’energia chimica
(3)
La contrazione muscolare è innescata da un rapido aumento citosolico di Ca2+
I tubuli T (Trasversi) trasmettono il potenziale
d’azione, innescato da uno stimolo del SNC,
che apre in pochi millisecondi i canali del Ca 2+
sul reticolo sarcoplasmatico. L’ingresso del
Ca 2+ nel citosol è temporaneo perché dopo
circa 30 msec è pompato indietro dalla pompa
Ca2+-ATPasi
54
Interazione tra proteine modulata dall’energia chimica
(4)
La contrazione muscolare innescata da Ca2+ è mediata da proteine accessorie
La tropomiosina e le troponine T, I, C, (chiamate così per la loro attività rispettivamente di
legame alla Tropomiosina, Inibitrice e di legame del Ca 2+), sono proteine accessorie
strettamente associate ai filamenti sottili di actina. La tropomiosina, una molecola disposta
lungo le scanalature dell’elica dell’actina, quando è legata con la troponina I maschera il sito di
legame della miosina con l’actina. Quando la troponina C si lega a Ca2+, va incontro ad un
cambiamento conformazionale che si trasmette alla tropomiosina, inducendola a staccarsi
dalla troponina I e a muoversi verso il centro dell’elica del filamento sottile di actina. In questo
modo i siti di legame sull’actina si rendono disponibili al legame con la testa della miosina,
permettendo la contrazione.
55












