IMMUNOLOGIA DELLA
RIPRODUZIONE
Applicazioni terapeutiche con
Immunofarmacologia Omeopatica
Dr. Angelo Micozzi
Il ”feto semiallogenico”
Il “dilemma” della gravidanza
Il SI materno deve ottemperare a 2
esigenze contrapposte :
• Tolleranza verso il feto, a livello uterino
• Mantenere una immunocompetenza a livello
sistemico
L’insuccesso gravidico ed il parto
pre-termine non sono evenienze rare
♦ Circa il 10 % delle nascite sono pre-termine
♦ Frequenza di interruzioni precoci di gravidanza dopo l’impianto = 31 %
♦ Abortività spontanea (interruzione della gravidanza clinicamente
evidente prima della 20a settimana) = 1 / 4
♦ 40-60 % di poliabortività ricorrente (≥ 3 aborti, prima della 20a sett.) è
attribuibile a cause note (anomalie cromosomiche, endocrine,
infezioni, fattori umorali, problemi anatomici)
♦ 40- 60 % da cause ignote (immunologiche ?)
Medawar & Billingham, Nature, 1953
♦ 4 ipotesi:
– Concetto di perdita di immunogenicità
– Significativa riduzione della risposta immunitaria in
gravidanza
– Utero come sito immunoprivilegiato
– Barriera immunitaria elaborata dalla placenta:
• La tolleranza al feto da parte della madre sembra essere
dovuta a un meccanismo attivo:
– Il tessuto fetale previene la ricognizione e quindi il rigetto
da parte del sistema immune materno
Moderne acquisizioni
♦ Il feto ha proprietà immunogene
Hoskin and Murgita Clin Exp Immunol 1989
♦ In gravidanza la RI materna non è depressa in modo significativo
– normale risposta alle vaccinazioni
– suscettibilità alle infezioni materne non aumentata
– grande numero di citochine Th1, monociti, LGL (NK),
linfociti γ/δ a livello dell’interfaccia materno-fetale
– cellule leucocitarie materne esprimono evidenti segnali di
attivazione
– il SI innato materno presenta evidenti segnali di attivazione
Sacks et al, immumnol Today, 1999
♦ Possibili gravidanze extra-uterine
Adattamenti materni:
premessa
♦ L’organismo materno va incontro a profonde modificazioni
nel corso della gravidanza
♦ Gli adattamenti sono locali, legati allo sviluppo dell’utero, di
altri apparati e di natura metabolica
♦ Gli adattamenti a distanza sono in larga misura determinati
dalla produzione di sostanze (progesterone) da parte della
placenta
Modificazioni dell’organismo materno in
gravidanza
1.
2.
3.
4.
5.
6.
7.
Aumento ponderale
Apparato genitale
Volume e composizione del sangue
Apparato cardiovascolare
Apparato urinario
Apparato digerente
Apparato muscolo-scheletrico
Incremento ponderale in gravidanza
12000
grasso
10000
liquidi extra
8000
sangue
6000
mammelle
4000
utero
placenta
2000
feto
0
10
20
30
40
settimane
1. Modificazioni dell’apparato genitale
♦ Aumento di volume dell’utero
♦ Rammollimento della cervice
♦ Proliferazione delle ghiandole endocervicali
12 sett
24 sett
40 sett
9
8
7
6
5
4
3
2
2. Modificazioni del volume e della
composizione del sangue
♦ Aumento volemia
– Aumento del volume plasmatico
– Aumento della massa eritrocitaria
♦ Diminuzione osmolarità
♦ Aumento leucociti
♦ Aumento VES
♦ Aumento lipidi circolanti
♦ Diminuzione della glicemia
3. Modificazioni dell’apparato
cardiovascolare
♦ Modificazione della posizione del cuore per elevazione del
♦
♦
♦
♦
diaframma
Aumento di volume del cuore (circa 75 ml)
Deviazione asse elettrico (verso sinistra 15-28 gradi)
Aumento della frequenza cardiaca e della gettata cardiaca
Riduzione della pressione arteriosa (sviluppo del circolo
placentare)
Portata del circolo utero-placentare a termine
500 ml/min
Compressione della vena cava in
posizione supina nella donna gravida
UTERO
GRAVIDO
cuore
Vena cava
Edemi in gravidanza
♦ Ritenzione di sodio e idrica
♦ Diminuzione della osmolarità ematica
Edema
declive
improntabile
80% delle
gravide
Varici in gravidanza
♦ Aumento della volemia
♦ Congestione dei genitali interni
♦ Diminuzione del tono venoso
4. Modificazioni dell’apparato urinario
♦ Dilatazione ureterale più marcata a destra (atonia e
fattori compressivi)
♦ Aumento della filtrazione glomerulare con
diminuzione di creatinina, urea e acido urico
♦ Glicosuria
♦ Ritenzione di sodio/idrica
Idroureteronefrosi in gravidanza
• Compressione da parte
dell’utero gravido
• Distensione uretere
indotta dal
progesterone
Gravidanza e infezione delle vie urinarie
♦ Infezioni delle vie urinarie sono frequenti in gravidanza
♦ Infezioni delle basse vie (cistiti) sono spesso complicate da
infezioni delle alte vie (cistopieliti/pielonefriti) che si associano
ad un rischio molto aumentato di parto prematuro
♦ In gravidanza, l’esame urine va controllato ogni mese; in caso di
dubbio urinocultura
5. Modificazioni dell’apparato digerente
♦ Frequenti disturbi digestivi
♦ Nausea/vomito (iperemesi gravidica)
♦ Scialorrea
♦ Pirosi (rilasciamento del cardias con reflusso gastro-
esofageo)
♦ Motilità intestinale diminuita con stipsi
Modificazioni dell’apparato scheletrico
Feto 3500 gr
Liquido
amniotico
900 gr
Placenta
500 gr
Ipertrofia utero
1000 gr
Patologie ‘orfane’
♦ Patologie rare
♦ Patologie frequenti ma (considerate) di scarso rilievo
– Iperemesi gravidica
– Algie lombari e pelviche in gravidanza
La fecondazione
1. I PROTAGONISTI
Spermatozoo
Oocita
Non so, caro Y
Sei tu la mia X?
Y
X
Wow!
X
X
Y
Vai pure, ho mal
di testa!
X
Ciao, caro...!
X
Y
Sono un piccolo
felice marinaio
L’adesione spermatozoica
alla superficie ovocitaria
La fecondazione
Attraversamento della
zona radiata
Riconoscimento speciespecifico e legame con
la zona pellucida
Reazione acrosomiale e
fusione delle membrane
2. Le tappe
L’inizio dell’embrione
Penetrazione della zona pellucida
Singamia (punto di non ritorno)
Nascita di una nuova cellula: da ovocita a
zigote o embrione unicellulare)
sistema unico con identità specifica ed
orientamento verso uno sviluppo
determinato
Attivazione dell’oocita
Avvicinamento dei due pronuclei (36h)
Cariogamia (nuovo genoma) (15h)
Il nuovo genoma
Contiene l’informazione essenziale e permanente per la graduale,
autonoma realizzazione dello sviluppo morfogenetico
Tutte le fasi della morfogenesi dipendono dall’espressione dei geni
propri dell’embrione (interazione con ambiente cellulare ed
extracellulare)
Regola e dirige il processo di sviluppo grazie all’espressione
coordinata e gerarchicamente ordinata di migliaia di geni (geni
regolatori: di posizione, selezione, realizzatori)
Determina l’appartenenza dello zigote alla specie umana e la sua
singolarità individuale o identità
Entrata dello spermatozoo
fecondazione
morula
Blastocisti – 2 +5 sett
Annidamento –3+0/+1 sett
La vita embrionale
♦ Zigote
♦ Blastomeri
♦ Morula
♦ Blastocisti
♦ Embrione
♦ Feto
♦ 58-cellule blastocisti
♦ 107-cellule blastocisti
♦ Biologia del trofoblasto
– Adesione del trofoblasto alla decidua dell’utero
– Nutrizione del prodotto del concepimento
– Funzione endocrina per la gravidanza
♦ Differenziazione
– Cellulare, sinciziale/ uninucleare, multinucleare
♦ Formazione del Sincizio
– I citotrofoblasti sono i progenitori cellulari del
sinciziotrofoblasto
citotrofoblasto
sinciziotrofoblasto
Cellule uninucleari
Cellule giganti multinucleari
margini cellulari
Ben demarcati
Non definiti
nucleo
singolo, distinto
Multiplo e diverso
presente
assente
Cellula germinale
cititrofoblasto
morfologia
figura miotica
Origine
♦ Intrusione del citotrofoblasto tra le cellule epiteliali dell’endometrio,
dopo apposizione e adesione
♦ Degradazione della matrice extracellulare di endometrio/decidua,
catalizzata da:
• Attivatore del plasminogeno urokinasi/tipo
• Recettore di attivatore del plasminogeno urokinasi/tipo
• Metalloproteinasi molteplici
♦ Tali funzioni sono indistinguibili da quelle delle cellule maligne
metastatizzanti
♦ impianto
– Moore
La vita embrionale
(Dal 2° al 5° giorno dalla fecondazione)
• Inizio
segmentazione
• 8-32 cellule: Morula
(2°- 4° giorno)
• 64-128 cellule:
Blastocisti (5° giorno)
La vita embrionale
Stadi embriologici
zigote, morula, blastula, gastrula, embrione
Foglietti (si formano durante la gastrulazione)
Blue = ectoderma ; rosso = mesoderma; giallo = endoderma
La vita embrionale
Dalla blastocisti al disco embrionale
6°-7°giorno ---> inizio del processo dell’impianto;
14°giorno --> formazione della stria primitiva (si definisce il disegno
generale del corpo, punto di inizio del modellamento dei differenti organi e
tessuti)
Dal disco embrionale al feto
4°settimana --->
5°settimana --->
organogenesi ed inizio circolazione
6°settimana --->
7°settimana --->
9°settimana --->
primordi degli arti
strutture primitive cuore, cervello, tratti polmonari
gastroenterici ed urinari inizio differenziazione sessuale
forma del corpo completa
maturazione ed accrescimento organismico
Foglietti embrionali
Ectoderma
1. Cute e derivati;
2. Sistema nervoso
Endoderma
1. Tratto digestivo e respiratorio
2. Organi derivati dall’intestino: fegato, pancreas, tiroide
Mesoderma
1. Muscoli e ossa
2. Tessuto vascolare: cuore, vasi e sangue
3. Organi escretori e riproduttivi
Stadi successivi di sviluppo
Embrione: stadi tra zigote e feto
Embriogenesi
2 6
10
5 weeks
13
20
30 mm
10 weeks
Feto: da 8 settimane in poi
10 settimane di amenorrea: termine del
periodo embrionale/inizio periodo fetale
lunghezza vertice sacro 34 mm
Embriogenesi
♦ I primi due mesi di sviluppo del prodotto di
concepimento (10 settimane di amenorrea)
♦ In questo periodo si configura la morfologia della
maggior parte degli organi
♦ In questo periodo si determina la maggior parte delle
malformazioni (difetti di struttura)
Embriogenesi: sintesi
♦ E’ un processo molto rapido (2 mesi) che si manifesta in modo molto
omogeneo in tutte le gravidanze
♦ Durante questo periodo il prodotto di concepimento è particolarmente
vulnerabile all’azione di teratogeni
♦ Lo sviluppo intrauterino rappresenta comunque un continuum ed
anomalie anatomiche/funzionali possono verificarsi per tutta la durata
della gravdianza
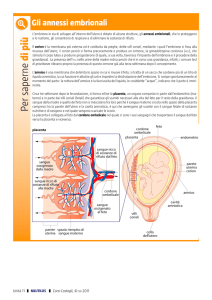
Placenta : sito immunologicamente “attivo” per l’induzione
di uno stato di tolleranza immunologica verso il feto
Petraglia et al, 1996
Gravidanza nelle sue fasi iniziali come processo bifasico
1a fase :
Reazione locale “inflammatory-like” indispensabile per
l’adesione e l’invasione del trofoblasto nei tessuti materni
2a fase :
Modulazione anti-infiammatoria per la preservazione del
sistema feto-placentare
Meccanismi di tolleranza del SI materno verso il feto
♦ Locali
–
(cellulari e umorali)
modificazioni dell’assetto immunologico
all’interfaccia materno-fetale
♦ Sistemici
–
–
(cellulari e umorali)
Modificazioni del sistema immunitario materno a
livello sistemico sotto l’influenza di ormoni e CK
(ruolo del microchimerismo)
Fattori locali
L’interfaccia materno-fetale : “un campo di battaglia”
♦ 2 tipidi di linee cellulari :
– deciduali (cellule stromali endometriali modificate)
– trofoblastiche (cellule parenchimali placentari)
♦ Diversi fattori regolatori
–
–
–
–
Chemochine, citochine
Ormoni
Fattori di crescita
Strutture antigeniche
trofoblasto
♦ Immunità adattativa
♦ Immunità innata
decidua
Organizzazione
del trofoblasto
3 tipi di cellule diversamente esposte
all’ambiente materno
♦ Citotrofoblasto villoso
separato dai
tessuti materni dal sinciziotrofoblasto
♦ Citotrofoblasto extravilloso (costituito
da cellule attivamente proliferanti che
invadono la decidua ed il miometrio e
formeranno le membrane coriali)
rimpiazzando in gran parte l’endotelio
delle arterie spirali materne (trofoblasto
endovascolare)
♦ Sinciziotrofoblasto
riveste il citotrofoblasto villoso ed è in
continuo contatto con il sangue
materno
Alla 20a sett. la superficie
totale del trofoblasto è pari a
circa 15 m2
Sistema HLA
♦ Le cellule del citotrofoblasto extravilloso esprimono solo molecole
HLA-G, HLA-E e in misura ridotta anche HLA-C
♦ Nessuna sottopopolazione del trofoblasto esprime Ag HLA di
classe II (DR)
♦ Il sinciziotrofoblasto non espone molecole HLA di membrana
♦ Elevati livelli di sHLA-G nella circolazione materna durante la
gravidanza
RICONOSCIMENTO DELL’ANTIGENE :
- linfociti B
antigene in forma nativa
-linfociti T
antigene processato da
cellule accessorie
(cellule presentanti
l’antigene )
Le APC (=Antigen Presenting Cell)
“PROFESSIONISTE” presentano l’antigene processato
ai linfociti T associato alle molecole MHC
recettore MHC legante
l’antigene processato in peptidi
Cellula
dendritica
Macrofago
Linfocita B
PRESENTAZIONE DELL’ANTIGENE CAPTATO DALL’ESTERNO
E PROCESSATO DA PARTE DELLE CELLULE DENDRITICHE
Cellula
dendritica
MHC-II
Antigene
processato
MHC-I
Antigene
processato
Linfocita T helper e suoi
recettori e co-recettori
per l’antigene
Linfocita T citotossico,
suoi recettori per
l'antigene e co-recettori
CD8
Le molecole
MHC-I presentano
l’ Ag ai T citotossici
Le molecole
MHC-II presentano
l’ Ag ai T helper
MOLECOLE MHC
struttura
e
genetica
IL COMPLESSO GENETICO MHC VENNE INIZIALMENTE IDENTIFICATO
COME REGIONE GENETICA CHE CONTROLLAVA IL RIGETTO DEI TRAPIANTI
TRA TOPI DI CEPPI INBRED DIVERSI (Snell-1940)
Benacerraf e McDevitt scoprirono tra gli
anni 1960/1970 che il complesso MHC
controllava anche la RISPOSTA
ANTICORPALE contro determinati
antigeni proteici, ed era diversa a seconda
degli alleli MHC di ciascun ceppo
Questo perchè alcuni peptidi li legavano
e generavano rispost aT helper, altri no
Regione MHC nell’uomo e nel topo
centromero
centromero
telomero
telomero
centromero
Regione MHC nell’uomo
telomero
Collocazione dei geni MHC e dei geni
MHC-relati sui cromosomi umani
NOMENCLATURA HLA
Nomenclature of human leukocyte antigen (HLA) loci and alleles
Nomenclature
Definition
HLA
The HLA region and prefix for an HLA gene
HLA-DRB1
A particular HLA locus (i.e., DRB1)
HLA-DRB1*13
A group of alleles that encode the DR13 antigen defined
serologically by microlymphocytotoxicity or by mixed lymphocyte reactivity
HLA-DRB1*1301
A specific HLA allele
HLA-DRB1*1301N
A null allele (i.e., nonexpressed)
HLA-DRB1*13012
An allele that differs by a synonymous mutation (i.e., identical amino acid
encoded by a different codon)
HLA-DRB1*1301102
An allele that contains a mutation outside the coding region
HLA-DRB1*1301102N
A null allele that contains a mutation outside the coding region
© 2003 by LIPPINCOTT WILLIAMS & WILKINS
I geni MHC sono espressi in maniera codominante
STRUTTURA SCHEMATICA DELLE MOLECOLE
MHC CLASSICHE
Secondo la regola: 1 gene-1 catena polipeptidica
-1 gene per la catena α
- 1 gene per la catena β
STRUTTURA DEL TCR
T cell recognition of a peptide-MHC complex. This schematic illustration shows an MHC molecule binding and displaying
a peptide and a T cell receptor recognizing two polymorphic residues of the MHC molecule and one residue of the peptide.
Details of the interactions among peptides, MHC molecules, and T cell receptors are described in Chapters 4, 5, and 6.
Lista degli alleli HLA di classe II
Lista degli alleli HLA di classe I
Molecole classiche HLA class Ia altamente
polimorfiche
HLA-A10
HLA-B12
HLA-Cw5
HLA-A3
HLA-B5
HLA-Cw7
HLA-A23
HLA-B12
HLA-Cw1
HLA-A11
HLA-B16
HLA-Cw8
HLA-A25
HLA-B40
HLA-Cw2
HLA-A26
HLA-B8
HLA-Cw5
HLA-A2
HLA-B27
HLA-Cw6
HLA-A28
HLA-B17
HLA-Cw5
HLA-A19
HLA-B14
HLA-Cw8
HLA-A19
HLA-B15
HLA-Cw2
HLA-A25
HLA-B12
HLA-Cw1
HLA-A24
HLA-B8
HLA-Cw4
HLA class Ib non classiche sono molecule quasi
monomorfiche
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
HLA-G
HLA-E
HLA-F
Ipotesi/concettiper spiegare la tolleranza
materna verso il feto
♦ HLA/HLA-G espressione dal trofoblasto
♦ Bilancio Th1/Th2
♦ Cellule regolatorie CD4+CD25+
♦ Altri
–
–
–
–
–
–
–
–
Leukemia inhibitory factor (LIF)
Indoleamine 2,3-dioxygenase (IDO)
Macrofagi soppressori
Ormoni
CD95 e suoi ligandi
Annexin II
Diminuita attività del complemento
Antigeni nascosti del trofoblasto
(Thellin et al, review 2000)
HLA in gravidanza
Placenta – HLA class Ib
HLA-Gm, -Em, -Fm, -Cm
HLA-Gp, -Ep, -Fp, -Cp
Madre – HLA class Ia
HLA-Am, -Bm, -Cm
HLA-Am, -Bm, -Cm
Human Leucocyte Antigen (HLA) system
Major Histocompatibility Complex (MHC)
DP
DQ DR
class II
Feto – HLA class Ia
HLA-Am, -Bm, -Cm
HLA-Ap, -Bp, -Cp
m = materno
p = paterno
B C
class III
E
class I
Chromosome 6
HLA class Ia and II (-A, -B, -C, -DR etc):
HLA class Ib (-G, -E, -F):
A G F
HLA-G espressione nel blastocisti
♦ HLA-G espressione può essere facilmente osservata
nel blastocisti
IVF = in vitro fertilization
Pre-impianto embrione umano (o blastocisti)
espressione di HLA-G: privilegio immunitario per il
trofoblasto e la cellula tumorale. Luogo funzionale della tolleranza
HLA-G e successo di IVF
♦ La percentuale di gravidanza in donne con embrione
trasferito da colture, in cui HLA-G solubile è presente,
è significativamente più frequente delle colture
negative per la forma solubile (Fuzzi et al 2002, Sher et al
2004, Noci et al 2005, Yie et al 2005)
♦ La percentuale di aborto spontaneo è più alta nelle
donne HLA-G negative, che in quelle positive
(Yie et al 2005)
Funzioni delle molecole HLA di classe I del trofoblasto
♦ Protezione del feto dalla madre
– legame inibitorio con recettori delle cellule immunocompetenti
materne (NK, M, T)
♦ Protezione del feto da infezioni
– Mantenimento delle funzioni di presentazione antigenica HLAristretta al sistema immunocompetente
Espressione HLA-G
HLA-G
Decidua
Ancoraggio dei villi
HLA-G
Citocheratina
(12.-13. settimane di gestazione)
(Emmer et al. Human Reproduction 2002; 17:1072)
♦ HLA-G positivo (tessuto normale):
– Placenta,
– dedicua (sHLA-G)
– Timo, alcuni monociti e cellule T e sporadicamente altri
tessuti
Geni HLA-G, mRNA, proteine, isoforme
0
1
2
3
codon 31: ACG/TCG (G*0103)
codon 93: CAC/CAT (G*010102/0105N/0106)
codon 107: GGA/GGT (G*010103)
codon 110: CTC/ATC (G*0104)
Trans1597delC (G*0105N)
codon 258: ACG/ATG (G*0106)
membrane
HLA-G gene
Signal
peptide
α1-domain
Exon 1
2
α2-domain
α3-domain
3
4
4 kb
Cytoplasmic
domain
region
5
3’ UTR
6
7
8 AATAAA
TGA
(nt 3741)
TCTAAA
5’-A TTTGTTCA TGCCT-3’
14-bp deletion polymorphism
CCAAT
HLA-G mRNA
STOP codon
STOP codon
STOP codon
5’ e1 e2 e3 e4 e5 e6 e8 3’ 5’ e1 e2 e4 e5 e6 e8 3’ 5’ e1 e2 e5 e6 e8 3’ 5’ e1 e2 e3 e5 e6 e8 3’ 5’ e1 e2 e3 e4 i4 e5 e6 e8 3’ 5’ e1 e2 e4 i4 e5 e6 e8 3’ 5’ e1 i2
Full-length
Exon 3 spliced out
Exons 3 and 4
spliced out
Exon 4 spliced out
Retains intron 4
Retains intron 4,
exon 3 spliced out
Retains intron 2
HLA-G protein
α3
α3
α2 α1
α1
HLA-G1
HLA-G2
α2
α1
α1
HLA-G3
HLA-G4
(membrane-bound isoforms)
α3
α3
α2 α1
α1
Soluble HLA-G5
α 1-domain
α 2-domain
β -2m
α3-domain
HLA-G1
HLA-G6
3’
α1
HLA-G7
Polimorfismo HLA-G
Threonin → Serin
Deletion of a cytosine
(codon 129/130)
frameshift
Leucin → Isoleucin
HLA-A
HLA-G
(After Ober & Aldrich, J Reprod Immunol 1997; 36:1-21 and Parham, Eur J Immunogenetics 1992; 19:347-359.
Based on work by Bjorkman et al, Nature 1987; 329:512-518).
HLA-G*0105N
♦ HLA-G*0105N è chiamato allele nullo, le cui
molecole di membrana e solubili non hanno
significato funzionale (non sono necessari per la
sopravvivenza del feto)
♦ I normali HLA-G2-G4 e G6-G7 sono invece codificati
come isoforme funzionali
(Sala et al 2004, Le Discorde et al 2005)
Funzioni di HLA-G
1) Attacco del blastocisti all’endometrio
•
HLA-G coinvolto nella adesione cellulare
(Ødum et al 1991)
2) Invasione del trofoblasto nel tessuto uterino e nelle
arterie spirali materne
•
HLA-G espresso da cellule endovascolari del trofoblasto e può
essere un modulatore dell’angiogenesi
(Le Bouteiller et al)
3) Interazione del trofoblasto con cellule effettrici
immunitarie della madre
•
HLA-G interagisce con recettori sulle cellule immunitarie
Cellula stimolatrice
Aumento risposta
allogenica-CTL
IL-10 ↓
TNF-α
α↑
INF-γγ ↑
HLADR4
T cellula di risposta
T cell
receptor
HLADR1
Inibizione di
allo-CTL
HLA-DR4
HLA-G
(Kapasi et al 2000)
HLA-G
IL-10 ↑
TNF-α
α↓
INF-γγ ↓
Aborto ricorrente e pre-eclampsia
Gravidanza normale
Aumento risposta
Th1,
Diminuzione Th2:
IL-2
INF-γ
(TNF-α)
Produzione
citochine Th2:
IL-4
IL-5
IL-10
IL-13
La bilancia Th1/Th2
HLA-G/sHLA-G???
Il successo di una gravidanza è correlato con la prevalenza
di risposte Th2, piuttosto che Th1
Il microambiente uterino
(cellule immunocompetenti a livello deciduale)
♦ Endometrio come “sito linfoide terziario” che contiene un rilevante numero
di cellule immunocompetenti
♦ Durante le prime fasi della gravidanza cambiano il numero e la distribuzione
dei leucociti uterini (T, NK, APC)
♦ Cellule NK popolazione dominante (homing selettivo e proliferazione in situ)
(Ruck et al, 1994 e Kammerer et al, 1999)
A livello della decidua predominano : uNK, MØ, T
poco rappresentati sono i granulociti e le cellule B
Cellule immunocompetenti a livello deciduale
• uNK (75 %) ≠ NK circolanti
– attività citolitica inibita dal legame delle molecole HLA-G, E e C ai
recettori inibitori KIR e lectin-like KIR
– svolgono una importante azione protettiva contro infezoni fetali
– Svolgono un ruolo citochino-mediato nella placentazione (G-CSF,
GM-CSF, N-CSF, LIF, TGFβ, TNFα, IFNγ);
– scompaiono al termine della gravidanza
– Azione immunomodulante
♦ T linfociti (1-3 %)
– non attaccano il citotrofoblasto extra-villoso
– predominano T linfociti γ/δ, di tipo Th2
♦ Monociti e Macrofagi (20-30 %)
– Svolgono azione difensiva anti-infettiva
– Sono importanti per la placentazione (TGFβ, TNFα, PGE)
– Fagocitano cellule apoptotiche (ruolo scavenger)
– Perdurano per tutta la gravidanza
Ruolo delle cellule uNK all’interfaccia materno-fetale
♦ Aumentano nelle prime fasi della gravidanza e si localizzano in stretta
prossimità dei processi di invasione deciduale del trofoblasto
♦ Sono regolate dagli ormoni della gravidanza (recettore-mediate o per azione indiretta da
parte di altri elementi cellulari)
− Diminuzione dell’attività citolitica
− Aumentata espressione di recettori inibitori (max entro il 3°mese)
♦
AZIONE IMMUNOMODULANTE
– galectina-1 : inibisce la proliferazione e la sopravvivenza delle cellule
T, riduce la produzione di TNFα, IL-2, IFNγ da parte di cellule T
attivate e la produzione di IL-12 da parte di macrofagi
– glicodelina (downregulation dell’attivazione T cellulare)
Moffett-King, Nat Rev Immunol, 2002
Dosiou & Giudice, 2005
Rabinovich et al, 2002
Logdberg & Wester, 2000
Ruolo dei macrofagi :
fenomeni di apoptosi placentare
♦ Una accurata regolazione dei meccanismi di apoptosi a livello placentare è
fondamentale per il successo della gravidanza
♦ La clearance dei “corpi apoptotici” a livello placentare rappresenta uno step
critico per l’omeostasi tessutale, prevenendo il rilascio di prodotti cellulari che
potrebbero innescare una risposta infiammatoria indesiderata
Abrahams et al, 2004
Macrofagi come elementi regolatori locali (CK,
ormoni) delle interazioni cellulari e tessutali all’
interfaccia materno- fetale
Macrofagi :
Nelle fasi iniziali della gravidanza c’è un elevato
numero di MØ nel sito di impianto :
– RI della madre contro l’invasione del trofoblasto ?
– azione “scavenger” dei corpi apoptotici ?
Il legame e l’ingestione di
materiale apoptotico da parte
dei macrofagi determina un
effetto immuno-soppressivo
e anti-infiammatorio
Th2
Voll et al, 1997
Savill e Fadok, 2000
Duffield et al, 2001
Huynh et al, 2002
Mor & Abrahams, 2003
un eccesso di apoptosi
(eventi infetttivi ?) induce
attivazione in senso proinfiammatorio dei MØ
Th1
Cellule immunocompetenti a livello periferico
♦ In gravidanza aumenta il numero di leucociti
♦ Linfociti T : switch Th1 – Th2
♦ Cellule NK
(assoluto ? relativo ?)
(diminuiscono e producono meno IFNγ)
♦ Monociti e Granulociti (immunità innata)
– sono in uno stato di attivazione
Lo switch Th1 – Th2 non riguarda solo gli elementi linfocitari
di tipo Th ma anche e soprattutto i linfociti Tc, NK, NKT
CKCK-Th1 : IFNγ
IFNγ, TNFα
TNFα, TNFβ
TNFβ, ILIL-2
CKCK-Th2 : ILIL-4, ILIL-5, ILIL-6, ILIL-10 e ILIL-13
Il “clima citochinico” (tipo 1 o tipo 2) condiziona il destino
e l’attività delle cellule immunocompetenti effettrici
Funzioni di HLA-G
♦ Molti studi in vitro mostrano che HLA-G protegge dalla
lisi NK-mediata delle cellule
Maternal NK cell
KIR2DL4
CD94/NKG2
ILT-2/(-4)*)
sHLA-G
HLA-E
HLA-C
Maternal monocyte/
macrophage/lymphocyte
IL-10
?
HLA-G1
HLA-F (?)
Trophoblast cell
FETUS
Cell lysis
Influence, interact with or modulate
Secretion of the specific factor
HLA-G ↑
(influenced by
HLA-G genotype)
HLA-G ↓
Inhibition of
allo-CTL
response ?
IL-10 ??
TNF-α ↓
INF-γ ↓
TGF-β1 ↑
VEGF ↑
Augmentation of
allo-CTL response ?
IL-10 ??
TNF-α ↑
INF-γ ↑
T regulatory cells (Tregs)
♦ CD4+CD25bright(FoxP3+)
– CD4: co-recettore si
lega a MHC class II
– CD25: alpha-catena
– FoxP3: fattore
essenziale per la
differenziazione di
CD4+CD25+ Tregs
(Sasaki et al 2004)
♦ Tregs importanti per la prevenzione di malattie
autoimmuni
♦ Giocano ruoli fondamentali nella induzione di
tolleranza nei trapianti d’organo
HLA e aborto ricorrente (recurrent
miscarriage RM)
♦ Specifici alleli HLA-DR sono associati con aumentato rischio di RM
– Meta-analisi (18 studi caso-controllo):
HLA-DRB1*01 fattore di rischio
(Christiansen et al 1999)
– HLA-DRB1*03 fattore di rischio in pazienti con 4 o più aborti
(Kruse et al 2004)
Aborto Ricorrente Spontaneo
Prevalenza del profilo citochinico Th1
–
–
–
–
–
Hill et al, 1995
Marzi et al, 1996
Maksheed et al, 1999 & 2000
Raghupathy et al, 1999 & 2000
Polgar & Hill, 2002
• TNFα, IFNγ e IL-2 hanno effetti potenzialmente dannosi sul prodotto
del concepimento
• TNFα, IFNγ e IL-1 attivano l’espressione di attività pro-coagulante (upregulation di fgl2 che converte pro-trombina in trombina)
• TNFα e IFNγ inibiscono “in vitro” la crescita delle cellule trofoblastiche
umane e ne inducono l’apoptosi
Chaouat et al, 1990
Haimovici et al, 1991
Yui et al, 1994
Laird et al, 2003
Daher et al, 2004
HLA-G solubile nel plasma e nel siero
♦ sHLA-G può essere rilevato nel plasma di tutte le
donne (gravide e non)
♦ sHLA-G è rilevato nel siero e sporadicamente solo
nelle donne non gravide e negli uomini
Livelli di sHLA-G nel sangue materno (plasma)
♦ Sostanzialmente non cambiano durante il corso di
una normale gravidanza
♦ Sembrano essere simili tra donne gravide e non
♦ Ridotti livelli di sHLA-G nel plasma materno possono
essere associati a un alto rischio di pre-eclampsia,
aborto spontaneo e rottura placentare (sHLA-G < 9.95
ng/ml RR 7.1; 3 trim)
(Steinborn et al 2003)
Pre-eclampsia
♦ Seconda metà della gravidanza:
– ipertensione
– proteinuria
– (edema)
♦ 2-7% di tutte le gravidanza
♦ Ancora oggi diffusa causa di morte del feto e della madre
♦ Il feto può essere compromesso
– Ritardo crescita intrauterina, basso peso alla nascita,
prematurità, asfissia intrauterina
♦ Tra le cause: fattori immunogenetici costituzionali e fattori
ambientali
Sviluppo della sindrome clinica
♦ Fattori liberati dalla placenta alla
circolazione materna (citochiine
ed elementi cellulari del
trofoblasto) possonondare
disfunzione della cellula
endoteliale
• Ciò comporta vasocostrizione e
attivazine della coagulazione
•
I sintomi clinici dipendono da:
ipertensione (vasocostriztione),
proteinuria (disfunzione endoteliale
nei glomeruli) e
edema (aumento della permeabilità
Ulcerazione focale del sincizio alla
vascolare)
miscoscopia elettronica.
(da Fox: ”Pathology of the placenta” 2ed)
Fattori sistemici : ormoni
PROGESTERONE
- promuove la sintesi di LIF (fasi di impianto)
- induce rilascio di PIBF (progesterone-induced blocking factor : inibisce NK)
– induzione switch Th1 – Th2
– diminuzione della citotossicità delle NK
– inibizione rilascio ac. arachidonico dai linfociti
– blocco della sintesi prostaglandinica
– Riduzione produzione IL-12
ESTROGENI (dose-dipendente)
- [C] fisiologiche stimolano Th1 e Th2
- [C] soprafisiologiche (gravidanza) inducono soppressione sulla
risposta cellulo-mediata e induzione di quella umorale (switch Th1 -Th2)
Beta-HCG
- induzione dell’apoptosi delle cellule endometriali (FASL mediata)
- facilitazione dell’invasione delle cellule trofoblastiche
GLUCOCORTICOIDI (switch Th1-Th2)
Recenti acquisizioni
♦ Superfamiglia di proteine recettoriali
coinvolte nella risposta immune innata
anti-infettiva
♦ L’engagement dei TLR (espressi sul
citotrofoblasto : TLR-2 e TLR-4) da
parte di prodotti microbici induce una
risposta infiammatoria
• Produzione di IL-6, IL-8,
TNFα, IFNγ e attivazione
dell’apoptosi
• Possibile ruolo dei TLR nel
parto pre-termine, IUGR e
pre-eclampsia
Ampi studi
epidemiologici mostrano
che madre e feto
contribuiscono allo
sviluppo della preeclampsia (il feto
essendo influenzato dai
geni paterni
(Lie
et al 1998)
Perdita della gravidanza
♦ Perdita pre-clinica occulta
– Alterato sviluppo: l’uovo fecondato non si divide
– Disturbo di impianto: la blastocisti non si impianta
– Preclinica: disturbo dopo impianto
♦ Perdita clinica
– Embrionica: perdita prima della 9th settimana
– Fetale: perdita dopo la 9th settimana
– Aborto: perdita prima della 20th settimana
– Parto precoce: perdita dopo 20 settimane
Aborto ricorrente
autoimmunità
♦
Diagnosi
– Antiphospholipidi
–
–
1.
2.
3.
Anti Nucleo ANA
Anti tiroide
Anti-tireoglobulina
Anti-tireoperossidasi
Anti-recettore TSH
Anticorpi antisperma
♦ Cause
– Ostruzione fuoriuscita
dello sperma
– Trauma dei testicoli
– Malattie sessualmente
trasmesse
– Autoimmunità
polighiandolare
♦ Fertilità ridotta per azione di
anticorpi su spermatozoi
Anticorpi anti-sperma
♦ Alterano la longevità degli spermatozoi
♦ Alterano l’interazione muco-sperma e il trasporto
degli spermatozoi
♦ Anticorpi policlonali
– Legano molte differenti proteine spermatiche
♦ Possono essere presenti anche nel siero
Anticorpi anti-Ovario
Malattie sessualmente
trasmesse
Allergia
Med Pregl. 2002 Jul-Aug;55(7-8):305-8. Links
[Adaptation of the immune system as a response to
pregnancy] Milasinovic L
♦ The protective mechanisms are coded by genes of
MCH region, locus HLA-G.
♦ The placenta protects itself against antibodymediated damage. A high level of complementregulatory proteins (CD46, CD55), being the
response to the synthesis of complement-fixing
maternal antibodies to paternal antigens and
regulation of the placental HLA expression as a
preventive reaction of the feto-placental unit to the
influence of maternal CTL, are the most important
protective mechanisms of placenta.
Crit Rev Immunol. 1999;19(5-6):509-39. Links
Hard science versus phenomenology in reproductive
immunology. Clark DA
♦ Does HLA-G determine maternal tolerance of her
semi-allogeneic fetus?
♦ Does membrane cofactor protein (CD46) contribute
to pregnancy success by protecting sperm and fetal
trophoblast from complement-mediated lysis?
♦ Irrespective of whether one is dealing with
phenomena or hard science data, Hippocrates was
correct in his aphorism that "description is infinite and
easy; explanation is limited and difficult".
Anti-CD46 potenziata liquida 06-018030LM
♦ Una fiala una volta al giorno, seguendo la
numerazione
♦ Cicli intervallati da 7-14 giorni di sospensione
♦ Meccanismo di similitudine patogenetica
Anti-CD55 (anti-recettore)
♦ simile molecolare di coxsackie virus B-3; minaccia di aborto;
aborto ricorrente.
♦ Il CD55 è una molecola regolatrice del complemento, che
interviene nella interazione del trofoblasto con le cellule
immunitarie della madre, durante la gravidanza, onde prevenire
l’azione distruttiva del complemento. La molecola è anche
chiamata DAF (decay accelerating factor), ed è espressa sulla
superficie di polimorfonucleato, linfociti T e B e monociti. È stato
anche dimostrato che il CD55 agisce come recettore del
coxsackie virus B3, cardiovirulento. L’anticorpo monoclonale
corrispondente agisce come simile molecolare per questo
agente patogeno
Anti-CD55 potenziata liquida 06-018030LM
♦ Una fiala una volta al giorno, seguendo la
numerazione
♦ Cicli intervallati da 7-14 giorni di sospensione
♦ Meccanismo di similitudine patogenetica
CIAO!