CHIMICA, LEZIONE #1
Classificazione della materia
La materia di presenta in natura in 3 stati fisici:
• Stato gassoso;
• Stato liquido;
• Stato solido.
La formula chimica resta invariata al passare della materia da uno stato
all'altro.
La materia è tutto ciò che occupa un volume e ha massa.
MATERIA
SISTEMA
FISICAMENTE
OMOGENEO
(materia in un unico
stato fisico)
SISTEMA
CHIMICAMENTE
OMOGENEO
SISTEMA
FISICAMENTE
ETEROGENEO
(materia che si presenta
in più stati fisici)
SISTEMA
CHIMICAMENTE
ETEROGENEO
Ad esempio: l'aria.
ELEMENTI
COMPOSTI
N2 , O2 , P4 , S8 , Cl2 Specie chimiche composte da più
, Br2 , I2
elementi: H2O, CO2, NH3
L'atomo viene riportato con il simbolo dell'elemento corrispondente senza
pedice.
Più atomi legati formano una molecola, che può essere composta da più
elementi o da un solo elemento.
Storia e scoperta dell'atomo
Il termine “atomo” deriva dal greco ἄτομος – àtomos – che significa “non
divisibile”. Questa definizione fa riferimento alla filosofia dell'atomismo,
che considerava l'atomo come la parte fondamentale della materia. Tale tesi
risale al IV secolo A.C. e venne smentita soltanto a fine Ottocento con la
scoperta delle particelle subatomiche.
Esperienza di Thomson
Nel 1897 Joseph John Thomson, fisico inglese, al lavoro con i raggi
catodici, effettuò un esperimento con gli atomi.
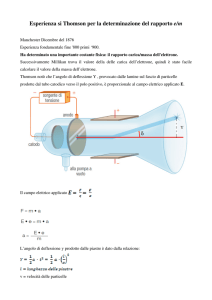
In un tubo catodico introdusse dell'idrogeno. Allorché, applicando una
tensione ∆V fra catodo (-) e anodo (+) vide un raggio catodico (linea
tratteggiata) stampigliarsi sul fondo del tubo. Un raggio catodico è un
fascio di elettroni che abbandona il metallo del catodo.
In seguito applicò quindi una seconda tensione ∆V sul raggio catodico
(zona in giallo) e notò che il raggio si spostò di ∆x- verso l'anodo. Se ne
dedusse quindi che il raggio avesse carica negativa (essendo attratto
dall'anodo) e, provenendo esso da atomi, che l'atomo avesse particelle
negative.
Aumentando la tensione ∆V vide apparire sul tubo anche un secondo
raggio, che non era altro che le particelle positive dell'atomo. Il raggio
catodico si era quindi scisso in due parti. Per analogia, è facile capire che il
raggio anodico tendeva verso il catodo elettrico, deviando di ∆x+ . Gli
spostamenti non erano però uguali, infatti risultava:
∆x- >> ∆x+
Lo spostamento ∆x era proporzionale a:
∆x ∝ e
(e carica elementare)
m
Che in riferimento alla relazione precedente, diventa:
e- >> e+
mm+
Poiché entrambi i raggi provengono da un atomo, che è una specie chimica
neutra, la carica elementare positiva e quella negativa si collidono,
annullandosi. È quindi logico scrivere:
1 >> 1
mm+
Per soddisfare questa relazione, è evidente che m- debba essere molto più
piccola di m+. Abbiamo dunque che:
m+ >> mScoperta dell'elettrone.
Nel 1909 il fisico statunitense Millikan riuscì a stabilire la massa
dell'elettrone in 9,1 * 10 -28 g.
Modelli atomici.
Thomson allora cercò di accertare la struttura dell'atomo.
Modello atomico di Thomson
Immaginò che l'atomo fosse costituito da una sorta di gelatina, avente
carica positiva, nella quale fossero inglobati gli elettroni (modello a
panettone, per l'analogia con l'uvetta nel panettone). In questa gelatina gli
elettroni erano liberi di muoversi, secondo un moto casuale.
Successivamente il fisico neozelandese Ernst Rutherford, che studiava le
radiazioni, volle testare il modello atomico di Thomson. Nel suo
laboratorio aveva un generatore di radiazioni di tipo α (He2+) al bromurio di
radio (RaBr2). Per contare le radiazioni utilizzò un contatore, che,
perfezionato, sarebbe diventato il contatore Geiger (Geiger era un suo
giovane assistente), come in figura.
Se l'atomo avesse avuto una consistenza gelatinosa come ipotizzava
Thomson, allora il raggio di particelle avrebbe dovuto attraversare senza
difficoltà l'atomo.
Senza la lamina d'oro il contatore segnava circa 132000 particelle al
minuto. Con la lamina d'oro (l'oro è stabile e non si ossida all'aria) circa
132000 particelle. Sembrò quindi che il modello atomico di Thomson fosse
valido, senonché Rutherford e i suoi assistenti vollero provare se
alcuneparticelle venissero respinte. Allora fu costruito un contatore come il
seguente:
In effetti, si contavano ora circa 26 particelle al minuto respinte verso il
generatore. Un numero così esiguo che è riuscito a sfuggire al calcolo
precedente. Quindi il modello di Thomson andava riconsiderato, poiché si
ipotizzano ora delle particelle massive nel nucleo dell'atomo.
Modello atomico di Rutherford
Rutherford immaginò la struttura atomica simile a quella dei pianeti che
orbitano intorno al Sole. Per questo motivo si parla anche di “modello
planetario”.
Il modello prevedeva un nucleo centrale (di massa molto maggiore a quella
dell'elettrone, come già previsto da Thomson) con una carica elettrica
positiva (che vada ad elidere quella negativa dell'elettrone, dando una
specie chimica neutra). Gran parte dello spazio che occupa un atomo è,
però, vuota. Possiamo capire come le particelle α del generatore abbiano
attraversato così facilmente la lamina d'oro nell'esperimento di Rutherford.
Come vediamo dall'immagine, le particelle che attraversano il vuoto non
hanno ostacoli che modifichino la loro traiettoria. Quelle che invece vanno
a scontrarsi con il nucleo dell'atomo vengono deviate o respinte.
Questo nucleo con una certa massa e una carica positiva venne identificato
con il protone.
Successivamente vennero anche calcolate le dimensioni del diametro
atomico e del nucleo. Il diametro atomico risulta essere 10-9 m, mentre il
nucleo ha un diametro di 10-14 m; quindi esso è 105 volte minore del
diametro atomico. Per fare un confronto, possiamo immaginare una pallina
da tennis al centro di un campo da calcio. La pallina rappresenta la
dimensione del nucleo, le gradinate intorno al perimetro del campo
rappresentano il diametro atomico.
Numero atomico Z
A questo punto viene introdotto il concetto di numero atomico. Nel nucleo
possiamo avere uno o più protoni, ognuno con una carica positiva. Il
numero atomico (che ha simbolo Z) rappresenta quindi il numero di protoni
all'interno del nucleo. Al variare di Z (che assume valori interi naturali)
corrisponde un atomo diverso, ossia un elemento diverso.
Gli isotopi
Nel 1932 Sir James Chadwick scoprì che lo stesso atomo (stesso elemento)
può avere masse diverse. Ma un atomo di un certo elemento ha sempre lo
stesso numero di protoni, quindi ciò che fa variare la massa è una terza
particella: viene scoperto il neutrone.
Atomi di uno stesso elemento con masse diverse vengono detti isotopi (dal
greco, “stesso luogo”, ossia stesso luogo nella tavola periodica).
In un atomo quindi distinguiamo le seguenti particelle:
SIMBOLO
CARICA
MASSA
Elettrone
e-
-1
9.109 * 10-28 g
Protone
p
+1
1.673 * 10-24 g
Neutrone
n
0
1,675 * 10-24 g
I valori di carica +1 e -1 si riferiscono alla carica elementare:
e = 1.602 * 10-19 C