Classe Scienze Biologiche
19 gennaio 2015
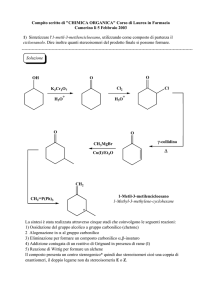
1) (5 punti) Completare le seguenti reazioni, riconoscerne il tipo e attribuire loro il nome specifico:
CH3
a) CH2=CHCH2CHCHCH3
OH
b) (CH3)3CH + Cl2
CH3
H2SO4
calore
hν
Eliminazione in ambiente acido di un alcol
Disidratazione
CH2=CHCH=CHCHCH3
Sostituzione radicalica alifatica
Clorurazione del 2-metilpropano
(CH3)3CCl + (CH3)2CHCH2Cl
MgBr
O
c)
H3O+
+ CH3CH2CH
Addizione nucleofila al carbonile di un composto di Grignard
Sintesi di un alcol secondario
CHCH2CH3
OH
Br
OCH3
CH3ONa (eccesso)
d)
Sostituzione nucleofila alifatica
Sintesi di Williamson di un etere
+ NaBr
Br
OCH3
+
e) CH3CH2COCH2CH3 + DIBAH
2) H
Sostituzione nucleofila acilica
Riduzione di un estere ad aldeide
CH3CH2CH + CH3CH2OH
O
O
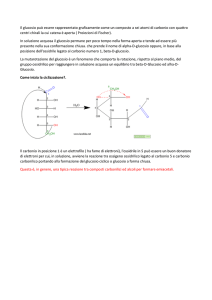
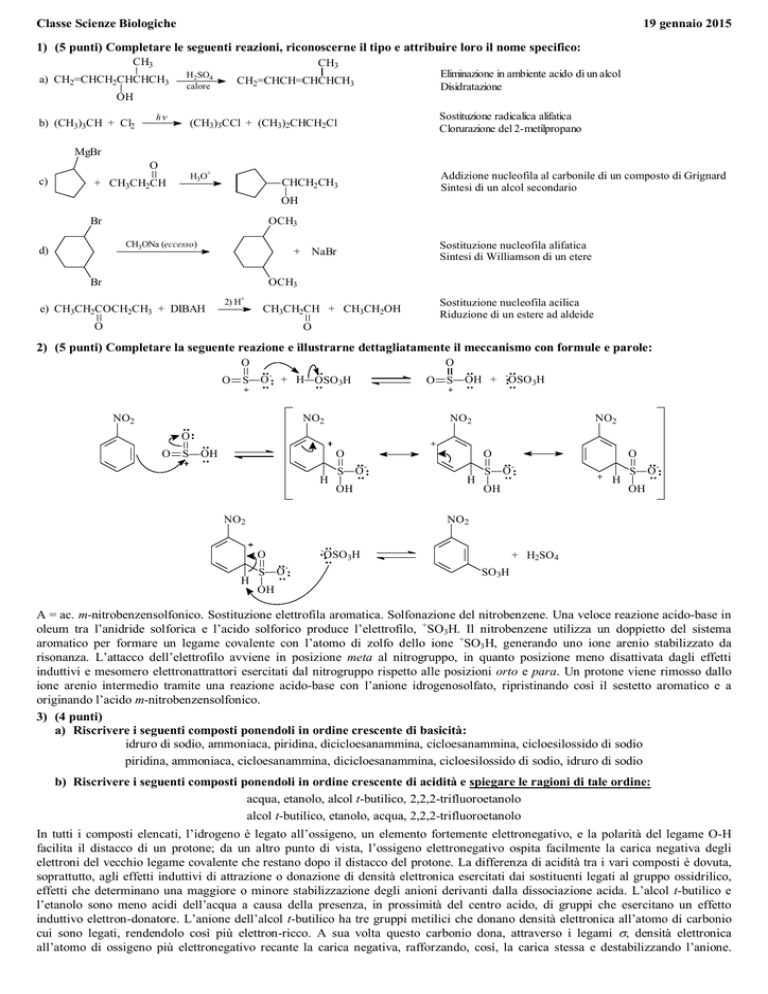
2) (5 punti) Completare la seguente reazione e illustrarne dettagliatamente il meccanismo con formule e parole:
O
O
O
S O
-
+ H OSO3H
NO2
O
NO2
S
-
OH + OSO3H
NO2
NO2
O
O
S
O
OH
H
S O
OH
NO2
H
S
O
O
-
H
OH
S O
-
OH
NO2
-
O
H
O
-
S O
OSO3H
-
+ H2SO4
SO3H
OH
A = ac. m-nitrobenzensolfonico. Sostituzione elettrofila aromatica. Solfonazione del nitrobenzene. Una veloce reazione acido-base in
oleum tra l’anidride solforica e l’acido solforico produce l’elettrofilo, +SO3H. Il nitrobenzene utilizza un doppietto del sistema
aromatico per formare un legame covalente con l’atomo di zolfo dello ione +SO3 H, generando uno ione arenio stabilizzato da
risonanza. L’attacco dell’elettrofilo avviene in posizione meta al nitrogruppo, in quanto posizione meno disattivata dagli effetti
induttivi e mesomero elettronattrattori esercitati dal nitrogruppo rispetto alle posizioni orto e para. Un protone viene rimosso dallo
ione arenio intermedio tramite una reazione acido-base con l’anione idrogenosolfato, ripristinando così il sestetto aromatico e a
originando l’acido m-nitrobenzensolfonico.
3) (4 punti)
a) Riscrivere i seguenti composti ponendoli in ordine crescente di basicità:
idruro di sodio, ammoniaca, piridina, dicicloesanammina, cicloesanammina, cicloesilossido di sodio
piridina, ammoniaca, cicloesanammina, dicicloesanammina, cicloesilossido di sodio, idruro di sodio
b) Riscrivere i seguenti composti ponendoli in ordine crescente di acidità e spiegare le ragioni di tale ordine:
acqua, etanolo, alcol t-butilico, 2,2,2-trifluoroetanolo
alcol t-butilico, etanolo, acqua, 2,2,2-trifluoroetanolo
In tutti i composti elencati, l’idrogeno è legato all’ossigeno, un elemento fortemente elettronegativo, e la polarità del legame O-H
facilita il distacco di un protone; da un altro punto di vista, l’ossigeno elettronegativo ospita facilmente la carica negativa degli
elettroni del vecchio legame covalente che restano dopo il distacco del protone. La differenza di acidità tra i vari composti è dovuta,
soprattutto, agli effetti induttivi di attrazione o donazione di densità elettronica esercitati dai sostituenti legati al gruppo ossidrilico,
effetti che determinano una maggiore o minore stabilizzazione degli anioni derivanti dalla dissociazione acida. L’alcol t-butilico e
l’etanolo sono meno acidi dell’acqua a causa della presenza, in prossimità del centro acido, di gruppi che esercitano un effetto
induttivo elettron-donatore. L’anione dell’alcol t-butilico ha tre gruppi metilici che donano densità elettronica all’atomo di carbonio
cui sono legati, rendendolo così più elettron-ricco. A sua volta questo carbonio dona, attraverso i legami σ, densità elettronica
all’atomo di ossigeno più elettronegativo recante la carica negativa, rafforzando, così, la carica stessa e destabilizzando l’anione.
Classe Scienze Biologiche
19 gennaio 2015
Questo effetto destabilizzante, per quanto presente, è inferiore nell’anione etossido che presenta un solo gruppo alchilico elettrondonatore legato all’atomo di ossigeno, ed è assente nello ione idrossido derivante dalla dissociazione acida dell’acqua. L’anione del
2,2,2-trifluoroetanolo ha tre atomi di fluoro elettronegativi che attraggono la densità elettronica dall’atomo di carbonio cui sono legati,
rendendolo così carente di elettroni. A sua volta questo carbonio elettron-povero attrae, attraverso i legami σ, la densità elettronica
dall’atomo di ossigeno recante la carica negativa, disperdendo, così, la carica stessa e stabilizzando l’anione. Questa stabilizzazione
favorisce la formazione dell’anione e accresce l’acidità del composto da cui esso deriva.
4) (2 punti) Parlare delle proprietà fisiche degli esteri
Tutti gli esteri hanno due gruppi polari, il gruppo carbonilico e quello alcossidico, per cui sono caratterizzati da interazioni dipolodipolo intermolecolari. Poiché non hanno legami O-H o N-H, gli esteri non sono in grado di formare legami idrogeno intermolecolari.
Perciò presentano punti di ebollizione più elevati dei composti apolari di peso molecolare analogo, ma più bassi dei corrispondenti
alcoli, acidi carbossilici o ammidi primarie e secondarie. Tutti gli esteri con un numero di atomi di carbonio minore di cinque sono
solubili in acqua perché possono formare con il solvente dei legami idrogeno, i termini con più di cinque atomi di carbonio sono
invece insolubili in acqua perché la porzione alchilica apolare è troppo grande per potersi sciogliere in un solvente polare come
l’acqua. Tutti gli esteri sono comunque solubili nei solventi organici più comuni poco polari o polari.
5) (7 punti)
a) Assegnare il nome IUPAC e la configurazione R/S o E/Z o cis/trans ai seguenti composti:
O
CH2NHCH3
CH2CHO
H3CCH2C
CH2CH3
IH2C
CH2Br
H
Br
H3C
OCH3
C C
C C
H
CH(CH3)2 H3C
H
HOOC
OH
(H3C)3C
CH2CH2I H3CH2CS
OCH3
H
H
CH2CONH2
CH2SCH3
1
4
3
2
5
1) (3S,4R)-4-bromo-3-isopropil-5-(metilammino) pentanammide
2) (3S,4R)-3,4-dimetil-5-(metiltio)-3-metossipentanale
3) (4Z)-4-t-butil-5-etil-7-iodo-4-epten-2-one
4) (2Z)-1-bromo-3-(etiltio)-4-iodo-2-metossi-2-butene
5) acido cis-2-idrossiciclopropancarbossilico
b) Scrivere la formula di struttura dei seguenti composti (usando i legami a cuneo pieno e tratteggiato nel primo caso):
1) (2R)-2-ammino-1-fluorobutan-2-olo
(3Z)-3-etil-4-metil-3-esen-1,5-diino
CH2F
CH2CH3
H2N
1
HC
C
C
CH
C C
H3CH2C
OH
CH3
2
6) (1 punto)
a)
Scrivere la formula a segmenti del seguente composto: 5-allil-1-etil-N-metilpirrol-3-ammina
NH
N
b) Assegnare il nome IUPAC al seguente composto:
O
O
O
3-formilbenzoato di metile
7) (6 punti) Confrontare le due principali reazioni dei composti carbonilici. Perché le aldeidi e i chetoni non subiscono la
reazione di sostituzione nucleofila acilica? Perché i cloruri acilici sono più reattivi degli esteri e delle ammidi nei confronti
della reazione di sostituzione nucleofila acilica?
L’atomo di ossigeno, elettronegativo, rende elettrofilo il carbonio carbonilico che, essendo trigonale planare, non è impedito
stericamente. Inoltre, il gruppo carbonilico ha un legame π facile da rompere. Ne risulta che i composti carbonilici reagiscono con i
nucleofili. Il risultato dell’attacco nucleofilo dipende però dalla natura del gruppo carbonilico di partenza, infatti le aldeidi e i chetoni
danno l’addizione nucleofila, mentre gli acidi carbossilici e derivati danno la sostituzione nucleofila.
Nel primo stadio dell’addizione nucleofila al carbonile, il nucleofilo forma un legame con il carbonio del gruppo carbonilico cedendo
ad esso una coppia di elettroni. Contestualmente una coppia di elettroni si riversa sull’ossigeno portando alla formazione di uno ione
alcolato. Il carbonio del vecchio gruppo carbonilico muta ibridazione da sp2 a sp3. Nel secondo stadio l’ossigeno dell’alcolato, poiché
fortemente basico, rimuove un protone dall’acqua (o da un’altra sorgente di protoni) portando ad un alcol.
Classe Scienze Biologiche
19 gennaio 2015
Nel primo stadio della sostituzione nucleofila acilica, il nucleofilo forma un legame con il carbonio del gruppo carbonilico cedendo ad
esso una coppia di elettroni. Contestualmente una coppia di elettroni si riversa sull’ossigeno portando alla formazione di uno ione
alcolato. Il carbonio del vecchio gruppo carbonilico muta ibridazione da sp2 a sp3. Questo stadio è identico al primo stadio
dell’addizione nucleofila. Una coppia di elettroni non condivisa dell’ossigeno ripristina il legame π C-O; contemporaneamente si
scinde il legame σ C-Z e Z si allontana con il doppietto elettronico del vecchio legame covalente.
La reazione di sostituzione nucleofila acilica può avvenire solo su substrati caratterizzati da buoni gruppi uscenti, che possono essere
definiti come atomi o raggruppamenti atomici che siano, sostanzialmente, basi deboli. Se tale reazione avvenisse su un’aldeide o un
chetone, una volta formatosi il classico intermedio tetraedrico, la sostituzione implicherebbe come gruppo uscente lo ione idruro :H-,
nel caso di un’aldeide, o uno ione alchiluro :R-, nel caso di un chetone. Questi sono le basi coniugate, rispettivamente, della molecola
di idrogeno H2 e di un alcano R-H, acidi debolissimi, perciò sono basi fortissime, più forti di uno ione idrossido o di uno ione
alcossido, e cattivissimi gruppi uscenti. Per questo motivo nelle aldeidi e nei chetoni prevale nettamente la reazione di addizione.
Gli acidi carbossilici e i suoi derivati differiscono grandemente tra loro nella reattività con i nucleofili. L’ordine di reattività deriva
dalla capacità come gruppo uscente del gruppo Z legato al carbonio carbonilico. Migliore è il gruppo uscente Z, più reattivo sarà
RCOZ nella sostituzione nucleofila acilica. Poiché lo ione cloruro è la base coniugata di un acido forte, quindi è una base debole,
mentre uno ione alcossido o uno ione ammiduro sono le basi coniugate di acidi deboli, quindi sono basi forti, i cloruri acilici
manifestano una reattività più spiccata degli esteri e delle ammidi.
La differente reattività è legata non solo alla natura del gruppo uscente che si forma durante una reazione di sostituzione nucleofila
acilica, ma anche al modo in cui i diversi sostituenti sul gruppo acilico influiscono sulla polarizzazione del gruppo carbonilico. Ad
esempio, il cloro sottrae elettroni per effetto induttivo ad un gruppo acilico rendendo l’atomo di carbonio del gruppo carbonilico più
elettronpovero e maggiormente suscettibile all’attacco di nucleofili. Invece i gruppi ammino o metossile donano elettroni per effetto
mesomero ad un gruppo acilico rendendo l’atomo di carbonio del gruppo carbonilico meno elettronpovero e suscettibile in misura
minore all’attacco di nucleofili. Una seconda conseguenza dell’ordine di reattività tra i derivati degli acidi carbossilici è che in natura
si trovano comunemente soltanto gli esteri e le ammidi. Gli alogenuri acilici reagiscono così velocemente con l’acqua che non
possono esistere negli organismi viventi.