645
CAPITOLO 25
Michele Di Stefano
Malattie
dello stomaco
Emanuela Miceli
Gino R. Corazza
Anatomia funzionale dello stomaco
© 2010 ELSEVIER S.R.L. Tutti i diritti riservati.
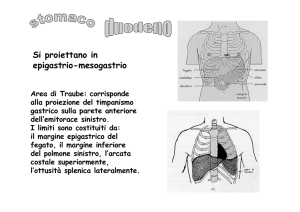
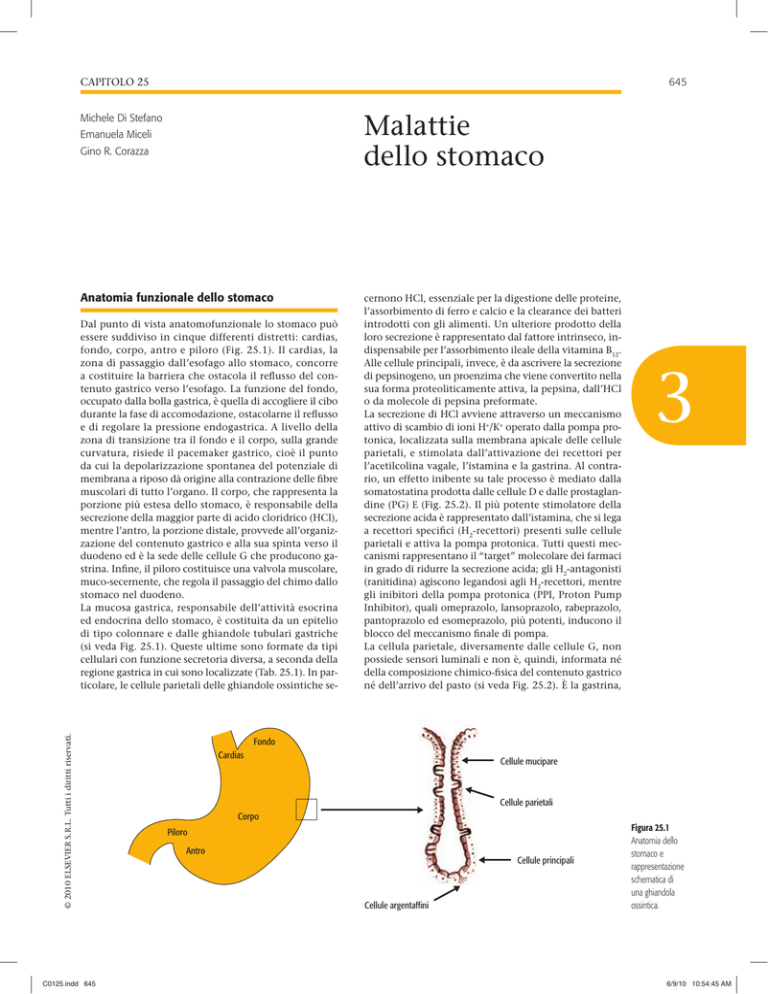
Dal punto di vista anatomofunzionale lo stomaco può
essere suddiviso in cinque differenti distretti: cardias,
fondo, corpo, antro e piloro ( Fig. 25.1 ). Il cardias, la
zona di passaggio dall’esofago allo stomaco, concorre
a costituire la barriera che ostacola il reflusso del contenuto gastrico verso l’esofago. La funzione del fondo,
occupato dalla bolla gastrica, è quella di accogliere il cibo
durante la fase di accomodazione, ostacolarne il reflusso
e di regolare la pressione endogastrica. A livello della
zona di transizione tra il fondo e il corpo, sulla grande
curvatura, risiede il pacemaker gastrico, cioè il punto
da cui la depolarizzazione spontanea del potenziale di
membrana a riposo dà origine alla contrazione delle fibre
muscolari di tutto l’organo. Il corpo, che rappresenta la
porzione più estesa dello stomaco, è responsabile della
secrezione della maggior parte di acido cloridrico (HCl),
mentre l’antro, la porzione distale, provvede all’organizzazione del contenuto gastrico e alla sua spinta verso il
duodeno ed è la sede delle cellule G che producono gastrina. Infine, il piloro costituisce una valvola muscolare,
muco-secernente, che regola il passaggio del chimo dallo
stomaco nel duodeno.
La mucosa gastrica, responsabile dell’attività esocrina
ed endocrina dello stomaco, è costituita da un epitelio
di tipo colonnare e dalle ghiandole tubulari gastriche
(si veda Fig. 25.1). Queste ultime sono formate da tipi
cellulari con funzione secretoria diversa, a seconda della
regione gastrica in cui sono localizzate (Tab. 25.1). In particolare, le cellule parietali delle ghiandole ossintiche se-
C0125.indd 645
cernono HCl, essenziale per la digestione delle proteine,
l’assorbimento di ferro e calcio e la clearance dei batteri
introdotti con gli alimenti. Un ulteriore prodotto della
loro secrezione è rappresentato dal fattore intrinseco, indispensabile per l’assorbimento ileale della vitamina B12.
Alle cellule principali, invece, è da ascrivere la secrezione
di pepsinogeno, un proenzima che viene convertito nella
sua forma proteoliticamente attiva, la pepsina, dall’HCl
o da molecole di pepsina preformate.
La secrezione di HCl avviene attraverso un meccanismo
attivo di scambio di ioni H+/K+ operato dalla pompa protonica, localizzata sulla membrana apicale delle cellule
parietali, e stimolata dall’attivazione dei recettori per
l’acetilcolina vagale, l’istamina e la gastrina. Al contrario, un effetto inibente su tale processo è mediato dalla
somatostatina prodotta dalle cellule D e dalle prostaglandine (PG) E (Fig. 25.2). Il più potente stimolatore della
secrezione acida è rappresentato dall’istamina, che si lega
a recettori specifici (H2-recettori) presenti sulle cellule
parietali e attiva la pompa protonica. Tutti questi meccanismi rappresentano il “target” molecolare dei farmaci
in grado di ridurre la secrezione acida; gli H2-antagonisti
(ranitidina) agiscono legandosi agli H2-recettori, mentre
gli inibitori della pompa protonica (PPI, Proton Pump
Inhibitor), quali omeprazolo, lansoprazolo, rabeprazolo,
pantoprazolo ed esomeprazolo, più potenti, inducono il
blocco del meccanismo finale di pompa.
La cellula parietale, diversamente dalle cellule G, non
possiede sensori luminali e non è, quindi, informata né
della composizione chimico-fisica del contenuto gastrico
né dell’arrivo del pasto (si veda Fig. 25.2). È la gastrina,
3
3
Fondo
Cardias
Cellule mucipare
Cellule parietali
Corpo
Piloro
Antro
Cellule principali
Cellule argentaffini
Figura 25.1
Anatomia dello
stomaco e
rappresentazione
schematica di
una ghiandola
ossintica.
6/9/10 10:54:45 AM
646
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Tabella 25.1 Localizzazione, tipologia cellulare e secrezione delle ghiandole gastriche
Ghiandola
Localizzazione
Tipo di cellula
Secrezione
Cardiale
Giunzione esofago-gastrica
Mucipara
Muco, pepsinogeni
Ossintica
Fondo e corpo
Mucipara
Parietale
Principale
Enterocromaffine
Endocrine
Muco
HCl, fattore intrinseco
Pepsinogeno I e II
Serotonina
Somatostatina, istamina, glucagone
Pilorica
Antro e piloro
Mucipara
Cellula G
Enterocromaffine
Endocrine
Muco
Gastrina
Serotonina
Somatostatina, istamina, glucagone
Corpo
–
Nervo
vago
Ach
Cellula D
Ach
Somatostatina
– Cellula +
+
parietale
+
Lume
Gastrina
H+
Cibo
Aminoacidi
H+
Cellula a
secrezione
istaminica
Lume
+
Cellula D
+ –
Cellula G
Figura 25.2
Rappresentazione
schematica dei
meccanismi di
regolazione della
secrezione acida
gastrica.
–
ina
Circolazione
sistemica
t
ma
So
at
ost
Gastrina
Antro
A livello del corpo, la cellula parietale, deputata alla secrezione degli ioni H+ e sprovvista di recettori luminali, possiede recettori per l’acetilcolina (Ach) vagale (fase cefalica), l’istamina e la
gastrina (fase prandiale), a effetto stimolante sulla secrezione di ioni H+, e recettori per la somatostatina, prodotta dalle cellule D, ad azione inibente su tale secrezione. Sulle cellule D l’Ach ha
un effetto inibente. A livello dell’antro, la cellula G è provvista di recettori luminali per gli alimenti e per gli ioni H+ a effetto, rispettivamente, stimolante e inibente sulla liberazione di gastrina.
La gastrina è responsabile della sintesi prandiale di H+ da parte delle cellule parietali del corpo. Anche nell’antro sono presenti cellule D che, se stimolate dall’elevata concentrazione di ioni
H+, inibiscono la secrezione di gastrina.
C0125.indd 646
6/9/10 10:54:45 AM
Capitolo 25 - MALATTIE DELLO STOMACO
secreta dalle cellule G, in risposta agli aminoacidi e ai peptidi contenuti negli alimenti, a rappresentare uno stimolo
positivo alla secrezione cloridrica, mentre l’acetilcolina
prodotta dal vago stimola tale secrezione in risposta a
impulsi neurosensoriali (fase cefalica della digestione).
La barriera gastrica rappresenta l’insieme di quei meccanismi che contribuiscono alla difesa e al mantenimento
dell’integrità della mucosa dello stomaco. Si distinguono in pre-epiteliali (mucine, bicarbonato, fosfolipidi di
superficie), epiteliali (giunzioni strette, rinnovamento
cellulare, scambio Na+/H+ e Cl−/HCO3) e postepiteliali
(flusso ematico). Il muco, che ricopre la parete gastrica,
è prodotto dalle cellule epiteliali e dalle cellule mucipare
ed è costituito per il 95% da acqua e per il 5% da glicoproteine. Svolge la sua funzione protettiva creando uno
strato continuo di gel contenente bicarbonato (rilasciato
dalle cellule epiteliali) che neutralizza gli ioni H+, mantenendo un pH neutro. La sua produzione è stimolata dalle
PG ed è proprio attraverso la loro inibizione che si attua
l’effetto gastrolesivo dei farmaci antinfiammatori non
steroidei (FANS). Al mantenimento della barriera gastrica
concorrono le giunzioni strette che uniscono le cellule
epiteliali e che ostacolano la retrodiffusione degli H+, la
rigenerazione continua dell’epitelio e il flusso sanguigno
che ne garantisce l’adeguata ossigenazione.
La vascolarizzazione dello stomaco è costituita da una fitta
rete arteriosa che origina dai rami del tronco celiaco. La
ricchezza di anastomosi di questi rami, fra di loro e con
l’arteria splenica, l’arteria epatica e l’arteria mesenterica
superiore, spiega la possibile severità degli eventi emorragici in corso di ulcera peptica e gastrite emorragica e, per
contro, la rarità con cui si verificano eventi ischemici a
carico dello stomaco. Lo stomaco è innervato dal sistema
nervoso parasimpatico (nervo vago), deputato alla stimolazione della secrezione di HCl e gastrina e al controllo
della motilità gastrica, e dal sistema nervoso simpatico
(nervi splancnici che originano dal ganglio celiaco) che
coordina le funzioni inibitorie, secretive e motorie. L’attività motoria gastrica è notevolmente influenzata da stimoli neurali e ormonali provenienti da regioni intestinali
anche lontane; la distensione meccanica di duodeno o
colon e la presenza di acido, lipidi e proteine nel duodeno
inducono un rilasciamento del fondo gastrico e inibiscono
la motilità antrale.
647
3
Gastriti
La gastrite, negli anni, è stata definita come una sindrome
clinica, un quadro endoscopico o un’infiammazione
microscopica dello stomaco. Tale ultima definizione è
quella in uso e su di essa si basa l’attuale sistema classificativo.
Classificazione delle gastriti
Le gastriti presentano un ampio spettro istopatologico
e topografico che si rende responsabile di differenti pattern di malattia attualmente ben caratterizzati. Oggi le
gastriti vengono classificate, sulla base di criteri istologici
ed endoscopici, in accordo con il cosiddetto “sistema di
Sydney”, successivamente modificato secondo la revisione
di Houston (Tab. 25.2).
Il sistema classifica le gastriti considerando da un lato i
possibili fattori eziologici coinvolti e, dall’altro, il tipo di
lesione presente. Le principali variabili considerate, che
permettono di definire un “grading” di severità istologica,
sono rappresentate dalla presenza dell’Helicobacter pylori
(Hp), dalla ricchezza dell’infiltrato di neutrofili e cellule
mononucleate, dall’entità dell’atrofia ghiandolare e dalla
presenza di metaplasia intestinale. Le differenti variabili
vengono graduate secondo uno schema di severità crescente illustrato nella Fig. 25.3.
La successiva trattazione, tenendo conto che alcune voci
della classificazione di Sydney-Houston costituiscono il
possibile spettro evolutivo della infezione da Hp, è principalmente articolata su criteri eziologici e, pertanto,
verranno considerate in dettaglio la gastrite cronica da
Hp, la gastropatia da FANS, la gastrite cronica atrofica
autoimmune, le gastriti croniche infettive e, infine, le
gastriti acute.
C0125.indd 647
Gastrite cronica Hp-relata
L’Hp è un bacillo Gram−, spiraliforme, anaerobio e argirofilo, dotato di flagelli unipolari e di spiccata attività
ureasica (Fig. 25.4). La capacità di produrre ureasi, oltre
a rappresentare come vedremo un marker indiretto della
sua presenza, è essenziale per le sue sopravvivenza e replicazione nella mucosa gastrica. L’ureasi, infatti, catalizza
la scissione dell’urea in CO2 e ammonio, che, neutralizzando l’HCl, favorisce la creazione di un microambiente
alcalino che protegge il microrganismo dal basso pH
gastrico e gli consente la produzione degli altri fattori di
virulenza. Dal 1983, anno della sua scoperta, una serie
innumerevole di studi ha chiarito il ruolo patogenetico
dell’Hp nella gastrite, nell’ulcera peptica, nell’adenocarcinoma gastrico e nel linfoma gastrico a cellule B.
L’Organizzazione Mondiale della Sanità (OMS) riconosce
nell’Hp un carcinogeno di classe I e stima che, debellando
l’infezione, si possa ottenere una riduzione del 60-80%
della prevalenza dell’adenocarcinoma gastrico.
Epidemiologia
L’Hp è un batterio ubiquitario, presente nell’acqua e
nei fluidi biologici di alcuni animali. La trasmissione
avviene da persona a persona attraverso varie modalità,
feco-orale, oro-orale o mediante oggetti contaminati.
La particolare suscettibilità all’infezione di individui di
gruppo 0, che presentano una particolare composizione
glicoproteica del muco gastrico, e studi su gemelli monozigoti suggeriscono l’importanza di fattori genetici nello
sviluppo dell’infezione. Inoltre, l’occorrenza familiare
dell’infezione da Hp, dell’ulcera peptica e del cancro
6/9/10 10:54:45 AM
648
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Tabella 25.2 Sistema di Sydney-Houston: classificazione topografica, morfologica ed eziologica delle gastriti
Gastriti acute
Da Helicobacter pylori
Da altri batteri
Da farmaci
Da caustici
Gastriti croniche
Non atrofica
Atrofica
– Autoimmune
Agente eziologico
Helicobacter pylori
? Altri fattori
Sinonimo
Superficiale
Gastrite antrale diffusa
Gastrite antrale cronica
Interstiziale-follicolare
Ipersecretiva
Tipo B
Autoimmune
Tipo A
Gastrite diffusa del corpo
Associata ad anemia perniciosa
Tipo B, tipo AB
Ambientale
Metaplasica
– Multifocale
Helicobacter pylori
Alimentazione
? Fattori ambientali
Altre forme
– Chimica
– Indotta da radiazioni
– Linfocitica
– Non infettiva granulomatosa
– Eosinofila
– Altre forme infettive
Irritazione chimica
Bile
FANS
? Altri agenti
Danno da radiazioni
Idiopatica – immunomediata
Glutine
Farmaci (ticlopidina)
? Helicobacter pylori
Malattia di Crohn
Sarcoidosi
Granulomatosi di Wegener e altre vasculiti
Sostanze estranee
Idiopatica
Allergia alimentare
? Altre allergie
Batteri (escluso l’Helicobacter pylori)
Virus
Funghi
Parassiti
gastrico rafforza il ruolo di tali fattori nella patogenesi
di queste lesioni.
Il principale fattore di rischio all’infezione da Hp è rappresentato da condizioni socioeconomiche scadenti. La
scarsità di presidi igienici, il sovraffollamento e l’insufficiente approvvigionamento idrico costituiscono fattori che
aumentano la prevalenza dell’infezione nella popolazione
generale. Si ritiene che l’infezione venga generalmente
contratta nel corso della prima infanzia e studi condotti
mediante l’utilizzo di test sierologici hanno documentato
un’elevatissima prevalenza infantile (60%) nei Paesi in via
di sviluppo, rispetto a un progressivo aumento della prevalenza in funzione dell’età nei Paesi occidentali. A conferma
di ciò, l’incidenza annua di nuovi casi o reinfezioni di
soggetti sottoposti a eradicazione è pari a 0,5-1% nei Paesi
industrializzati e a 3-10% nei Paesi in via di sviluppo.
C0125.indd 648
Reattiva
Da reflusso
Da FANS
Tipo C
Varioliforme (endoscopica)
Associata alla malattia celiaca
Granulomatosi isolata
Allergica
Flemmonosa
Fattori di virulenza e storia naturale
L’Hp è caratterizzato da un particolare tropismo per l’epitelio gastrico e per aree di metaplasia gastrica al di fuori
dello stomaco e la sua presenza determina l’insorgenza
di un’importante risposta infiammatoria e immunitaria
che si interrompe solo dopo l’eradicazione del batterio. Anche se l’infezione può rimanere asintomatica per
tutta la vita, in tutti gli individui infetti è presente una
gastrite istologicamente documentabile (Fig. 25.5), che
inizialmente coinvolge l’antro e, in seguito, si estende
prossimalmente in direzione del corpo. Circa un quinto
dei pazienti sviluppa, prima dei 50 anni, un’ulcera duodenale; più tardivamente, l’infezione può associarsi a
ulcera gastrica e in rari casi (1-3%), soprattutto quando
la gastrite ha una localizzazione multifocale (corpo e
antro), può evolvere in adenocarcinoma gastrico o in
6/9/10 10:54:45 AM
Capitolo 25 - MALATTIE DELLO STOMACO
Normale
Lieve
Moderato
Severo
Helicobacter pylori
Neutrofili
Normale
Lieve
Moderato
Severo
649
Figura 25.3
Scala di severità
(da normale a
severa) delle
sei variabili
istopatologiche
che caratterizzano
la gastrite.
Atrofia: antro
Atrofia: corpo
3
Cellule mononucleate
Metaplasia intestinale
(Modificata da: Am J Surg Pathol 1996.)
linfoma gastrico-MALT (Mucosa Associated Lymphoid
Tissue).
Oltre alla già menzionata attività ureasica che determina
la sopravvivenza del batterio in un ambiente ostile, altri
fattori che contribuiscono alla sua elevata patogenicità sono
rappresentati dalla marcata motilità conferita dai flagelli,
dalla produzione di adesine di parete, che ne impediscono
la rapida clearance e favoriscono la colonizzazione della
mucosa gastrica, e, infine, dalla produzione di citotossine,
quali la vacuolizzante (VacA) e la citotossina associata all’antigene (CagA). Nonostante il gene VacA sia sempre presente,
la citotossina è espressa solo nel 50% dei casi; si tratta di una
proteina di 90 kD responsabile della vacuolizzazione delle
cellule mucosali. Il gene CagA, che codifica per una proteina
di 120-140 kD, è presente nel 60% dei casi e sembra essere
correlato a gastrite severa, al possibile sviluppo di ulcera e
all’evoluzione in cancro gastrico. La sua azione consiste
nell’indurre alterazioni del citoscheletro delle cellule colpite. Accanto a queste esotossine, l’Hp è munito, come altri
Gram−, di endotossine, quali il lipopolisaccaride capsulare,
anch’esse provviste di proprietà citotossiche e capaci di
indurre il rilascio di citochine infiammatorie.
Come si è detto, l’infezione da Hp si localizza nella maggior parte dei casi, in forma acuta, nella regione antrale.
Attraverso la liberazione di tossine e all’intervento di
citochine (IL-8), stimolate dal lipopolisaccaride, vengono richiamati polimorfonucleati, eosinofili, linfociti T e
B con formazione di aggregati linfoidi. Si configura così
il quadro di gastrite acuta superficiale. Se il batterio non
viene eradicato in questa fase, l’infezione cronicizza assumendo tre diversi pattern evolutivi (Fig. 25.6).
C0125.indd 649
Figura 25.4
Caratteristiche
morfobiologiche
di Hp:
spiraliforme,
unipolare,
multiflagellato
(4-6), Gram-,
anaerobio.
Figura 25.5
Biopsia
dell’angulus in
paziente con
gastrite
Hp- positiva
(Giemsa, 100×).
Sono evidenti focolai di flogosi cronica e acuta. Nello strato di muco sovrastante l’epitelio e
nel lume delle ghiandole sono presenti numerose forme di Hp (frecce).
6/9/10 10:54:46 AM
650
Figura 25.6
Rappresentazione
schematica
della possibile
evoluzione
clinicopatologica
dell’infezione
da Hp.
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
II. Gastrite
atrofica
del corpo
Infezione
da Hp
Gastrite
acuta
I. Gastrite
cronica
antrale
Ulcera
duodenale
Ulcera
gastrica
Metaplasia
Displasia
Adenocarcinoma
III. Gastrite
cronica
multifocale
Infanzia
Età adulta
Nel primo, persiste una predominanza della gastrite a livello
antrale, con progressiva risoluzione dell’infiammazione nel
corpo, incremento della secrezione gastrinica e, di conseguenza, di quella acida, e frequente insorgenza di ulcera
duodenale. Nel secondo, l’infiammazione predomina a
livello del corpo dello stomaco, la secrezione acida si riduce
progressivamente e la persistenza dell’infezione può portare
alla formazione di ulcera gastrica e all’atrofia delle ghiandole
ossintiche. Questa forma predispone a metaplasia intestinale
incompleta (sostituzione di singole cellule foveolari da parte
di cellule caliciformi) e completa (sostituzione dell’epitelio
gastrico superficiale da parte di enterociti e cellule caliciformi con formazione di villi e cripte), fino alla displasia e alla
possibile trasformazione in adenocarcinoma.
Nel terzo, la gastrite cronica progredisce in direzione sia
dell’antro sia del corpo (gastrite multifocale), assumendo
poi caratteristiche evolutive simili alla forma precedente.
Manifestazioni cliniche
Pazienti con gastrite cronica Hp-positiva non complicata
presentano uno spettro clinico estremamente ampio, che
va da casi del tutto asintomatici a casi con sintomi evidenti.
Le manifestazioni cliniche sono rappresentate da un quadro
dispeptico caratterizzato dalla varia associazione di sintomi
quali dolore epigastrico, ripienezza postprandiale, sazietà
precoce, distensione addominale, nausea e vomito.
L’insorgenza di complicanze della gastrite cronica Hp-positiva, quali ulcera duodenale o gastrica, può determinare
una maggiore severità delle manifestazioni sopra descritte,
mentre la sovrapposizione di metaplasia o displasia non
determina modificazioni del quadro clinico. Relativamente
alla comparsa di cancro gastrico, la sintomatologia dipende
dalla sede di insorgenza, dalle dimensioni e dalle caratteristiche in termini di crescita espansiva o infiltrativa (disfagia,
sintomi di occlusione con vomito, anoressia, malnutrizione,
sanguinamento manifesto o occulto).
Patologie correlate
Numerosi studi hanno riportato l’associazione tra infezione da Hp e una serie eterogenea di affezioni extraintestinali, quali anomalie della coagulazione, patologie
C0125.indd 650
Età avanzata
cardiovascolari (coronaropatia, vasculopatia cerebrale,
ipertensione), endocrine (diabete, tiroidite, dismenorrea),
dermatologiche (orticaria, acne rosacea e psoriasi), reumatologiche (artrite reumatoide, fenomeno di Raynaud
e sindrome di Sjögren) ed ematologiche (anemia sideropenica, porpora trombocitopenica idiopatica). L’infezione
da Hp è, come si è detto, limitata alla mucosa gastrica, ma
la risposta infiammatoria e immunitaria da essa stimolata
condiziona, anche a livello sistemico, l’up-regolazione di
citochine e di altri mediatori della flogosi, che potrebbe
giustificare un nesso causale tra l’infezione e le possibili
manifestazioni extraintestinali.
Tuttavia, la forza di tali associazioni si è dimostrata spesso
insufficiente a giustificare una loro sistematica ricerca.
Diversi studi hanno arruolato un campione di pazienti
di numero non adeguato e in molti di essi la possibile
dipendenza delle manifestazioni extraintestinali da una
terza variabile (fumo, fattori alimentari, basse condizioni
socioeconomiche ecc.) non è stata sufficientemente considerata; infine, la scomparsa di tali manifestazioni dopo
trattamento antibiotico potrebbe dipendere direttamente
da quest’ultimo e non dall’eradicazione dell’Hp.
In conclusione, a tutt’oggi, la ricerca e il trattamento
dell’infezione dell’Hp risultano giustificati solo in poche
condizioni nelle quali il ruolo patogenetico del batterio
sembra accertato. In soggetti con anemia sideropenica si
ipotizzano come meccanismi fisiopatologici il sanguinamento occulto secondario alla gastrite cronica erosiva,
il ridotto assorbimento di ferro secondario alla gastrite
cronica del corpo con conseguente ipo- o acloridria e la
possibile utilizzazione del ferro, alimentare o circolante, da parte del batterio. L’eradicazione dell’infezione è
in grado di correggere l’anemia in pazienti con gastrite
asintomatica e migliorare l’assorbimento orale del ferro.
Nella porpora trombocitopenica idiopatica l’eradicazione
dell’infezione induce un significativo aumento della conta
piastrinica. Il meccanismo responsabile di tale associazione non è completamente chiaro e potrebbe coinvolgere,
attraverso un meccanismo di mimicria molecolare, il riconoscimento di antigeni piastrinici da parte di anticorpi
anti-CagA.
6/9/10 10:54:47 AM
Capitolo 25 - MALATTIE DELLO STOMACO
Diagnosi
Il test diagnostico per definire la presenza di una gastrite
cronica attribuibile a un’infezione da Hp è rappresentato
dalla valutazione istologica della biopsia gastrica, corredata
dalla colorazione di Giemsa, che consente l’evidenziazione
del batterio a livello della superficie epiteliale (si veda Fig.
25.5). Tale esame richiede l’effettuazione di un’esofagogastroduodenoscopia e va, quindi, riservato a pazienti sintomatici e con elevato rischio di patologia organica sulla base
dei criteri di Roma III (si veda il Capitolo 29). Al contrario,
in individui di età inferiore a 45-55 anni e in assenza di
sintomi conferenti elevato rischio di patologia organica, si
preferisce evitare l’effettuazione di test invasivi e rilevare la
presenza del batterio attraverso test non invasivi.
In alternativa, campioni di tessuto prelevati endoscopicamente possono essere utilizzati per effettuare il test rapido
all’ureasi, che rappresenta un metodo immediato, basato
sull’attività ureasica del batterio, la quale determina, in una
soluzione campione, l’idrolisi dell’urea in ammonio e CO2
con incremento del pH e variazione del colore. Quest’indagine può risultare falsamente negativa, se effettuata a breve
distanza dall’assunzione di farmaci che inibiscono l’attività
metabolica del batterio, quali antibiotici, bismuto o PPI.
Per ciò che riguarda i test non invasivi, la presenza di anticorpi circolanti di classe IgG può essere ricercata mediante un
test ELISA. Tuttavia, in virtù della memoria immunologica,
elevati livelli di IgG specifiche sono rilevabili anche a distanza
dall’eradicazione. Il test, di conseguenza, è utile per la ricerca
dell’Hp in individui naïve, mentre non consente la verifica
dell’eradicazione o la valutazione di eventuali recidive.
L’esame attualmente più utilizzato, provvisto di un’elevata
accuratezza diagnostica, è rappresentato dal breath test
all’urea, che prevede l’assunzione orale di urea marcata
con 13C la quale, in presenza di attività batterica ureasica,
rilascia 13CO2 a livello gastrico. Il gas diffonde nel circolo
ematico, viene eliminato nell’aria espirata e in essa quantizzato mediante spettrometria di massa. Anche il breath
test all’urea può risultare falsamente negativo, se effettuato
a breve distanza da terapie con farmaci che inibiscono
l’attività metabolica del batterio.
Un ulteriore esame, di accuratezza paragonabile al breath test all’urea, è rappresentato dalla ricerca di antigeni
specifici dell’Hp nelle feci. Si tratta di un test immunoenzimatico che, a differenza dei precedenti, non subisce
interferenze da eventuali terapie in atto e può, quindi,
essere utilizzato per la valutazione dell’avvenuta eradicazione o di possibili recidive dell’infezione.
I livelli di accuratezza dei test impiegati per la diagnosi
dell’infezione da Hp sono riportati nella tabella 25.3.
Terapia
A tutt’oggi, per l’eradicazione dell’Hp non esiste una
terapia in grado di soddisfare contemporaneamente
requisiti quali assenza di effetti collaterali, elevata
efficacia, basso costo e basso rischio di indurre ceppi
resistenti. Le linee guida di Maastricht III prevedono
la somministrazione combinata di antisecretori (PPI
o H2-antagonisti) e antibiotici (Tab. 25.4). La prima
linea di terapia prevede l’utilizzo di amoxicillina e
C0125.indd 651
Tabella 25.3
651
Accuratezza dei test per la diagnosi
dell’infezione da Helicobacter pylori
Test
Sens.
(%)
Spec.
(%)
VPP
(%)
VPN
(%)
Invasivi
Test rapido all’ureasi
Istologia
98
93
99
99
99
99
98
89
Non invasivi
Sierologia
Urea breath test
Antigene fecale
91
92
94
97
93
96
95
98
-
85
84
-
Sens. = sensibilità; Spec. = specificità; VPN = valore predittivo negativo;
VPP = valore predittivo positivo.
claritromicina o metronidazolo in combinazione con
PPI per un periodo variabile da 7 a 14 giorni e in grado di conseguire un tasso di eradicazione superiore
all’80%. Recentemente, in Italia, si è assistito a un
declino dell’efficacia terapeutica di tale schema ed è
stato, di conseguenza, suggerito un trattamento cosiddetto sequenziale, che prevede la somministrazione di
un solo antibiotico per i primi 5 giorni (amoxicillina)
insieme a un PPI e l’associazione claritromicina-tinidazolo per ulteriori 5 giorni. Tale schema è provvisto
di un’efficacia pari al 90% e, soprattutto, si è dimostrato efficace contro infezioni da ceppi resistenti alla
claritromicina.
Gli schemi di seconda linea sono rappresentati dalla
quadruplice terapia, consistente nell’associazione tra
bismuto, metronidazolo, tetraciclina e un PPI, caratterizzata da un tasso di eradicazione compreso tra il
70 e l’80% dei casi non eradicati con trattamenti di
prima linea e uno schema di triplice terapia basato
sulla combinazione di levofloxacina, amoxicillina e
un PPI provvisto di efficacia comparabile, ma minori effetti collaterali. Purtroppo, la possibilità di una
rapida comparsa di resistenza al chinolonico limita
l’applicazione di tale schema.
Schemi terapeutici di terza linea prevedono l’associazione tra rifabutina, un antitubercolare o rifamicina
e amoxicillina e un PPI. Questi ultimi mostrano un
tasso di eradicazione dell’ordine del 70% in pazienti
non eradicati con due dei precedenti schemi terapeutici.
Nel caso di ulteriori insuccessi terapeutici, la scelta
dell’antibiotico dovrebbe essere guidata dall’effettuazione dell’antibiogramma.
3
Gastropatia da FANS
Si stima che ogni giorno più di 30 milioni di persone nel
mondo assumano FANS. Tale consumo è purtroppo gravato
da un notevole tasso di ospedalizzazione (5,6‰ persone/
anno) e da un’aumentata mortalità (5% dei pazienti ospe-
6/9/10 10:54:47 AM
652
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Tabella 25.4 Protocolli terapeutici per l’eradicazione
dell’Helicobacter pylori
Prima linea
“Triplice terapia” per 7-14 giorni con:
– PPI/H2-antagonisti a dose piena, 2 volte al giorno
– amoxicillina 1 g, 2 volte al giorno
– claritromicina 500 mg o metronidazolo 500 mg, 2 volte
al giorno
Tabella 25.5
Manifestazioni gastrointestinali del danno
indotto dall’assunzione di FANS
Esofago
Ulcere
Stenosi
Esofagite
Stomaco e duodeno
Gastropatia da FANS
Ulcere
“Trattamento sequenziale”
5 giorni con:
– PPI/H2-antagonisti a dose piena, 2 volte al giorno
– amoxicillina 1 g, 2 volte al giorno
seguiti da 5 giorni con:
– PPI/H2-antagonisti a dose piena, 2 volte al giorno
– claritromicina 500 mg, 2 volte al giorno
– tinidazolo 500 mg, 2 volte al giorno
Seconda linea
“Quadruplice terapia” per 10-14 giorni con:
– PPI/H2-antagonisti a dose piena, 2 volte al giorno
– bismuto 120 mg, 4 volte al giorno
– tetraciclina 500 mg, 4 volte al giorno
– metronidazolo 500 mg, 3 volte al giorno
oppure
– PPI/H2-antagonisti a dose piena, 2 volte al giorno
– levofloxacina 500 mg, 2 volte al giorno
– amoxicillina 1 g, 2 volte al giorno
dalizzati, circa 7.000 decessi/anno in Italia), in particolare
in pazienti anziani affetti da patologie reumatiche e osteoarticolari croniche. I FANS, infatti, sono spesso responsabili
di importanti lesioni a carico di tutto l’apparato digerente,
che possono evolvere in manifestazioni emorragiche o perforazioni (Tab. 25.5).
I fattori di rischio al danno da FANS sono sia paziente- sia farmaco-correlati (Tab. 25.6). In particolare, per quanto riguarda
la durata del trattamento, il periodo critico è rappresentato
dai primi 3 mesi. L’ulteriore prosecuzione della terapia favorisce, infatti, l’instaurarsi di meccanismi di adattamento
protettivi, quali l’aumento del flusso ematico mucosale e
l’incremento della produzione locale di ossido nitrico e/o di
fattori di crescita (EGF [Epidermal Growth Factor] e TGF-␣
[Transforming Growth Factor-␣]). Differenti formulazioni
(tamponate o gastroprotette) o vie di somministrazione (rettale, topica o parenterale) non modificano significativamente la lesività gastrica dei FANS, legata all’inibizione dell’enzima ciclo-ossigenasi (COX) e della conseguente sintesi di
PG ad azione citoprotettiva. Tale inibizione è, ovviamente,
indipendente dalla via di somministrazione.
Meccanismi di difesa della mucosa gastrica
La mucosa gastrica è continuamente esposta a diversi
fattori nocivi e un consistente numero di meccanismi di
difesa è in grado di prevenire il danno mucosale mantenendone l’integrità. Le lesioni mucosali possono pertanto
comparire quando i fattori nocivi superano l’efficienza
funzionale dei normali meccanismi difensivi o quando
questi ultimi risultano compromessi.
C0125.indd 652
Intestino tenue
Ulcere
Stenosi
Enteropatia
Colon
Ulcere
Stenosi
Colite da FANS
Perforazione diverticoli
Riacutizzazione malattie infiammatorie croniche intestinali
Fegato
Epatite acuta
Pancreas
Pancreatite acuta
La barriera muco-bicarbonato-fosfolipidi rappresenta la prima
linea di difesa. È costituita da uno strato di muco in gel,
contenente bicarbonato e fosfolipidi, che ricopre la superficie cellulare. La superficie luminale di tale strato di muco
è rivestita da un film fosfolipidico con notevoli proprietà
idrofobiche. La secrezione di muco è stimolata da ormoni
gastrointestinali, quali gastrina e secretina, da PGE2 e da
agenti colinergici. Sostanze ad attività ulcerogena, come
Tabella 25.6
Fattori di rischio coinvolti nel danno
gastrointestinale da FANS
Paziente-correlati
Età avanzata
Sesso femminile
Comorbilità
Concomitante infezione da Hp
Precedenti episodi di ulcera peptica
Farmaco-correlati
Tipo di farmaco
Dosaggio
Durata del trattamento
Interazione con altri farmaci
Contemporanea assunzione di steroidi o anticoagulanti
Fumo, caffè e alcolici
Assunzione del farmaco lontano dai pasti
6/9/10 10:54:48 AM
Capitolo 25 - MALATTIE DELLO STOMACO
l’acido acetilsalicilico e i sali biliari, inducono una riduzione della viscosità del gel, favorendo la retrodiffusione
acida e lesioni superficiali. La barriera muco-bicarbonatofosfolipidi rappresenta l’unico meccanismo pre-epiteliale
di difesa.
La successiva linea di difesa mucosale è costituita dallo
strato continuo di cellule epiteliali di superficie tra loro
interconnesse da giunzioni serrate. Le cellule di superficie
producono proteine specifiche, definite heat-shock protein,
in risposta a stress termici, ossidativi o agenti citotossici,
che esercitano un effetto protettivo contro tali insulti.
Il continuo rinnovamento cellulare contribuisce a mantenere l’integrità strutturale della mucosa. La completa
rigenerazione dell’epitelio di superficie avviene nell’arco
di 3-7 giorni, mentre il rinnovamento cellulare a livello
delle ghiandole impiega alcuni mesi. Pertanto, lesioni
superficiali dell’epitelio vengono riparate nell’arco di
pochi minuti attraverso la migrazione di cellule localizzate in prossimità delle ghiandole gastriche. Tale migrazione precede ed è indipendente dalla proliferazione
di cellule progenitrici, che richiede tempi più lunghi.
Quest’ultima è controllata da fattori di crescita, il cui
principale recettore è quello per l’EGF, bersaglio elettivo
anche dei fattori di crescita mitogenici, quali il TGF-␣
e l’IGF-1 (Insulin-like Growth Factor 1).
Un normale microcircolo mucosale è essenziale per l’ossigenazione, la supplementazione in nutrienti e la rimozione
di sostanze tossiche. Le cellule endoteliali che rivestono
il microcircolo producono potenti vasodilatatori, quali
l’ossido nitrico e la prostaciclina 2 (PGI2) che proteggono la mucosa gastrica da potenti vasocostrittori, quali
il leucotriene C4, il trombossano A2 e le endoteline, e
prevengono l’adesione piastrinica e leucocitaria all’endotelio del microcircolo, mantenendo la pervietà del flusso.
L’abolizione di questa risposta protettiva attraverso meccanismi che riducono il flusso mucosale provoca lesioni
necrotico-emorragiche.
La continua produzione mucosale di PGE2 e PGI2 rappresenta un meccanismo cruciale per il mantenimento dell’integrità mucosa, in quanto tutti i meccanismi di difesa sono
stimolati o facilitati dalle PG. Tali molecole inibiscono la
secrezione acida, stimolano la produzione di muco, bicarbonato e fosfolipidi, aumentano il flusso ematico mucosale e accelerano la guarigione delle lesioni epiteliali.
conseguente danno locale. Entro 10 minuti dalla somministrazione di acido acetilsalicilico è possibile rilevare,
in microscopia sia ottica sia elettronica, la presenza di
lesioni delle cellule epiteliali, mentre, entro 15-30 minuti,
l’endoscopia dimostra emorragie subepiteliali ed erosioni,
principalmente nell’antro.
A livello sistemico, i FANS, attraverso il blocco della COX,
inibiscono la sintesi di PG, responsabili, come si è detto,
del mantenimento della normale integrità mucosa. La
figura 25.7 mostra come dall’acido arachidonico possano
originare sostanze protettive (PG) o aggressive (leucotrieni) nei confronti della mucosa gastrica. La sintesi di PG
è catalizzata dalle COX-1 e COX-2. La COX-1 è espressa
in maniera costitutiva in diversi tessuti dell’organismo, la
COX-2 non è presente stabilmente, ma la sua espressione
viene indotta in risposta a processi infiammatori. I FANS
tradizionali inibiscono entrambe le forme enzimatiche e,
di conseguenza, causano danno gastrico per la marcata
riduzione del contenuto mucosale di PGE2. Al contrario,
le nuove molecole antinfiammatorie, selettivamente attive
sulla COX-2 (espressa solo nella flogosi), non interferiscono con la produzione mucosale di PG. Tuttavia, evidenze
più recenti suggeriscono che entrambe le isoforme (COX-1
e COX-2) svolgano un ruolo importante nella sintesi delle
PG e nel mantenimento dell’integrità mucosale gastrica.
Anche una normale attività motoria dello stomaco contribuisce al mantenimento di un normale flusso ematico.
Contrazioni di elevata ampiezza, anch’esse secondarie
alla ridotta sintesi di PG, determinano, infatti, riduzione
del flusso ematico mucosale, a sua volta responsabile di
ipossia, attivazione dei neutrofili e produzione di radicali
liberi dell’ossigeno.
Fisiopatologia del danno da FANS
Come riportato nella tabella 25.5, l’assunzione di FANS
può causare alterazioni a carico di tutto il tratto gastrointestinale.
Il danno a carico della mucosa gastrica si verifica attraverso un meccanismo locale e uno sistemico. I FANS sono
perlopiù acidi organici deboli, che a pH acido si trovano
in forma non ionizzata, quindi altamente lipofilica, in
grado di attraversare la barriera mucosa e accumularsi
nelle cellule epiteliali. A tale livello il pH intracellulare
basico li riporta alla forma ionizzata, configurando il cosiddetto fenomeno dello “ion trapping”. Ne conseguono
alterazioni sia di tipo fisico, l’aumento dell’osmolarità
intracellulare, sia di tipo metabolico, il disaccoppiamento
della fosforilazione ossidativa mitocondriale, l’inibizione
della citocromo C ossidasi con riduzione dell’ATP e la
maggiore produzione di radicali liberi dell’ossigeno con
Prevenzione del danno da FANS
La prevenzione del danno gastroduodenale inizia con
l’impiego dei FANS solo in caso di reale necessità. Le linee
guida, a tal fine, sottolineano l’opportunità di individuare
a priori soggetti a rischio di complicanze e raccomandano
la scelta di molecole a minore lesività (Tab. 25.7), oltre
alla definizione di una dose minima efficace, all’utilizzo
di gastroprotettori, quali i PPI e il misoprostolo (analogo
delle PG). Gli H2-antagonisti (cimetidina, famotidina,
ranitidina) hanno mostrato una minore efficacia. Si stima
che il corretto impiego dei PPI sia in grado di ridurre il
rischio di complicanze del 40-50%.
Gli inibitori selettivi delle COX-2 sembrano dotati di una
minore lesività gastroduodenale e di un’efficacia terapeutica sovrapponibile ai FANS tradizionali. Il loro uso,
tuttavia, è associato a un aumentato rischio di eventi
cardiovascolari.
C0125.indd 653
653
3
Manifestazioni cliniche
I sintomi della gastropatia da FANS sono gli stessi di una
sindrome dispeptica dominata da dolori epigastrici e nausea. Il quadro può evolvere, sul piano patologico, fino
alla comparsa di ulcera gastrica e gastrite acuta emorragica, che possono determinare sanguinamenti profusi. È
importante sottolineare che la severità dei sintomi raramente correla con quella delle lesioni e che sintomi rilevanti possono mancare nel 40% dei pazienti con lesioni
erosivo-ulcerative e nel 60% dei pazienti che sviluppano
sanguinamento.
6/9/10 10:54:48 AM
654
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Figura 25.7
Vie di sintesi di
prostaglandine
e leucotrieni a
partire dall’acido
arachidonico.
Fosfolipidi di membrana
Fosfolipasi A2
Acido arachidonico
5-lipo-ossigenasi
(LOX)
Ciclo-ossigenasi
(COX-1 e COX-2)
Leucotrieni (LT)
Prostaglandine (PG)
LTA4
PGG2
LTB4
LTC4
PGH2
LTD4
Trombossano
A2
LTE4
Trombossano
B2
Tabella 25.7 Rischio relativo di tossicità gastrointestinale
di alcuni FANS di comune impiego
Molecola
Ibuprofene
Fenoprofene
Acido acetilsalicilico
Diclofenac
Sulindac
Diflunisal
Naproxene
Indometacina
Tolmetin
Piroxicam
Ketoprofene
Azapropazone
Rischio relativo
1,0
1,6
1,6
1,8
2,1
2,2
2,2
2,4
3,0
3,8
4,2
9,2
IC (95%)
1,0-2,5
1,3-2,0
1,4-2,3
1,6-2,7
1,2-4,1
1,7-2,9
1,9-3,1
1,8-4,9
2,7-5,2
2,7-6,4
4,0-21,0
IC = intervallo di confidenza
Gastrite cronica atrofica autoimmune
La gastrite cronica atrofica autoimmune (gastrite cronica
atrofica di tipo A) coinvolge corpo e fondo ed è trasmessa
con carattere autosomico dominante a penetranza incompleta. È caratterizzata dalla presenza di anticorpi circolanti
C0125.indd 654
PGD2
PGE2
PGF2a
PGI2
6-KETOPGF1a
anticellule parietali gastriche e antifattore intrinseco. Si
tratta di una condizione a lenta evoluzione, che si manifesta quando il numero di cellule parietali si riduce al punto
tale da rendere lo stomaco incapace di produrre quantità
sufficienti di acido, pepsinogeno e fattore intrinseco. Alla
ridotta biodisponibilità di quest’ultimo conseguono il
malassorbimento di vitamina B12 e lo sviluppo di anemia
perniciosa.
Il fatto di essere, nella maggior parte dei casi, asintomatica
ostacola l’acquisizione di dati certi circa la sua epidemiologia. La prevalenza di questa gastrite, comunque, è
maggiore nel sesso femminile e nel Nord Europa.
Fisiopatologia delle lesioni
La natura autoimmune della malattia è confermata dalla
positività degli anticorpi anticellule parietali gastriche e
antifattore intrinseco, dalla frequente associazione con
altre malattie autoreattive (tiroidite di Hashimoto, malattia di Graves, malattia di Addison, vitiligine, ipoparatiroidismo autoimmune) e dalla frequente associazione
con l’aplotipo HLA-B8/DR3.
A tutt’oggi non è completamente chiara la sequenza di
eventi che porta alla produzione di autoanticorpi e alla genesi delle lesioni. Gli anticorpi anticellule parietali, diretti
nei confronti delle subunità ␣ e  della pompa protonica
(H+/K+-ATPasi), sono presenti nell’80-90% dei pazienti
con anemia perniciosa, mentre i due tipi di anticorpi
6/9/10 10:54:48 AM
Capitolo 25 - MALATTIE DELLO STOMACO
antifattore intrinseco – bloccante di tipo I e legante di
tipo II – sono rispettivamente presenti nel 70% e nel 30%
dei pazienti. Più recentemente sono stati descritti cloni
T-cellulari reattivi contro le subunità ␣ e ( della pompa
protonica ed è stata documentata un’aumentata apoptosi
Fas-Fas ligando mediata delle cellule parietali.
Il processo infi ammatorio, a carico di corpo e fondo
dello stomaco, è caratterizzato dall’infiltrazione di cellule mononucleate, plasmacellule e linfociti T, che determina la rarefazione o la scomparsa delle ghiandole
ossintiche e la conseguente atrofia della mucosa. A ciò
consegue la progressiva sostituzione della mucosa normale da parte di isole di mucosa pilorica, pseudopilorica
e intestinale (Fig. 25.8), anche se piccole aree di mucosa
ossintica rimangono intatte, anche in corso di patologia
avanzata. La metaplasia intestinale è generalmente di
tipo completo ed è caratterizzata dalla presenza di enterociti e goblet cell sulla superficie e di enterociti delle
cripte, cellule di Paneth ed endocrine nella porzione
basale.
L’ipoacloridria, per la perdita del normale feedback negativo sulle cellule G antrali, determina l’iperplasia di tale
popolazione cellulare e ipergastrinemia. Quest’ultima
rappresenta un potente fattore trofico per le cellule ECL
(enterochromaffin-like cells). In alcuni casi l’iperplasia di
tali cellule può evolvere in displasia, formazione di microcarcinoidi ed eventuale sviluppo di carcinoidi gastrici
invasivi.
Manifestazioni cliniche
Il paziente affetto da gastrite cronica atrofica autoimmune si presenta con una sindrome dispeptica associata ad
anemia.
La sindrome dispeptica è caratterizzata da sintomi quali
ripienezza postprandiale, eruttazione, nausea, vomito,
gonfiore e distensione addominale. In una condizione
dominata dalla ridotta secrezione acida, epigastralgie
urenti sono relativamente rare e, quando presenti, sono
secondarie al reflusso duodeno-gastrico di materiale
biliare.
Per ciò che riguarda l’anemia, è necessario considerare
che nella gastrite autoimmune il malassorbimento di
vitamina B12 (per ridotta produzione di fattore intrinseco) coesiste con il malassorbimento di ferro (per ridotta
sintesi di acido). Ciò rende possibile il riscontro di forme
macrocitiche, microcitiche e miste con anemia normocitica caratterizzata da spiccata anisocitosi.
Altri sintomi sono rappresentati da glossite atrofica, con
superficie liscia, arrossata e dolente, anoressia e moderato
calo ponderale. Il deficit di vitamina B12 può determinare
le tipiche manifestazioni neurologiche consistenti in una
polineuropatia periferica con parestesie a carico delle
estremità, astenia e atassia.
La storia naturale di questa condizione può essere complicata dal possibile sviluppo di polipi iperplastici e adenomatosi, carcinoma e tumori endocrini. I polipi, riscontrati
nel 20-40% dei pazienti, sono in genere multipli, sessili e
inferiori a 2 cm di diametro. Sono più spesso iperplastici
ma, nel 10% dei casi, contengono foci di displasia. I tumori gastrici sono di tipo intestinale e insorgono da aree
di metaplasia, suggerendo che il nesso tra gastrite autoimmune e carcinoma sia rappresentato dalla trasformazione
displasica della metaplasia.
C0125.indd 655
655
Figura 25.8
Gastrite
cronica atrofica
autoimmune
con metaplasia
intestinale
(Alcian-PAS,
10×).
La biopsia del corpo gastrico mostra sclerosi moderata, flogosi interstiziale, metaplasia
intestinale completa e incompleta con evidenza di villi (freccia) e atrofia ghiandolare severa.
Non sono evidenti immagini riferibili a Helicobacter pylori.
Diagnosi
Spesso è l’anemia macrocitica, magari accompagnata da
ipergastrinemia, a fare sospettare, più degli stessi sintomi
dispeptici, una gastrite cronica atrofica autoimmune.
Altri importanti elementi clinici sono rappresentati dalle
manifestazioni neurologiche e dall’associazione con altre
malattie autoimmuni.
Il riscontro della positività autoanticorpale impone l’effettuazione di un esame endoscopico corredato da un adeguato campionamento bioptico per valutare la presenza di
atrofia e metaplasia. Tipicamente, l’assottigliamento della
mucosa del corpo e la riduzione del numero e dell’altezza
delle pliche aumentano l’evidenza endoscopica del reticolo vascolare della sottomucosa.
Il fatto che la presenza di gastrite cronica atrofica autoimmune con anemia perniciosa rappresenti una chiara situazione preneoplastica comporta la necessità di un periodico
controllo endoscopico-bioptico. Il rilievo di aspetti atipici
condiziona la riduzione dell’intervallo di sorveglianza.
3
Terapia
L’atrofia della mucosa gastrica non è reversibile. Di
conseguenza, le carenze nutrizionali da essa determinate (ferro e vitamina B12) recidivano inevitabilmente,
nonostante la loro completa correzione.
Il quadro dispeptico può giovarsi della somministrazione di procinetici (metoclopramide, domperidone,
clebopride, levosulpiride), mentre l’uso di inibitori
della secrezione acida è controindicato per evitare un
ulteriore stimolo all’ipergastrinismo.
Gastriti croniche infettive
L’elevato contenuto di acido rende lo stomaco inospitale
per la maggior parte dei microrganismi. Tuttavia, in pazienti con atrofia gastrica, ridotta secrezione acida, deficit della
risposta immune, infezioni sistemiche, l’ambiente gastrico
può essere colonizzato da agenti infettivi di varia natura.
6/9/10 10:54:48 AM
656
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Virus
Rotavirus enterici e calicivirus probabilmente infettano
lo stomaco nel corso di gastroenteriti, anche se non è
stata documentata alcuna modificazione della mucosa
gastrica in corso di tali infezioni. Solo il citomegalovirus
(CMV) determina caratteristiche patologiche distintive.
La gastrite da CMV si sviluppa prevalentemente in bambini o pazienti immunocompromessi e si associa a una
concomitante infezione in altri distretti. Endoscopicamente, la mucosa può apparire del tutto normale o può
presentare erosioni o ulcerazioni a impronta emorragica.
Una manifestazione frequente è rappresentata da una
massiva iperplasia foveolare accompagnata da edema e
infiammazione moderata a carico della lamina propria.
L’aspetto endoscopico che ne deriva è rappresentato da
una gastropatia a pliche giganti, indistinguibile dalla malattia di Ménétrier. La diagnosi della gastrite da CMV si
basa sulla dimostrazione delle caratteristiche inclusioni
virali, nucleari o citoplasmatiche, mediante tecniche di
immunoistochimica o di ibridizzazione in situ. Il farmaco di scelta è rappresentato dal ganciclovir che inibisce
selettivamente la DNA-polimerasi del CMV.
Batteri
Una sovracrescita batterica può colonizzare lo stomaco
in una serie di condizioni caratterizzate da ipoacloridria
(gastrite atrofica, antrectomia, vagotomia, uso prolungato
di antagonisti dei recettori H2 o di PPI). In tali condizioni, la sovracrescita batterica non determina lo sviluppo
di una risposta infiammatoria e, quindi, diversamente
dall’Hp, è responsabile di una colonizzazione più che di
un’infezione.
La tubercolosi gastrica primaria è rara nei paesi industrializzati. In corso di infezione disseminata può determinare
la formazione di granulomi necrotizzanti. Il riscontro
nella lamina propria di istiociti schiumosi, talvolta aggregati in formazioni granulomatose non associate a necrosi,
deve sollevare il sospetto di un’infezione da Mycobacterium
avium intracellulare.
Negli ultimi anni è stato registrato un incremento dei
casi di gastrite sifilitica in pazienti infetti da virus HIV.
Le lesioni, per l’ispessimento delle pliche associato alla
comparsa di erosioni e ulcerazioni, mimano talvolta il
quadro endoscopico del linfoma. I sintomi includono
dispepsia severa, nausea, vomito, anoressia e rapido calo
ponderale. La diagnosi è spesso rallentata da un basso
indice di sospetto. La spirocheta può essere evidenziata in
sezioni trattate con colorazione argentica e il trattamento
standard è quello della sifilide secondaria (penicillina).
Funghi
La presenza di Candida, Histoplasma capsulatum e Mucoraceae è stata più volte documentata nello stomaco di
pazienti immunocompromessi. Anche se le ife possono
essere ritrovate alla base di ulcere, la loro presenza deve
essere considerata come la colonizzazione secondaria di
una lesione preesistente.
Parassiti
Lo stomaco rappresenta un ambiente molto sfavorevole
per le infestazioni da parassiti; tuttavia, sono descritti casi
di parassitosi sistemiche con coinvolgimento gastrico.
C0125.indd 656
Il Cryptosporidium species è stato documentato a livello
epiteliale ma in assenza di segni di flogosi in atto, mentre la giardia intestinale è stata identificata nella mucosa
gastrica, in particolare quando sono presenti atrofia e
metaplasia intestinale. Inoltre, lo Strongyloides stercoralis
può coinvolgere lo stomaco, soprattutto in corso di infestazioni disseminate. Sia larve sia parassiti adulti possono
essere rilevati nella mucosa gastrica in associazione a uno
spettro di quadri macro- e microscopici, variabile dall’assenza di lesioni alla presenza di formazioni granulomatose
contenenti frammenti di parassiti, fino alla presenza di
danno mucosale diffuso, emorragia e necrosi.
Tra i nematodi, gli unici in grado di infestare la parete dello stomaco umano sono quelli appartenenti alla famiglia
delle Anisakidae, i cosiddettii “sushi worm”. Le Anisakidae
sono un’importante causa di morbilità in Paesi nei quali
vengono consumate notevoli quantità di pesce crudo,
per la possibile presenza di larve nel tessuto muscolare di
molte specie di pesci commestibili. In una piccola quota di
persone che assumono il pesce contaminato le larve penetrano la parete gastrica, inducendo la formazione di un infiltrato eosinofilo a tale livello. In casi ad andamento cronico si rileva una reazione granulomatosa che circonda i
parassiti.
Gastriti acute
Le due forme principali di gastrite acuta sono la gastrite
acuta da Hp e quella erosivo-emorragica, causata da fattori eziologici eterogenei. Una terza condizione più rara
è la gastrite flemmonosa o suppurativa determinata da
batteri piogeni.
L’infezione da Hp, come già detto, esita comunemente
in un quadro di gastrite cronica. Tale processo, tuttavia,
nelle sue fasi iniziali, è caratterizzato da un’infiammazione
mucosale acuta di corpo e antro (importante infiltrato di
polimorfonucleati con possibili ascessi interstiziali) che,
solo in taluni casi, produce sintomi clinicamente rilevanti
(dolore epigastrico, nausea e vomito) e di breve durata.
Poiché ciò si verifica più spesso in pazienti di giovane età,
che raramente vanno incontro a un esame endoscopico,
le informazioni disponibili sulla gastrite acuta da Hp sono
scarse e poco dettagliate.
Le sostanze in genere implicate nella genesi della gastrite
acuta erosivo-emorragica sono numerose e comprendono
alcol, FANS, salicilati e steroidi. Un analogo quadro patologico si riscontra in pazienti in stato di shock secondario a politraumatismo, interventi chirurgici complessi,
ustioni diffuse, ipotermia prolungata ed è considerato
conseguente a ipoperfusione e aumentata permeabilità
mucosale. La presenza di erosioni diffuse si accompagna
a lesioni istologiche, quali edema della lamina propria,
congestione capillare ed emorragie interstiziali di vario
grado. A differenza della forma da Hp, l’infiammazione
è di grado lieve o assente, costituita da uno scarso infiltrato neutrofilo. Il quadro clinico è dominato da massive
emorragie digestive (si veda il Capitolo 23).
La gastrite acuta flemmonosa è caratterizzata dalla presenza di estese aree di necrosi purulenta che coinvolge la
parete gastrica a tutto spessore. I casi riportati sono rari,
la maggior parte dei quali in neonati, anziani, alcolisti e
immunocompromessi.
6/9/10 10:54:50 AM
Capitolo 25 - MALATTIE DELLO STOMACO
Malattia di Ménétrier
La malattia di Ménétrier, o gastropatia ipertrofica a pliche
giganti, è una condizione iperproliferativa dello stomaco, causata da un’alterata regolazione del recettore della
tirosina-chinasi. È una rara condizione cronica, più frequente nel sesso maschile, con un picco di insorgenza
intorno ai 55 anni ed è considerata precancerosa, con
possibile evoluzione in adenocarcinoma gastrico nel
10-15% dei casi. Può eccezionalmente presentarsi anche in
età pediatrica, con un andamento autolimitante nell’arco
di alcune settimane e regressione completa delle lesioni.
Nell’infanzia è frequente il riscontro di una infezione da
CMV e, occasionalmente, da Hp e Herpes simpex.
Le lesioni sono rappresentate da un marcato ispessimento
delle pliche del corpo e del fondo gastrico, che possono raggiungere fino a qualche centimetro di spessore,
assumendo un aspetto simil-polipoide con ulcerazioni
superficiali (Fig. 25.9).
Sul piano istologico è evidente una massiccia espansione
delle cellule mucose, che determina iperplasia foveolare,
accompagnata da riduzione delle cellule principali e parietali, atrofia ghiandolare, lassità delle giunzioni strette
e modesto infiltrato della lamina propria, associato a un
accumulo irregolare di eosinofili che possono, talvolta,
rappresentare il tipo cellulare predominante. La muscularis
mucosae si presenta ispessita, disorganizzata e invade la
lamina propria.
La patogenesi non è nota. Si ritiene, tuttavia, che l’abnorme attivazione del recettore tirosino-chinasico per
l’EGF, secondaria a un’aumentata espressione locale del
suo ligando TGF-␣, porti all’iperespansione delle cellule
mucose di superfice e al conseguente ispessimento plicale.
Il TGF-␣ rappresenta, infatti, un importante mediatore
dell’omeostasi mucosale gastrica, attraverso la stimolazione dei processi di riparazione, migrazione e proliferazione
cellulare ed è un potente stimolatore della produzione
gastrica di muco.
Sul piano clinico la malattia di Ménétrier può presentarsi
con dolore addominale, epigastralgie, nausea, vomito,
diarrea, inappetenza, calo ponderale, talvolta anche superiore ai 20 kg, e anemia sideropenica da perdita ematica
657
Figura 25.9
Malattia di
Ménétrier: sono
evidenti pliche
giganti del corpo
dello stomaco
nel contesto di
una mucosa
iperemica.
attraverso le ulcerazioni. La perdita di proteine secondaria
all’alterazione della permeabilità mucosale gastrica, da
danno delle giunzioni serrate, può determinare la comparsa di edemi declivi, versamento pleurico e ascite su base
discrasica. Inoltre, è presente un’aumentata incidenza di
eventi trombotici, anche in conseguenza della riduzione
della volemia efficace.
La documentazione endoscopica delle alterazioni mucosali, insieme alle caratteristiche istologiche, permette la
diagnosi di questa condizione, che va posta in diagnosi
differenziale con altre forme di gastrite ipertrofica, quali sindrome di Zollinger-Ellison, gastropatia ipertrofica
ipersecretiva e gastrite linfocitica, e con neoplasie infiltranti.
La terapia è volta alla gestione dell’anemia e dell’ipoalbuminemia e si avvale di una dieta iperproteica e integrazioni specifiche. Non esiste una terapia farmacologica, ma
è stato suggerito l’utilizzo di anticolinergici, octreotide,
steroidi, acido tranexamico e antisecretori. A conferma del
ruolo patogenetico del TGF-␣, il trattamento sperimentale
con un anticorpo monoclonale contro il suo recettore si
è dimostrato efficace.
Il rischio di evoluzione neoplastica impone un periodico
follow-up endoscopico e istologico.
3
Ulcera peptica
L’ulcera peptica è una lesione della mucosa, caratterizzata
da una perdita di sostanza che, a differenza delle erosioni,
si approfondisce oltre la muscolaris mucosae , causata
dell’azione di pepsina e acido cloridrico. In questa sezione verranno trattate l’ulcera gastrica (UG) e l’ulcera duodenale (UD), ma lesioni del tutto sovrapponibili possono
manifestarsi nell’esofago o in corrispondenza dell’ansa
anastomotica nel paziente gastroresecato.
Epidemiologia
Si stima che in circa il 10% della popolazione generale
verrà posta, nel corso della vita, la diagnosi di ulcera
peptica. Sul piano epidemiologico, tra UG e UD sono
evidenti alcune differenze; se la prevalenza dell’UG è
valutata intorno al 2,5% della popolazione adulta, con
C0125.indd 657
un valore doppio nell’uomo rispetto alla donna, quella
dell’UD si attesta intorno all’1,8% senza differenze tra i
due sessi.
L’incidenza della malattia si è modificata significativamente negli ultimi vent’anni in relazione al trattamento
dell’infezione da Hp e alla prevenzione del danno da
FANS. Come esposto nella tabella 25.8, infatti, una sostanziale riduzione dell’incidenza si è resa evidente negli
ultimi anni sia per l’UG sia per l’UD.
Fattori di rischio per l’insorgenza dell’ulcera peptica
sono il fumo di sigaretta, l’abuso di alcolici e alcuni
fattori genetici, quali il gruppo sanguigno 0 e alcuni
aplotipi HLA; il consumo di FANS rappresenta il fattore
di rischio più significativo per l’UG, mentre l’infezione
da Hp lo è per l’UD. Tale dato si riflette sull’età media
6/9/10 10:54:50 AM
658
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Tabella 25.8 Modificazioni dell’epidemiologia dell’ulcera
peptica (1993-2002)
UD non complicata
UG non complicata
Ulcera peptica
sanguinante
Ulcera peptica
perforata
Incidenza
nel 1993
(persone/anno)
0,55/1000
0,56/1000
0,55/1000
Incidenza
nel 2002
(persone/anno)
0,37/1000
0,40/1000
0,57/1000
0,14/1000
0,08/1000
Tabella 25.9
Ulcera
duodenale
Ulcera
gastrica
Prevalenza (%) dei fattori responsabili
dell’insorgenza dell’ulcera
Infezione
da Hp
50-85
FANS
Zollinger
Miscellanea
5-25
0,1-1
2-4
50-70
15-30
1-3
2-4
UD = ulcera duodenale; UG = ulcera gastrica.
di insorgenza della malattia, più precoce nell’UD (nel
quinto-sesto decennio di vita), rispetto all’UG (nel sestosettimo decennio di vita).
In assenza di una corretta strategia terapeutica e preventiva (eminentemente nei confronti del consumo di FANS),
l’ulcera peptica recidiva nell’80% dei casi entro l’anno,
rappresentando, quindi, un problema clinico rilevante
anche per la frequente associazione con complicanze
severe, quali emorragia e perforazione. A tal proposito
va sottolineato che, se l’incidenza del sanguinamento
è rimasta stabile nel corso degli ultimi anni, l’incidenza
delle ulcere perforate si è marcatamente ridotta.
Fisiopatologia
I diversi fattori responsabili dell’insorgenza dell’ulcera
peptica sono riassunti nella tabella 25.9. Anche se, come già detto, l’infezione da Hp rappresenta un fattore di
rischio importante per l’UD, soggetti Hp-positivi presentano un aumentato rischio per entrambe le forme. Negli
anni Ottanta l’infezione da Hp era responsabile di più
del 90% delle UD e di circa il 70% delle UG. La riduzione
dell’incidenza e della prevalenza dell’ulcera peptica nei
Paesi industrializzati risente, quindi, della riduzione della
prevalenza dell’infezione da Hp. Solo una piccola percentuale (10-15%) dei soggetti con infezione da Hp sviluppa
nel corso della vita un’ulcera. Ciò ha portato a ipotizzare
l’esistenza di cofattori coinvolti nella genesi della malattia
ulcerosa, verosimilmente di tipo genetico e ambientale o
Figura 25.10
Aspetto
endoscopico di
ulcera gastrica
(prepilorica)
benigna. Non
sono evidenti
segni di
sanguinamento.
Le caratteristiche
della lesione non
permettono di
definirne la causa.
C0125.indd 658
legati alle diverse caratteristiche dei ceppi di Hp (si veda
in precedenza, Gastrite cronica Hp-relata). Il ruolo dell’infezione da Hp nella fisiopatologia dell’ulcera peptica è
testimoniato dalla stretta associazione epidemiologica
tra prevalenza dell’infezione e prevalenza della malattia
nelle varie popolazioni del mondo e dall’evidenza scientifica di una riduzione dell’incidenza delle recidive dopo
eradicazione dell’infezione.
Come già detto, l’assunzione di FANS favorisce l’insorgenza
di danno mucosale gastrico per l’inibizione delle COX,
con conseguente riduzione della produzione di PG, muco
e bicarbonati e inibizione della proliferazione delle cellule
epiteliali. La coesistenza dell’infezione da Hp determina
un incremento della lesività farmaco-indotta.
Il fumo di sigaretta induce una ridotta produzione di PG a
livello della mucosa gastrica e duodenale e inibisce la secrezione di bicarbonati a livello della mucosa duodenale,
oltre ad aumentare la secrezione acida e favorire la proliferazione dell’Hp. Inoltre, il fumo di sigaretta ostacola
la guarigione delle lesioni ulcerose e sinergizza con l’Hp
nell’aumentare il rischio di recidiva.
Il consumo di alcolici stimola la secrezione acida gastrica,
ma a concentrazioni non elevate causa solo lesioni superficiali di incerto significato clinico. Analogamente,
uno smodato consumo di caffè e tè, potenti secretagoghi
gastrici, non si è dimostrato sicuramente associato a una
maggiore incidenza di ulcera peptica.
Una serie di altre condizioni morbose è stata associata ad
aumentato rischio di ulcera peptica, tra esse l’infezione da
CMV, la tubercolosi, la malattia di Crohn, la cirrosi epatica, l’insufficienza renale, la sarcoidosi e le malattie mieloe linfoproliferative. Oltre ai FANS, molti altri farmaci sono
potenzialmente ulcerogeni, quali steroidi, bifosfonati,
agenti chemioterapici e cloruro di potassio.
Manifestazioni cliniche
Il quadro clinico dell’ulcera peptica varia a seconda della sede di insorgenza delle lesioni (Fig. 25.10). Le UG
possono manifestarsi con quadri che vanno da un’anemia sideropenica asintomatica fino a un addome acuto
con perforazione ed emorragia. I pazienti con dolore
addominale e/o sintomi dispeptici vanno attentamente
inquadrati, in quanto tale sintomatologia aspecifica è
sovrapponibile a quella di diverse altre condizioni patologiche dell’apparato gastrointestinale e non (Tab. 25.10).
Il dolore, a insorgenza notturna nel 30% dei pazienti, è
generalmente localizzato all’epigastrio e può essere de-
6/9/10 10:54:51 AM
Capitolo 25 - MALATTIE DELLO STOMACO
Tabella 25.10
Diagnosi differenziale nei pazienti che
manifestano sintomi suggestivi di ulcera
Malattia da reflusso gastroesofageo
Dispepsia funzionale
Patologia colecistica
Pancreatite
Neoplasia gastrica
Neoplasia pancreatica
Ischemia miocardica
scritto come sordo e insistente o come urente; inoltre
può essere irradiato alla regione dorsale nel 20% dei casi
e, in circa la metà, è aggravato dall’assunzione di cibo. La
nausea e il vomito rappresentano sintomi frequentemente
associati al dolore nell’ulcera gastrica e possono portare
a calo ponderale anche in assenza di evoluzione maligna
della lesione.
Anche nell’UD il sintomo più frequente è il dolore epigastrico (Tab. 25.11), ma alcune caratteristiche sono differenti; il dolore non è irradiato, presenta insorgenza
tardiva rispetto all’assunzione di cibo, spesso è notturno
e associato a nausea e vomito. L’assunzione di cibo, latte
e antiacidi migliora il dolore.
Tuttavia, la semplice valutazione delle caratteristiche del dolore non consente una sicura differenziazione tra UG e UD.
È opportuno, infine, sottolineare che la malattia ulcerosa, in
particolare l’UD, può decorrere del tutto asintomatica.
Complicanze
Un quarto circa dei pazienti con ulcera peptica va incontro a complicanze severe, rappresentate da eventi acuti –
emorragia e perforazione – o cronici – stenosi cicatriziale
e penetrazione nel pancreas. I più colpiti sono i soggetti
in trattamento cronico con FANS e i pazienti anziani. Il
sospetto di complicanza spesso nasce dalla modificazione
delle caratteristiche del dolore che diventa continuo,
può essere irradiato posteriormente, non responsivo alla
terapia con PPI e aggravato dall’ingestione di cibo.
L’emorragia rappresenta la complicanza più frequente,
interessa il 15-20% dei pazienti con ulcera peptica e
può manifestarsi in forma acuta o cronica, con insorgenza di anemia sideropenica, accompagnata o meno
da manifestazioni di ipovolemia acuta. Per gli aspetti
diagnostici e terapeutici di tale complicanza si rimanda
al Capitolo 23.
La perforazione si verifica in circa il 2-10% delle ulcere peptiche. In genere coinvolge la parete anteriore del duodeno
o la porzione antrale e la piccola curvatura gastrica. Tale
complicanza determina l’insorgenza di una peritonite
chimica, legata all’irritazione del peritoneo da parte del
contenuto gastrico, e batterica, secondaria alla diffusione
a livello peritoneale di batteri derivanti dalla flora orofaringea. Ne consegue l’insorgenza di un quadro di addome acuto con dolore severo, spesso localizzato nella fossa
iliaca destra e poi diffuso a tutto l’addome ed esacerbato
dai movimenti. Si associa distensione addominale, irrequietezza e, all’esame obiettivo, è possibile apprezzare
C0125.indd 659
Tabella 25.11
Manifestazioni cliniche dell’ulcera
duodenale
Sintomo
Dolore epigastrico
Beneficio dall’assunzione di latte
Beneficio dall’assunzione di cibo
Ricorrenza notturna
Irradiazione posteriore
Nausea
Vomito
659
Pazienti (%)
61-86
39-86
20-63
50-88
20-31
49-59
25-57
l’assenza della peristalsi intestinale e la contrazione di
difesa della parete addominale. La percussione dell’addome permette di rilevare la scomparsa dell’aia di ottusità
epatica. La radiografia diretta dell’addome documenta la
presenza di aria libera e di livelli idroaerei conseguenti
all’ileo paralitico secondario. Tale complicanza rappresenta sempre un’emergenza chirurgica e, nell’imminenza
dell’intervento, è necessaria la tempestiva somministrazione di liquidi e antibiotici a largo spettro.
La ricorrenza di ulcere del canale pilorico o del bulbo duodenale può determinare stenosi come esito della fibrosi
cicatriziale. I sintomi dipendono dal difficoltoso transito
del contenuto luminale e sono rappresentati da episodi
ricorrenti di vomito alimentare, nausea, meteorismo, ripienezza postprandiale e sazietà precoce. Possono, inoltre,
comparire calo ponderale, disidratazione, ipocloremia, ipokaliemia e alcalosi metabolica. La conseguente dilatazione
gastrica può essere rilevata mediante percussione e confermata da una radiografia delle prime vie. Tale condizione va
differenziata dalla presenza di lesioni neoplastiche antropiloriche che sono responsabili di quadri clinici analoghi.
Dal punto di vista terapeutico, la somministrazione di
farmaci procinetici non sempre è efficace, in quanto spesso
accentua la sintomatologia ostruttiva. Misure efficaci sono
rappresentate dalla dilatazione per via endoscopica, attraverso un dilatatore pneumatico, o, in caso di insuccesso,
dall’intervento chirurgico di resezione.
A differenza delle UD, le UG sono associate a un aumentato rischio di trasformazione maligna. Ciò in genere
avviene nei primi 3 anni dopo la diagnosi e riguarda il
2% dei casi. Segni endoscopici di tale trasformazione sono
rappresentati dalle maggiori dimensioni del cratere ulcerativo e dalla presenza di bordi rilevati, irregolari e rigidi.
3
Diagnosi
Come si è detto, la scarsa specificità dei sintomi, in particolare del dolore epigastrico, riduce la loro predittività
nei confronti della lesione ulcerativa. Di conseguenza, la
diagnosi di certezza è fondata sull’esofagogastroduodenoscopia, corredata da biopsie per evidenziare la possibile
concomitante infezione da Hp e l’eventuale degenerazione neoplastica.
È importante sottolineare che, poiché la sintomatologia
che porta il paziente dal medico è essenzialmente rappresentata da sintomi dispeptici, l’effettuazione dell’esofagogastroduodenoscopia è regolata dall’algoritmo diagnostico
già presentato nel Capitolo 23.
6/9/10 10:54:52 AM
660
Parte 3 - MALATTIE DELL’APPARATO DIGERENTE
Terapia
Farmaci antisecretivi (H2-antagonisti o PPI) consentono il rapido miglioramento dei sintomi e la cicatrizzazione della lesione. Una recente meta-analisi
dei trial controllati randomizzati ha dimostrato la
maggior efficacia dei PPI.
La cicatrizzazione è favorita dalla sospensione di
concomitanti terapie gastrolesive, dall’astensione
dal fumo e dall’eradicazione di un’eventuale infezione da Hp. Una terapia di mantenimento con PPI
o H2-antagonisti è indicata nei pazienti a elevato
rischio, in particolare quelli che hanno sviluppato complicanze o manifestano frequenti recidive, i
portatori di ulcere Hp-negative o di ulcere giganti
refrattarie.
Per ulcera refrattaria si intende una condizione che
persiste dopo 12 settimane di terapia continuativa
con PPI o H2-antagonisti a dosaggio adeguato. Può
essere conseguente alla persistenza dell’infezione da
Hp, alla mancata sospensione dei FANS, alla presenza
di ulcere giganti che richiedono tempi di guarigione
più lunghi o di adenocarcinoma. La terapia dell’ulcera peptica refrattaria prevede l’individuazione del
meccanismo patogenetico che ne è responsabile e la
somministrazione prolungata di PPI.
La terapia chirurgica viene ormai riservata al trattamento dei pazienti intolleranti alla terapia medica
e in presenza di complicanze gravi delle ulcere refrattarie.
SINDROME DI ZOLLINGER-ELLISON
La sindrome di Zollinger-Ellison è caratterizzata da una
triade costituita da ipersecrezione acida gastrica, ulcerazioni multiple, tumore delle cellule non- localizzate nel
pancreas o in altri distretti.
La reale incidenza della sindrome non è chiara. Da un
lato l’ampia diffusione dei potenti farmaci antisecretori
ne maschera la sintomatologia, dall’altro la possibile incompletezza del quadro di esordio rende difficoltoso il suo
riconoscimento. La prevalenza della malattia sembra non
mostrare sostanziali differenze tra maschi e femmine.
La lesione responsabile del quadro è rappresentata da
un gastrinoma, il più frequente tumore a cellule insulari
dopo l’insulinoma. In un terzo dei pazienti con sindrome
di Zollinger-Ellison è riconoscibile una sindrome multiendocrina adenomatosa di tipo I (MEN-1, gastrinoma,
adenoma delle paratiroidi, altri adenomi pancreatici).
Manifestazioni cliniche
La malattia si manifesta con sintomi quali dolore o
bruciore epigastrico, ripienezza postprandiale, nausea
e vomito legati alla presenza di ulcerazioni duodenali
multiple. È presente diarrea, che nel 30% dei casi precede la comparsa dei sintomi dell’ulcera, ed è correlabile
all’effetto osmotico dell’ipersecrezione acida e all’abbassamento del pH nel lume intestinale che determina inattivazione della lipasi pancreatica; la conseguente ridotta
C0125.indd 660
idrolizzazione dei trigliceridi, a sua volta, è responsabile
della comparsa di steatorrea e della precipitazione dei sali
biliari. Infine, un’eccessiva acidificazione intraluminale
intestinale può determinare, anche a tale livello, un
danno della mucosa.
Diagnosi
Il sospetto clinico di sindrome di Zollinger-Ellison nasce
dal rilievo della puntuale recidiva sintomatologica e patologica alla sospensione della terapia con PPI e dell’ipergastrinemia persistente a distanza dalla sospensione di tali
farmaci; in corso di terapia con PPI, infatti, l’aumento della
gastrina si spiega per la mancata retroinibizione della secrezione gastrinica da parte della secrezione cloridrica ridotta.
La marcata ipergastrinemia rappresenta un importante
marker di sindrome di Zollinger-Ellison, ma la diagnosi
deve essere ulteriormente corroborata dall’effettuazione di
test funzionali, rappresentati dalla monitorizzazione della
gastrinemia dopo stimolo con calcio o secretina e.v.
Una volta documentata l’ipergastrinemia, è necessario
localizzare la sede della sua produzione. Indagini di imaging dell’addome devono essere mirate all’esplorazione
delle sedi che costituiscono il cosiddetto “triangolo del
gastrinoma”, delimitato superiormente dalla confluenza
del dotto cistico con il dotto epatico comune, inferiormente dalla giunzione tra II e III porzione duodenale e
medialmente dalla giunzione tra testa e corpo del pancreas, sede del 90% dei gastrinomi. L’ecoendoscopia è in
grado di rilevare il 50% delle localizzazioni duodenali e il
75-90% di quelle pancreatiche. La scintigrafia con analoghi radiomarcati della somatostatina, l’ecografia e la TC
dell’addome sono indagini meno sensibili, ma permettono di documentare un’eventuale diffusione metastatica,
frequentemente a carico del fegato.
Le complicanze sono le stesse dell’ulcera peptica: emorragia, perforazione, penetrazione e quadri subocclusivi/
occlusivi da cicatrizzazione delle pregresse ulcere.
Terapia
La terapia medica si fonda sull’utilizzo di antisecretivi
e di farmaci chemioterapici. La somministrazione di
octreotide, un analogo sintetico della somatostatina, inibisce il rilascio di gastrina e, di conseguenza,
la secrezione acida. L’asportazione chirurgica della
neoplasia, che spesso si avvale dell’endoscopia intraoperatoria, è indicata in assenza di metastasi e
ottiene una guarigione nel 40% dei casi. Le recidive
sono frequenti e, talvolta, è indicata una gastrectomia
totale a scopo palliativo.
LO STOMACO OPERATO
La rilevanza epidemiologica delle sindromi postgastroresezione si è notevolmente ridotta a seguito dell’impiego diffuso dei nuovi, potenti farmaci antisecretori. Attualmente,
pertanto, tali sindromi riguardano o pazienti operati da
lungo tempo o pazienti complicati nei quali si è reso necessario l’intervento chirurgico.
6/9/10 10:54:53 AM
Capitolo 25 - MALATTIE DELLO STOMACO
La vagotomia, tronculare, selettiva o superselettiva, ha lo
scopo di inibire la secrezione cloridrica vagomediata. La
tronculare è, in particolare, complicata, anche a distanza
di tempo, dalla cosiddetta “sindrome postvagotomica”,
caratterizzata da disturbi motori dello stomaco prossimale
(alterazione del riflesso di accomodazione e accelerato svuotamento dei liquidi), discinesie delle vie biliari e alterazioni motorie e secretive a carico di intestino tenue e colon.
L’alterata regolazione dello sfintere di Oddi e dello sfintere
esofageo inferiore predispone al reflusso duodeno-gastrico
e gastroesofageo, a stasi biliare con formazione di sabbia
e colelitiasi, a ridotta secrezione pancreatica esocrina con
malassorbimento lipidico e diarrea.
L’intervento di gastroresezione prevede l’asportazione della regione antro-pilorica e della porzione prossimale del
duodeno e comporta, quindi, la riduzione della minuta
frammentazione del bolo alimentare; in tale condizione
lo stomaco trattiene scarsamente i solidi al suo interno, i
quali subiscono un accelerato svuotamento responsabile,
a volte, di malassorbimento e diarrea su base osmotica.
L’anastomosi può essere termino-terminale con il duodeno
residuo (Billroth I) o termino-laterale con la prima ansa
digiunale (Billorth II). La ricostruzione secondo Billroth I è
gravata dalla frequente comparsa di sintomi dispeptici da
ostacolato transito ed è virtualmente abbandonata. Quella
secondo Billroth II, viceversa, può comportare una sindrome da maldigestione e malassorbimento, prevalentemente
a carico dei lipidi, per inadeguato mixing tra secrezioni
bilio-pancreatiche e materiale alimentare. Il principale
meccanismo alla base di tale condizione è legato al ridotto
flusso di cibo nell’ansa afferente (duodeno residuo), con
conseguente ridotta secrezione di secretina e pancreozimina e minore risposta enzimatica del pancreas. Infine, la
stasi a livello dell’ansa afferente può determinare un’anomala proliferazione batterica e conseguente alterazione dei
processi di assorbimento (si veda il Capitolo 26).
La ridotta produzione di acido e fattore intrinseco, legata
alla resezione di una porzione o di tutto lo stomaco, ha
ripercussioni sulla capacità di assorbire il ferro e la vitamina B12, con comparsa di anemia microcitica, macrocitica
o dimorfica.
La dumping syndrome è una complicanza frequente degli
interventi di resezione dello stomaco e talvolta anche della vagotomia. L’ingestione di alimenti ricchi in zuccheri,
fluidi o iperosmolari, induce la comparsa di ripienezza,
addominalgie e diarrea, associati a sintomi sistemici quali
episodi lipotimici, marcata astenia, sudorazione profusa, tachicardia e flushing. Tale corteo sintomatologico è
conseguente alla marcata distensione meccanica del duodeno, per mancato controllo pilorico dello svuotamento
gastrico, con stimolazione dei meccanocettori e rilascio di
eccessive quantità di serotonina, bradichinine, neurotensina e VIP. Inoltre, la presenza intraluminale di sostanze a
elevato effetto osmotico determina un eccessivo richiamo
di liquidi, con conseguente riduzione della volemia efficace. Il trattamento prevede l’adesione a rigorose norme
comportamentali: consumo di pasti piccoli e frequenti,
adeguata triturazione degli alimenti, ridotta assunzione di
liquidi durante i pasti e abolizione delle bevande zuccherate o ad attività osmotica. Addensanti, come la pectina,
sono in grado di rallentare lo svuotamento gastrico e può
essere utile assumere una posizione supina dopo i pasti.
Altri farmaci potenzialmente utili sono gli anticolinergici,
gli antiserotoninergici e l’octreotide. Talvolta si rende
necessaria una correzione chirurgica.
Esiste una forma tardiva di dumping syndrome che si manifesta con sintomi analoghi, ma a distanza di alcune ore
dall’assunzione del pasto, accompagnata a ipersecrezione
di insulina e conseguente ipoglicemia. Tale forma tende a
regredire spontaneamente nel tempo, trova giovamento
dagli stessi accorgimenti alimentari e non richiede l’intervento chirurgico.
661
3
Bibliografia
Barkun A, Leontiadis G. Systematic review of the symptom burden,
quality of life impairment and costs associated with peptic ulcer
disease. Am J Med 2010;123:358–66.
Dixon MF, Genta RM, Yardley JH et al. Classification and grading of
gastritis: the updated Sydney System. International Workshop
on the Hystopathology of Gastritis, Houston 1994. Am J Surg
Pathol 1996;20:1161–81.
Granstrom M, Lehours P, Bengtsson C et al. Diagnosis of
Helicobacter pylori. Helicobacter 2008;13:7–12.
Laine L, Takeuchi K, Tarnawski A. Gastric mucosal defense and
cytoprotection: bench to bedside. Gastroenterology 2008;135:41–60.
C0125.indd 661
Malfertheiner P, Megraud F, O’Morain C et al. Current concepts
in the management of Helicobacter pylori infection:
the Maastricht III Consensus Report. Gut 2007;56:
772–81.
Torres J, Backert S. Pathogenesis of Helicobacter pylori infection.
Helicobacter 2008;13:13–7.
Vaira D, Zullo A, Vakil N et al. Sequential therapy versus standard
triple-drug therapy for Helicobacter pylori eradication: a
randomized trial. Ann Intern Med 2007;146:556–63.
Yuan Y, Padol IT, Hunt RH. Peptic ulcer disease today. Nat Clin Pract
Gastroenterol Hepatol 2006;3:80–9.
6/9/10 10:54:53 AM
C0125.indd 662
6/9/10 10:54:53 AM