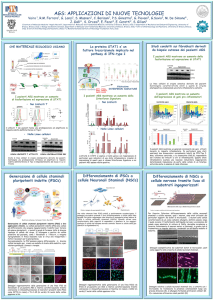
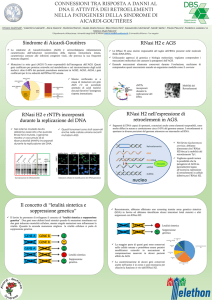
NEUROPATOLOGIA DELLA SINDROME DI
AICARDI-GOUTIÈRES
Peter G. Barth
Amsterdam – The Netherlands
Riassunto
La Sindrome di Aicardi-Goutières (AGS) è una patologia autosomica recessiva neurodegenerativa
con caratteristiche particolari che comprendono linfocitosi del liquor cefalo-rachidiano, interessamento delle
citochine (interferone alfa nel plasma e nel liquor), una distribuzione caratteristica delle calcificazioni
cerebrali e una perdita precoce di mielina. Sono però disponibili solo pochissimi studi neuropatologici
dettagliati a riguardo. Questo articolo si propone di passare in rassegna le osservazioni disponibili. Le
calcificazioni sono presenti sia sotto forma di concrezioni che di manicotti perivascolari di calcio che
circondano i piccoli vasi. L’interessamento dei piccoli vasi (microangiopatia) si manifesta attraverso una
distribuzione tipica di microinfarti in almeno uno dei casi studiati. Unitamente ai segni di interessamento
vascolare extracerebrale già segnalati in studi precedenti, la microangiopatia si presenta come un importante
meccanismo patogeno nell’AGS.
Introduzione
La Sindrome di Aicardi-Goutières (AGS), una patologia autosomica recessiva, presenta due
caratteristiche rilevanti che, però, non sono ancora comprese a fondo. La prima è rappresentata da
calcificazioni progressive localizzate soprattutto, ma non esclusivamente, nei gangli della base; la seconda è
una leggera pleocitosi linfocitica cronica nel liquor cefalo-rachidiano. La ricerca ormai classica pubblicata da
Jean Aicardi e Françoise Goutières nel 1984 1 si basa su esami clinici e analisi del liquor cefalo-rachidiano,
mentre le immagini neurologiche erano state ottenute mediante TAC. In quella pubblicazione, venivano citati
studi precedenti che, alla luce delle conoscenze acquisite nel frattempo, potrebbero essere stati casi di AGS
per i quali erano talvolta disponibili reperti autoptici ma in cui non si faceva menzione di un esame
citologico del liquor cefalo-rachidiano. È quindi impossibile affermare che tali studi precedenti si riferissero
a pazienti affetti da una “AGS ante litteram”. Un’altra scoperta fondamentale fu fatta soltanto in ricerche
successive, dopo l’introduzione della RM come tecnica di diagnostica per immagini: si tratta della grave
demielinizzazione che accompagna l’AGS. Ad oggi, è disponibile soltanto un referto autoptico dettagliato di
un caso di AGS diagnosticata quando il paziente era ancora in vita 2. Riassumerò ora questo referto e
aggiungerò alcune osservazioni sulla patologia di questa sindrome. La mia ricostruzione si basa su possibili
casi precedenti di AGS e di affezioni correlate che, col senno di poi, potrebbero essere ritenute forme di
AGS.
Osservazioni neuropatologiche
Il paziente su cui si impernia questa analisi visse fino a 17 anni e, mentre era in vita, gli fu diagnosticata
l’AGS. La diagnosi poggiava su una TAC caratteristica, sul fatto che il soggetto aveva una sorella con
caratteristiche analoghe e sulla presenza di linfocitosi nel liquor cefalo-rachidiano. In passato, sono già state
pubblicate le osservazioni neuropatologiche su questo caso 2 che evidenziava in particolare:
1.
Grave microencefalia;
2.
Demielinizzazione diffusa ma caratteristicamente disomogenea, con astrocitosi associata e assenza di
31
3.
4.
5.
6.
segni di accumulo o di segni palesi di degradamento della mielina;
Depositi calcifici nella sostanza bianca, nel talamo, nei gangli della base e nei nuclei dentati;
La neocorteccia e la corteccia cerebellare sono colpite da una moltitudine di microinfarti cuneiformi;
Calcificazione dei piccoli vasi a carico di tonaca media, avventizia e spazi perivascolari;
Infiammazione limitata alle aree di necrosi e alle leptomeningi.
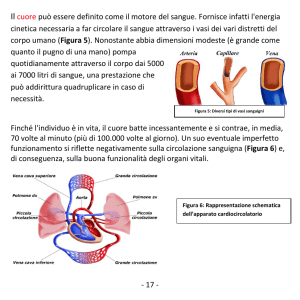
Fig.
1:
Sostanza
bianca
cerebellare centrale. Colorazione
H&E.
a. Basso ingrandimento della
sezione trasversale di numerosi
piccoli vasi circondati da
calcificazioni scure. I puntini
neri indicano le calcificazioni
isolate esterne ai vasi sanguigni.
b. Sezione trasversale di arteriola
con calcificazioni nell’avventizia
e nello spazio perivascolare.
c. Sezione trasversale di arteriola
con tonaca media ispessita e
presenza
massiccia
di
calcificazioni.
d. Sezione trasversale di un vaso
con pareti sottili e masse
calcifiche.
Le molteplici anomalie riscontrate nelle sezioni trasversali dei vasi sono mostrate nella Figura 1, dove sono
visibili le calcificazioni nelle piccole vene e arterie. Gran parte dei profili anomali dei vasi si riscontrano
nelle arteriole. Si osservano masse calcificate nella tonaca media ispessita, nell’avventizia e negli spazi
periavventizi. Non vi è traccia di trombosi conclamata. Tuttavia, in considerazione della forma molto
anomala dei vasi colpiti, è molto probabile che ne risultino pregiudicate le proprietà contrattili e che sia stata
questa patologia a causare i microinfarti cuneiformi che si incontrano in molte aree della corteccia cerebrale
e cerebellare. Si è trovata demielinizzazione sia negli emisferi che nel tronco cerebrale e nel cervelletto
(Figura 2), senza la presenza di macrofagi ad alto contenuto lipidico. È impossibile affermare se la
demielinizzazione fosse connessa soltanto alle anomalie vascolari. La distribuzione irregolare della
demielinizzazione e la variabilità della sua intensità in spazi ravvicinati (Figura 3) suggeriscono
indubbiamente che la compromissione vascolare abbia potuto influire in qualche modo sulla perdita di
mielina.
32
Fig. 2
a. Corteccia cerebrale con area
infartuata cuneiforme (frecce). Si
osserva un altro infarto a sinistra.
Numero
aumentato
di
vasi
leptomeningei (colorazione H&E).
b. Corteccia cerebellare con infarto
cuneiforme
(frecce)
(colorazione
H&E).
Altri studi neuropatologici e sperimentali
Sono decisamente rare le microangiopatie cerebrali nel contesto di una patologia genetica. Due
esempi, altrimenti totalmente diversi dall’AGS, sono la cosiddetta CADASIL 3 e la sindrome cerebro-oculofacciale-scheletrica (COFS) 4. Le altre caratteristiche di entrambe queste affezioni sono molto diverse
dall’AGS. Kumar et al.5 hanno descritto una forma autosomica recessiva con caratteristiche molto simili
all’AGS, compreso un innalzamento dei livelli di interferone alfa in due casi esaminati. In due casi l’autopsia
ha evidenziato un’atrofia cerebrale diffusa e calcificazioni cerebrali estese che si presentano soprattutto come
aree calcificate all’interno della sostanza bianca e dei gangli della base, ma anche occasionalmente intorno e
all’interno delle pareti vascolari. Si è notata inoltre una perdita notevole di sostanza bianca. Nel 1988 fu
descritta l’“encefalite” osservata in bambini appartenenti agli Indiani Cree che vivono nel Quebec
settentrionale 6. Questa ricerca su una malattia che è probabilmente identica alla Sindrome di AicardiGoutières comprende quattro autopsie cerebrali. Le osservazioni venivano così descritte:
“panmeningoencefalite cronica con numerose calcificazioni e profonde modificazioni vascolari, soprattutto a
carico della sostanza bianca”, indicando implicitamente che la perdita di sostanza bianca potrebbe essere
stata di origine vascolare.
33
Fig. 3.
Sezione trasversale del cervello in corrispondenza del
talamo. (Colorazione con Luxol fast blue per la
mielina).
Atrofia macroscopica del giro. Demielinizzazione con
relativo risparmio della sostanza bianca subcorticale.
Piccole aree con cavità (freccia), ad indicare una
demielinizzazione disomogenea.
Un recente aggiornamento sulla Sindrome di Aicardi-Goutières ad opera dei suoi scopritori 7
comprende due brevi referti autoptici. Uno è un riassunto di questa relazione e l’altro descrive un’affezione
simile con focolai di necrosi e calcificazioni vascolari. Pubblicazioni precedenti che riportano casi che oggi
potrebbero essere considerati AGS comprendono un caso descritto da Melchior et al.8 Il caso 4 è
particolarmente bene illustrato da questi autori e rispecchia in gran parte quanto qui descritto; si descrivono
poi due fratelli che presentano una patologia identica che ricorda quella del caso precedente 9.
I livelli elevati di interferone alfa (IFNα) trovati nel liquido cerebrospinale e nel siero, soprattutto nei
bambini più piccoli affetti da AGS, inducono a chiedersi se questa citochina rappresenti un epifenomeno o se
sia un elemento patogeno a sé stante. A tale riguardo, risulta particolarmente interessante la neuropatologia
osservata nei topi transgenici con espressione cerebrale dell’IFNα 10, perché essa evidenzia angiopatia e
formazione di manicotti di cellule mononucleari, oltre alla progressiva calcificazione a carico dei gangli della
base e del cervelletto.
Vasculopatia extracerebrale e Sindrome di Aicardi-Goutières
Vari autori 6,7,11,12 hanno descritto nei pazienti AGS la presenza di “geloni” che si presentavano come
lesioni dolorose e cianotiche alle estremità, talvolta con ulcerazioni, conseguenza di un interessamento
distale dei piccoli vasi. Analogamente, questa importante osservazione indica l’importanza
dell’interessamento vascolare come meccanismo patologico nell’AGS.
Conseguenze per la ricerca futura
Sono necessarie altre descrizioni più dettagliate della neuropatologia dell’AGS per corroborare i dati
attualmente disponibili. Tuttavia, i fatti evidenziati fino ad oggi dimostrano già come questa patologia possa
essere svelata mediante tecniche di RM e di RMS. La possibilità che necrosi, calcificazione e
demielinizzazione siano causate da una vasculopatia connessa alle citochine sollecita a studiare nuovi
approcci terapeutici per questa sindrome devastante.
34
Bibliografia
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
Aicardi J, Goutières F. A progressive familial encephalopathy in infancy with calcifications of the
basal ganglia and chronic cerebrospinal fluid lymphocytosis. Ann Neurol 1984; 15: 49-54.
Barth PG, Walter A, van Gelderen I. Aicardi-Goutières syndrome: a genetic microangiopathy? Acta
Neuropathologica 1999; 98: 212-16.
Hutchinson M, O'Riordan J, Javed M, et al Familial hemiplegic migraine and autosomal dominant
arteriopathy with leukoencephalopathy (CADASIL). Ann Neurol 1995; 38: 817-824
Del Bigio MR,Greenberg CR, Rorke LB, Schnur R, McDonald, McGinn DM, Zackai EH.
Neuropathological findings in eight children with cerebro-oculo-facio-skeletal (COFS) syndrome. J
Neuropathol Exp Neurol 1997; 56: 1147-57.
Kumar D, Rittey C, Cameron AH, Variend S. Recognizable inherited syndrome of progressive central
nervous system degeneration and generalized intracranial calcification with overlapping phenotype of
the syndrome of Aicardi and Goutières. Am J Med Genet 1998; 75: 508-515.
Black DN, Watters GV, Andermann E et al. Encephalitis among Cree children in Northern Quebec.
Ann Neurol 1988; 24: 483-489.
Goutières F, Aicardi J, Barth PG, Lebon P. Aicardi-Goutières syndrome: An update and results of
interferon- studies. Annals of Neurology 1998; 44: 900-7.
Melchior JC, Benda C, Yakovlev PI (1960) Familial idiopathic cerebral calcifications in childhood.
Am J Dis Child 99: 787-803.
Troost D, van Rossum A, Veiga Pires J, Willemse J. Cerebral calcifications and cerebellar hypoplasia
in two children: Clinical, radiologic and neuropathological studies - A separate neurodevelopmental
entity. Neuropediatrics 1984; 15: 102-9.
Campbell IL, Krucker T, Steffensen S et al. Structural and functional neuropathology n transgenic
mice with CNS expression of IFN-alpha. Brain Res 1999; 835: 46-61.
Tolmie JL, Shillito P, Hughes-Benzie R, JBP Stephenson. The Aicardi-Goutieres(familial syndrome,
early onset encephalopathy with calcifications of the basal ganglia and chronic cerebrospinal fluid
lymphocytosis) Journal of Medical Genetics 1995; 32: 881-4.
Stephenson J, Tomie J, Heckmatt J et al. Aicardi-Goutières syndrome: autoimmune clues to diagnosis
and pathogenesis and link to microcephaly intracranial calcification syndrome. Dev Med Child Neurol
1997; 77(Suppl): 15 (Abstract).
35