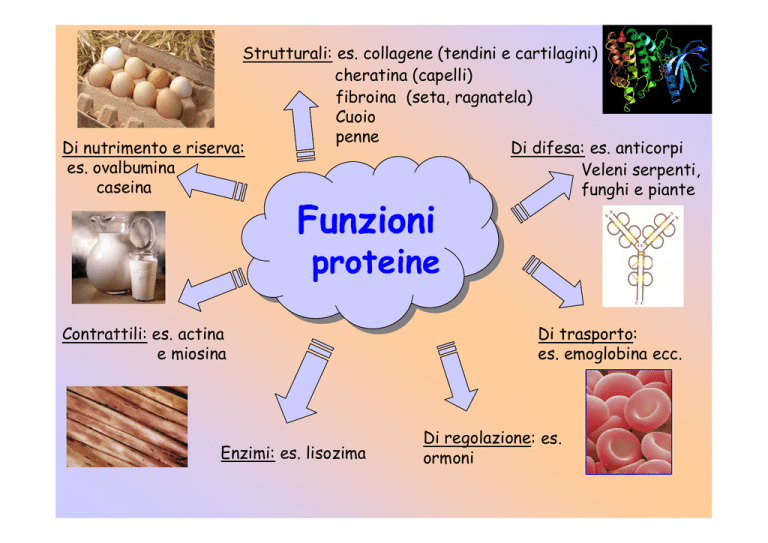
Strutturali: es. collagene (tendini e cartilagini)
cheratina (capelli)
fibroina (seta, ragnatela)
Cuoio
penne
Di nutrimento e riserva:
Di difesa: es. anticorpi
es. ovalbumina
Veleni serpenti,
caseina
funghi e piante
Funzioni
proteine
Contrattili: es. actina
e miosina
Enzimi: es. lisozima
Di trasporto:
es. emoglobina ecc.
Di regolazione: es.
ormoni
Dal greco“Proteios”= di primaria importanza:
CHE COSA SONO?
Molecole organiche complesse con funzioni vitali
nei processi biologici di un organismo.
Sono presenti in tutte le forme di vita
soprattutto negli organismi animali.
Costituiscono il 50% del peso secco di una cellula
proteina
Sono Poliammidi
Sono formate da
molecole di
α-amminoacidi
α- AMMINOACIDI
O
Gruppo amminico
H
O
Gruppo carbossilico
C
H
N
Cα
H
H
R
Catena laterale
variabile
IDENTITA’ e CLASSIFICAZIONE
DEI 20 AMMINOACIDI!
α- amminoacidi:
Glicina
Alanina
GRUPPI R
Valina
Fenilalanina
Triptofano
Leucina
Metionina
Gruppi R
non polari
Isoleucina
Gruppi R
polari
non carichi
α- amminoacidi:
GRUPPI R
Gruppi R
carichi
negativamente
a pH 7
Aspartato
Glutammato
Gruppi R
carichi
positivamente
a pH 7
Istidina
Lisina
Arginina
Amminoacidi essenziali :
devono essere introdotti
nell’organismo umano
con la dieta
Istidina
Isoleucina
Leucina
Lisina
Metionina
Fenilalanina
Treonina
Triptofano
Valina
Amminoacidi non essenziali:
possono essere
sintetizzate dalle
cellule umane
Alanina
Arginina
Asparagina
Aspartato
Cisteina
Glutammato
Glutammina
Glicina
Prolina
Serina
Tirosina
Tutti hanno carbonio asimmetrico (tranne la glicina)
“Composti chirali”
Configurazione
L
Amminoacidi naturali
Configurazione
D
Alcuni prodotti di sintesi
PROPRIETA’:
PUNTI DI FUSIONE
200° C
DISCRETA SOLUBILITA’ IN ACQUA
E ALTRI SOLVENTI POLARI
ELEVATO MOMENTO DIPOLARE
PERCHE’?
COO
COOH
H2N
C
H
R
Forma non dissociata
H3N
C
H
PREVALENTE !
R
Forma dipolare
Zwitterionica a pH 7
Gli amminoacidi sono anfoteri
Comportamento
come acido
COOH
H3N
C
COO
H
+H+
R
H3N
C
H
+OH-
R
COO
H2N
C
H
R
Comportamento
come base
0
14
pH
Forma cationica
(protonata)
PUNTO ISOELETTRICO
pKa amminoacido= pKa del gruppo –NH3+
Forma anionica
(deprotonata)
PUNTI ISOELETTRICI
DEGLI AMMINOACIDI
amminoacido
pH
amminoacido
pH
glicina
6.0
prolina
6.3
alanina
6.0
triptofano
5.9
valina
6.0
tirosina
5.7
leucina
6.0
Istidina
7.5
isoleucina
6.0
Lisina
9.7
fenilalanina
6.0
Arginina
11.2
serina
5.7
asparagina
5.4
treonina
5.6
Acido aspartico
2.8
cisteina
5.1
glutammina
5.7
metionina
5.7
Ac. glutammico
3.2
IN LABORATORIO:
“SEPARAZIONE AMMINOACIDI MEDIANTE
ELETTROFORESI SU CARTA”
Scopo esperienza: Separare e identificare gli
amminoacidi di una soluzione di
una miscela
Materiale: due vaschette,
tampone a un dato pH,
carta da filtro,
un alimentatore elettrico in CC,due elettrodi,
soluzione di una miscela di amminoacidi
Ninidrina
Campione di amminoacidi noti
Contenuti: 1-Prevedere il comportamento degli amminoacidi in campo
elettrico al valore di pH misurato e in base ai valori dei
loro punti isoelettrici.
2-Osservare e giustificare la differente direzione e velocità
di migrazione dei diversi amminoacidi
IL LEGAME PEPTIDICO
H
H2N
C
C
R
O
H
H
O
N
H
C COOH
H
R
H2O
H2N
H
O
C
C
R
H
N
C
H
R
COOH
Legame ammidico
OLIGOPEPTIDI
PEPTIDI
POLIPEPTIDI
PM
10.000
PROTEINE
Anni ’40 e 50’: Linus Pauling e Robert Corey. Struttura del legame peptidico
CARATTERISTICHE
Delocalizzazione degli elettroni
non condivisi dell’azoto
sulla funzione carbonilica
Legame peptidico è rigido
Parziale carattere di doppio legame
carbonio e azoto
Il gruppo ammidico è planare
1.32 A°
1.47 A°
PROTEINE:
4 LIVELLI DI ORGANIZZAZIONE
Struttura primaria
Sequenza amminoacidi dall’informazione genetica
Struttura secondaria
Conformazioni della catena per formazione legami
idrogeno
Struttura terziaria
Struttura tridimensionale per ripiegamenti
Struttura quaternaria
Interazione di due o più catene polipeptidiche
(sub-unità) che formano le proteine “oligomeriche”
STRUTTURA PRIMARIA
polipeptide
Determina l’attività
biologica proteina
Determina le strutture
superiori di organizzazione
Ribosoma
mRNA
Gravi patologie
Es. anemia falciforme
Sostituzione eliminazione
o addizione di un solo
amminoacido
STRUTTURA SECONDARIA
β-sheet
α-elica
3.6 RESIDUI
Es. fibroina della seta
Es: α-cheratine
STRUTTURA TERZIARIA
Ogni proteina ne possiede una sola e precisa
Il ripiegamento corretto è guidato
da proteine specifiche (folding).
Importante per lo svolgimento delle funzioni
biologiche
STRUTTURA TERZIARIA
serina
glutammina
valina fenilalanina
LEGAMI
IDROGENO
INTERAZIONI IDROFOBICHE
Approfondimento:
Come si fa
l’ondulazione “permanente”
dei capelli
Ac. glutammico
lisina
LEGAMI IONICI
PONTI DISOLFURO
STRUTTURA TERZIARIA
LA DENATURAZIONE
PERDITA DELLA STRUTTURA TERZIARIA PER:
Aumento della temperatura
Trattamento con acidi o con basi
Trattamento con detergenti
proteina
Proteina denaturata
Trattamento con urea
Processo irreversibile per la maggior parte delle proteine
Esempio:
Riscaldamento dell’albume dell’uovo
(albumina)
STRUTTURA QUATERNARIA
PROTEINE OLIGOMERICHE
Interazioni tra 2 o più subunità fino a 180!
Le subunità si uniscono mediante:
Legami ionici
Interazioni idrofobiche
Legami H
Ponti disolfuro
Immunoglobuline
Emoglobina
Prima proteina oligomerica sottoposta
a raggi X da Max Perutz,
intorno agli anni ’50-’60
CLASSIFICAZIONE PROTEINE
Fibrose
Forma allungata
Insolubili in acqua
globulari
Catena/catene polipeptidiche
ripiegate
Solubili in acqua
coniugate
Es: a-cheratine dei capelli
e della lana
Fibroina della seta
Collagene ed elastina
Es: enzimi (lisozima, citocromo c)
proteine di trasporto
del sangue (mioglobina)
Anticorpi
proteine di riserva (albumina)
Proteine con parte non amminica
detta “gruppo prostetico” che consente di classificarle in:
Lipoproteine (es. quelle sanguigne)
Glicoproteine (es. globuline sangue)
Metalloproteine (ferritina)
ENZIMI
Proteine globulari che catalizzano reazioni chimiche specifiche
nei sistemi biologici, aumentando la loro velocità.
La reazione avviene nel sito attivo
Elevata specificità per il substrato
Emil Fischer (1894)
Daniel Koshland (1958)
Un migliaio in ogni cellula
Il nome viene affidato in base alla reazione catalizzata
aggiungendo suffisso –ASI.
Es: polimerasi












