Capitolo 11
Risposte a Domande ed Esercizi
11.1
2-metil-1-propanolo
a.
b.
2-clorociclopentanolo
c.
2,4-dimetilcicloesanoo
d.
2.3-dicloro-3-esanolo
11.2
a<d<c<b
11.3
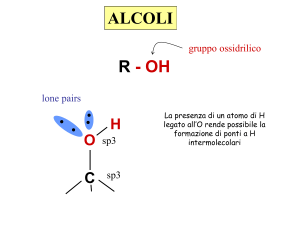
Gli alcoli hanno temperature di ebollizione maggiori di quelle degli alcani
poiché hanno il gruppo ossidrilico fortemente polare che permette la
formazione di legami a idrogeno.
11.4
a.
CH3CH2OH
b.
CH3CH2CH2CH2OH
c.
11.5
a.
CH3 CH2CH2CH2CH2 CH3 < CH3 CHCH2 CHCH2CH3 < CH3 CHCH2 CHCH2CH2 OH
OH
11.6
OH
b.
1-esanolo < alcol pentilico < glicole etilenico
a.
nome IUPAC: 1-eptanolo
nome comune: alcol eptilico
nome IUPAC: 2-propanolo
b.
OH
OH
c.
d.
11.7
11.8
11.9
nome comune: alcol isopropilico
nome IUPAC: 2,4-dibromo-3-clorocicloesanolo
nome comune : alcol 2,4-dibromo-3-clorociclopentilico
nome IUPAC: 2,5-dimetilciclopentanolo
nome comune: alcol 2,5-dimetilciclopentilico
a.
1,4-esandiolo
b.
2,3-pentadiolo
c.
2-metil-3-pentanolo
a.
5-etil-4,6-dimetil-1-eptanolo
b.
3-esanolo
c.
3-bromo-4-cloro-1-esanolo
a.
b.
c.
11.10
a.
alcol metilico
b.
alcol etilico
11.11
c.
glicole etilenico
d.
alcol propilico
a.
b.
c.
d.
e.
11.12
11.13
a.
2-metilcicloesanolo
b.
3-bromociclobutanolo
c.
2,4,6-eptantriolo
d.
2,3,4-esantriolo
L’alcol denaturato è etanolo al 100% a cui è stato aggiunto metanolo o
benzene. Gli additivi non lo rendono idoneo all’uso alimentare e impediscono
un uso illegale dell’etanolo puro.
11.14
I vini hanno un contenuto alcolico non superiore al 13-14%, poiché
concentrazioni alcoliche maggiori uccidono il lievito, responsabile della
fermentazione alcolica. Pertanto quando si raggiunge la concentrazione
alcolica massima, la fermentazione cessa e il contenuto alcolico non aumenta
più.
11.15
11.16
11.17
a.
Primario
b.
Secondario
c.
Terziario
d.
Terziario
e.
Terziario
a.
Alcol primario
b.
Alcol secondario
c.
Alcol primario
d.
Alcol primario
e.
Alcol secondario
a
1-ottanolo
HO—CH2CH2CH2CH2CH2CH2CH2CH3
Alcol primario - alcol ottilico
b
3-ottanolo
CH3CH2CH(OH)CH2CH2CH2CH2CH3
Alcol secondario - alcol 3-ottilico
11.18
11.19
11.20
11.21
Un alcol terziario non può subire ossidazione poiché l’atomo di carbonio su
cui insiste il gruppo ossidrilico, per essere ossidato, deve essere legato ad
almeno un atomo di idrogeno. Gli alcoli terziari hanno tre legami C-C e
quindi non possono dare ossidazione.
11.22
a.
I prodotti previsti sono: 1-esanolo (secondario) e 2-esanolo
(maggioritario).
b.
I prodotti previsti sono: 2-esanolo e 3-esanolo. Questi prodotti si
formeranno in quantità approssimativamente uguali.
c.
I prodotti previsti sono: 5-metil-3-esanolo e 2-metil-3-esanolo. Questi
prodotti si formeranno in quantità approssimativamente uguali.
d.
I prodotti previsti sono: 2,2-dimetil-4-eptanolo e 2,2-dimetil-3-
eptanolo. Questi prodotti si formeranno in quantità approssimativamente
uguali.
11.23
OH
H+
+
heat
calore
a.
H+
heat
b.
+ H2O
calore
OH
OH
H+
c.
heat
calore
+ H2O
+ H2O
OH
Br
Br
Br
H+
d.
heat
calore
+
+ H2O
2-esene
11.24
a.
2-esanolo
3-esanolo
Questi prodotti si formano in quantità approssimativamente eguali.
;
b.
ciclopentene
ciclopentanolo
1-ottene
c.
2-ottanolo
(prodotto principale)
or
1-ottanolo
(prodotto secondario)
d.
1-metilcicloesene; 1-metilcicloesanolo (prodotto principale);
2-metilciloesanolo (prodotto secondario)
11.25
a.
Le seguenti razioni richiedono tracce di acidi e calore:
CH3CHCH2CH3 → CH3CH==CHCH3 + CH2==CHCH2CH3
│
2-butene
1-butene
OH
(prodotto principale)
(prodotto secondario)
2-butanolo
b.
OH
calore
H+, heat
+
.
CH3
2-metilciclopentanolo
11.26
CH3
CH3
1-metilciclopentene
3-metilciclopentene
(prodotto principale) (prodotto secondario)
a.
butanone
b.
N.R.
c.
cicloesanone
d.
N.R.
11.27
a.
liver
Enzimi
enzymes
epatici
O
CH3OH
H C H
Methanol
metanolo
Metanale
Methanal
(formaldeide)
(formaldehyde)
b.
Enzimi
liver
epatici
enzymes
O
CH3CH2CH2OH
CH3CH2
1- Propanolo
C H
Propanale
Propanal
1-Propanol
c.
Enzimi
liver
epatici
enzymes
CH3CH2CH2CH2OH
O
CH3CH2CH2
1-Butanol
1-Butanolo
11.28
Butanale
Butanal
a.
3-pentanone
b.
propanale (a seguito di ulteriore ossidazione si forma l’acido propanoico).
c.
4-metil-2-pentanone
d.
N.R.
e.
3-fenilpropanale (a seguito di ulteriore ossidazione si forma l’acido 3-
fenilpropanoico).
11.29
C H
a.
H H
H C
C
H O
[O]
OH
H
C C
H H
H
Etanolo
Ethanol
Etanale
Ethanal
H
b.
H H
H C
C
H
[O]
C
H
H O
H C
C
H
C
H OH H
H
2-Propanolo
2-Propanol
Propanone
H
H
c.
OH
H+ , heat
Cyclopentanol
Ciclopantanolo
11.30
Cyclopentene
Ciclopentene
La reazione in cui una molecola di acqua si addiziona all’1-butene è una reazione di
idratazione.
1-butene
2-butanolo
11.31
Propene
(propilene)
11.32
a.
b.
2-propanolo
(ispopropanolo)
c.
d.
11.33
L’ossidazione è una perdita di elettroni mentre la riduzione implica un
guadagno di elettroni.
11.34
11.35
O
O
||
||
CH 3 CH 2 CH 3 < CH 3 CH 2 CH 2 OH < CH 3 CH 2 C — H < CH 3 CH 2 C — OH
Il coenzima nicotinamide-adenin-dinucleotide (NAD+) prenda parte a una
reazione di ossido-riduzione catalizzata dall’enzima e che consiste
nell’accettazione di uno ione idruro (un atomo di idrogeno con due elettroni)
da uno dei reagenti. La forma ridotta del coenzima potrà poi donare lo ione
idruro ad altre molecole.
11.36
Come gli alcoli, anche i fenoli sono composti polari in grado di formare
legami a idrogeno, avendo il gruppo ossidrilico, fortemente polare. Per questo
motivo i fenoli più piccoli sono alquanto solubili in acqua.
11.37
acido picrico
2,4,6-trinitrotoluene
L’acido picrico è solubile in acqua poiché il gruppo ossidrilico, fortemente
polare, può formare legami a idrogeno con l’acqua.
11.38
a.
2-nitrofenolo
11.39
b.
4-isopropilfenolo
c.
3-bromo-5-clorofenolo
d.
4-bromo-2-metilfenolo
Gli eteri hanno temperature di ebollizione molto più basse degli alcoli di
comparabile massa molare poiché le molecole degli eteri non possono legarsi
fra loro mediante legami a idrogeno.
11.40
Gli eteri hanno temperature di ebollizione molto più basse degli alcoli di
comparabile massa molare, ma più alte degli alcani di comparabile massa
molare. La loro temperatura di ebollizione è maggiore di quella degli alcani
poiché il raggruppamento R—O—R è polare. D’altra parte in essi non ci sono
gruppi —OH e quindi gli eteri non possono legarsi l’uno all’altro tramite la
formazione di legami a idrogeno. Questo è il motivo per cui le loro
temperature di ebollizione sono inferiori a quelle di alcoli di comparabile
massa molare.
11.41
Alcoli ed eteri di formula molecolare C4H10O
11.42
a.
2,2-dicloro-1,1-difluoro-1-metossietano
b.
2-cloro-2-fluoro-1,1-difluoro-1-difluorometossietano
11.43
a.
b.
c.
d.
11.44
a.
H+
2
OH
c.
H+
HO
OH
b.
+ H2O
O
+
+ H2O
O
H+
2
OH
+ H2 O
O
H+
d.
OH
+
HO
O
11.45
11.46
a.
2-etossipentano
b.
2-metossibutano
c.
1-etossibutano
d.
metossiciclopentano
a.
etil propil etere
b.
metil eptil etere
c
dibutil etere
d.
etil esil etere
+ H2O
11.47
a.
b.
c.
d.
11.48
11.40
11.50
a.
1-propantiolo
b.
2-butantiolo
c.
2-metil-2-butantiolo
d.
1,4-cicloesanditiolo
a.
1,2-propanditiolo
b.
benzentiolo
c.
2-pentantiolo
d.
1-eptantiolo