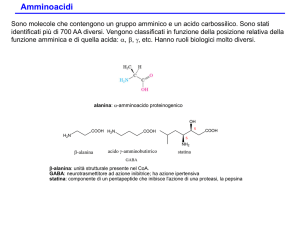
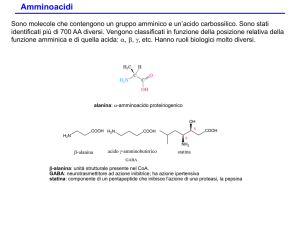
PEPTIDI (PROTEINE)
Polimeri costituiti da monomeri relativamente semplici: gli amminoacidi.
Hanno proprietà biologiche molto varie (ad es., antibiotici, ormoni, additivi
alimentari, antidolorifici, ecc.)
DEFINIZIONI
Õ Gli amminoacidi sono tenuti insieme con legami ammidici; il legame ammidico viene chiamato
anche legame peptidico
Õ Gli amminoacidi che fanno parte di un peptide o di una proteina si dicono residui
La distinzione tra proteine e peptidi è formale e di riferisce alle dimensioni:
PEPTIDI
polimeri costituiti da meno di 50 residui di amminoacidi;
di solito non hanno una struttura tridimensionale ben definita.
PROTEINE
polimeri costituiti da almeno 50 residui (fino a oltre 1000);
hanno strutture tridimensionali ben definite, da cui dipendono
le proprietà biologiche.
Per peptidi e proteine si definiscono:
Struttura primaria
è la sequenza dei residui
Struttura secondaria
si riferisce ad aspetti strutturali specifici all'interno di una molecola
Struttura terziaria
è la forma tridimensionale complessiva della molecola
Struttura quaternaria
quando unità separate di proteine sono bloccate insieme(per esempio,
emoglobina, tropocollagene)
PROPRIETA' CHIMICHE DEL LEGAME PEPTIDICO
R
H
N
..
C
R'
O
R
1
H
+
N
C
R'
-O
1.
Il legame peptidico è piuttosto inerte. N non è né nucleofilo né basico. Perché gli elettrofili
reagiscano con C=O servono condizioni drastiche
2.
Il gruppo ammidico può talvolta funzionare da nucleofilo (in tal caso il centro nucleofilo è l'O).
3.
Il gruppo ammidico è planare (importante per la forma tridimensionale).
PROPRIETA' BIOLOGICHE DI PEPTIDI E DI AMMINOACIDI
Non è necessario avere lunghe catene polimeriche per avere attività biologica
Nome
n. di
residui
GABA
Glutammato monosodico
Aspartame
Penicillina
TRH
1
1
2
3
3
Encefaline
Falloina
Angiotensina II
Ossitocina
5
7
8
9
Gramicidina S
10
Proprietà biologiche
neurotrasmettitore, implicato nel controllo degli impulsi nervosi
additivo alimentare
dolcificante artificiale (circa 100 volte più dolce del saccarosio)
potente antibiotico (prodotto da alcune muffe)
ormone che controlla il rilascio di un altro ormone (tirotrofina)
ed influenza il sistema nervoso centrale.
trovate nel cervello; sono peptidi coinvolti nella sensazione del dolore
peptide biciclico, estremamente velenoso, in funghi non commestibili
usato dal corpo per aumentare la pressione del sangue
nonapeptide ormonale ciclico, che può essere usato per provocaare il
travaglio
decapeptide ciclico, potente antibiotico
2
1
La sequenza degli amminoacidi in molti peptidi è controllata dal codice genetico
solo 20 α-amminoacidi sono codificati dal DNA
anche così le combinazioni sono molte:
pentapeptide
205 combinazioni
3 200 000 possibili peptidi
Gli α-amminoacidi naturali (tranne la glicina) sono di serie L e di configurazione S
CO2H
H
R
H2N
L
Nome
CO2H
R
NH2
(S)
H
struttura
abbreviazioni
punto
catena laterale
isoelettrico pKa tipo
O
H3C
Alanina
OH
Ala, A
6.00
-
L
Arg, R
10.76
12.5
H+
Asn, N
5.41
NH2
NH
Arginina
H2N
O
N
H
OH
NH2
O
Asparagina
O
OH
H2N
Nome
H
3
struttura
abbreviazioni
O
Acido aspartico
-
NH2
OH
punto
catena laterale
isoelettrico pKa tipo
Asp, D
2.77
3.9
H-
Cys, C
5.07
9.3
H-
Glu, E
3.22
4.3
H-
H
OH NH2
O
Cisteina
HS
OH
NH2
O
Acido glutammico
O
HO
NH2
O
Glutammina
OH
O
H2N
Gln, Q
5.65
-
Gly, G
5.97
-
OH
NH2
O
Glicina
OH
NH2
O
Istidina
(Histidine)
N
N
OH
NH2
His, H
7.59
6.1
H
4
2
Nome
struttura
abbreviazioni
punto
catena laterale
isoelettrico pKa tipo
O
Isoleucina
Ile, I
6.02
-
L
Leu, L
5.98
-
L
Lys, K
9.74
10.5
H+
Met, M
5.74
-
L
OH Phe, F
5.48
-
L
Pro, P
6.30
-
L
OH
NH2
O
Leucina
OH
NH2
Lisina
H2N
O
OH
NH2
O
S
Metionina
NH2
OH
O
Fenilalanina
(Phenylalanine)
NH2
O
Prolina
OH
N
Nome
5
H
struttura
abbreviazioni
punto
catena laterale
isoelettrico pKa tipo
O
Serina
HO
OH
Ser, S
5.68
-
-
Thr, T
5.60
-
-
Trp, W
5.89
-
L
NH2
OH O
Treonina
OH
NH2
O
Triptofano
OH
NH2
N
H
O
Tirosina
OH Tyr, Y
5.66
9.1
L
Val, V
5.96
-
L
NH2
HO
O
Valina
OH
NH2
H = idrofilo; L = lipofilo (idrofobo)
6
3
Amminoacidi "non usuali"
Moltissimi amminoacidi presenti in natura non sono codificati dal DNA. Sono meno abbondanti di quelli codificati
Catene laterali insolite
esempi:
Cl
S
H
H
N
H
N
CO2H
O
CO2H
H2N CH2CH2 CH2 C
CO2H
H
CO2H
H
HO2C
H
N
H
NH2
CO2H
CH2 C CH CH2 C
CO2H
H2N CH2CH2CH2 CH2 C
H
NH2
H
NH2
Ornitina
H
NH2
Lisina
presente in molti peptidi naturali
(antibiotico)
HO
H
N
CO2H
H
Prolina
H
N
H
CO2H
Idrossiprolina
costituente principale del collagene
β-amminoacidi
esempi:
CO2H
H 2N
H 2N
CO2H
7
γ-amminoacidi
OH
H2N
esempi:
GABA
CO2H
CO2H
acido 4-amminobutanoico
entra nella trasmissione
degli impulsi nervosi
NH2
D-amminoacidi
NH2
esempi:
CH2 C
H
CO2H
D-Phe
H3C
CH C
H3C
NH2
H
CO2H
CO2H
N
H
H
D-Pro
D-Val
sono sintetizzati da diversi organismi e sono importanti costituenti di antibiotici
altri
esempi:
H3C +
H3C N CH2 CO2
H3C
Betaina
agente metilante, entra nella
biosintesi della metionina
H2N CH2 CO2H
Glicina
8
4
CLASSIFICAZIONE E PROPRIETA' FISICHE DEGLI α-AMMINOACIDI
Gli amminoacidi vengono classificati, a seconda della natura della catena laterale, in:
Amminoacidi "acidi“
contengono nella catena laterale un altro gruppo -CO2H
contengono nella catena laterale un altro gruppo -NH2
Amminoacidi "basici“
polari
contengono nella catena laterale un eteroatomo
non polari
la catena laterale è idrocarburica
Amminoacidi "neutri"
Gli α-aminoacidi naturali sono composti solidi cristallini, alto-fondenti, solubili in acqua
Le proprietà fisiche sono diverse da quelle di acidi o ammine con lo stesso numero di atomi di C
RCO2H
pKa ~ 5
RNH2
pKb ~ 4
pKa ~ 10
pKb ~ 12
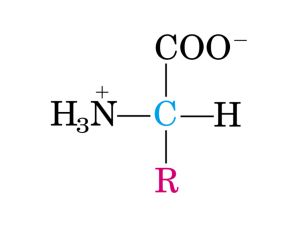
H2N CH CO2H
R
?
Allo stato solido gli α-amminoacidi sono "ioni dipolari" (zwitterioni)
+
H3N
CO2C
Il centro acido è -NH3+, il centro basico è -CO2-
H
R
9
IN SOLUZIONE ACQUOSA LA STRUTTURA PREVALENTE DIPENDE DAL pH
In soluzione acquosa -NH3+ è più forte come acido di quanto -CO2- sia forte come base
Come risultato della differenza di forza tra il centro acido ed il centro
basico, UNA SOLUZIONE ACQUOSA DI ALANINA (amminoacido neutro
non polare) CONTIENE PIU' ANIONI CHE CATIONI
A pH 7 l'alanina ha una carica globale negativa.
CO 2
+
H3N
H
C
base
(più debole)
+ H2 O
H2N
C
H
+
H3 O +
R
R
acido
(più forte)
CO2-
si comporta
da base
carica globale negativa
Per tornare allo ione dipolare bisogna aggiungere H3O+
A pH 6 l'alanina ha una carica globale nulla.
CO 2
H2N
C
R
H
+
H3O +
+
H3 N
CO2C
H
+ H2O
R
10
carica globale nulla
5
CO2H
H2 N
+
H3 N
H
C
CH3
CO2H
C
R
L’alanina NON E’ MAI così
L’alanina è così allo stato solido
e al punto isoelettrico
Si definisce PUNTO ISOELETTRICO quel valore di pH al quale l'amminoacido esiste in
prevalenza come ione dipolare (complessivamente neutro). Al punto isoelettrico la
concentrazione della forma cationica e di quella anionica sono uguali (e molto basse).
Per un amminoacido "neutro" il punto isoelettrico (che dipende soprattutti dai valori
del pKa di NH3+ e del pKb di -CO2-) è attorno a 5.5-6.0.
CO2H2N
C
H+
+
H3N
H
OH-
R
CO2C
H+
H
OH-
R
prevalente a
prevalente a
R
prevalente a
pH = pI
pH > pI
CO2H
+
H3N C H
pH < pI
11
Ogni amminoacido ha un punto isoelettrico diverso
In un amminoacido "acido" c'è un altro gruppo (il secondo carbossile) che reagisce
con l'acqua (è il centro acido più forte)
Una soluzione acquosa di un amminoacido "acido" è decisamente acida:
+
H3N
acido
(più debole)
CO -
base
(più debole)
2
C
+ H 2O
H
CH2 CH2 CO2H
acido
(più forte)
CO2+
H3N C H
+ H3O+
CH2 CH2 CO2si comporta
da base
carica globale negativa
Per portare un amminoacido "acido" al punto isoelettrico E' NECESSARIA UNA
CONCENTRAZIONE DI H3O+ MAGGIORE che per un amminoacido "neutro".
Il punto isoelettrico di amminoacidi "acidi" è ~ pH 3.
12
6
In un amminoacido "basico" c'è un altro gruppo (il secondo gruppo amminico) che
reagisce con l'acqua (è il centro basico più forte)
Una soluzione acquosa di un amminoacido “basico" è decisamente basica
+
H 3N
acido
(più debole)
base
(più debole)
CO 2
C
+ H2O
H
CH2 CH2 CH2 CH2 NH2
si comporta
da acido
base
(più forte)
CO2+
H 3N C H
+ OH+
CH2 CH2 CH2 CH2 NH3
carica globale positiva
Per neutralizzare un amminoacido "basico" e portarlo al punto isoelettrico BISOGNA
AGGIUNGERE IONI OH-.
Il punto isoelettrico di amminoacidi "basici" è nell'intervallo 9-10 di pH.
13
TITOLAZIONE DELLA GLICINA
+
H3N CH2 CO2H + H2O
K1
+
+
H3N CH2 CO2 + H3O
Quando sono stati aggiunti 0.5 equivalenti di OHK1 = [H3O+]
K1 =
+
[H3O+] [ H N CH CO ]
2
2
3
+
[ H3N CH2 CO2H ]
= 10-2.4
pKa1 = 2.35
Aggiungendo altro OH-:
+
H3N CH2 CO2 + H2O
K2
H2N CH2 CO2 + H3O+
Quando sono stati aggiunti 1.5 equivalenti di OH-
K1 =
[H3O+] [ H2N CH2 CO2- ]
+
[ H N CH2 CO2 ]
3
al punto isoelettrico
specie prevalente
= 10-9.78
K2 = [H3O+]
pKa2 = 9.78
+
[ H2N CH2 CO2- ] = [ H3N CH2 CO2H ]
+
H3N CH2 CO2
14
7
+
[ H3N CH2 CO2H ] x 10-2.4
[ H3N CH2 CO2 ] =
[H3O+]
[H3O+] [ H N CH CO - ]
+
2
2
2
[ H N CH2 CO2 ] =
3
-9.78
10
Dal primo equilibrio
Dal secondo equilibrio
[ H3N CH2 CO2H ] x 10-2.4
[H3O+]
=
[H3O+] [ H N CH CO - ]
2
2
2
10-9.78
+
10-12.2 [ H3N CH2 CO2H ]
2
[H3O+] =
[ H2N CH2 CO2 ]
[H3O+] =
al punto isoelettrico
10-12.2
Per gli amminoacidi "neutri" il valore del punto isoelettrico è determinato dall'effetto
induttivo del gruppo R
aumenta l'acidità, diminuisce la basicità
il fenile ha effetto -I
15
Confronto fra le curve di titolazione di
glicina e fenilalanina
Curva di titolazione dell’acido
glutammico (amminoacido “acido”)
pKa=2.19
+
H3N
pKa=9.67
CO2H
C
pI =
H
pKa1 + pKa2
2
=
2.19 + 4.25
2
=
6.44
2
= 3.22
CH2 CH2 CO2H
acido glutammico
pKa=4.25
16
8
Curva di titolazione della lisina
(amminoacido “basico”)
+
H3N
pKa=8.95
pKa=2.18
CO2H
C
H
+
CH2 CH2 CH2 CH2 NH3
lisina
pI =
pKa2 + pKa3
2
=
19.74
2
=
pKa=10.79
8.95 + 10.79
2
= 9.87
E’ significativo confrontare la carica complessiva dei quattro amminoacidi a pH diversi
17
IDROFILICITA'/LIPOFILICITA'
La catena laterale degli amminoacidi ne influenza la solubilità
Il fatto che tutti gli amminoacidi allo stato solido esistano come ioni dipolari li rende più solubili
nei solventi polari che in quelli non polari.
Amminoacidi (e peptidi) di solito sono solubili in acqua, ma spesso si sciolgono con difficoltà
nei solventi organici
le solubilità relative nei diversi solventi dipendono dalla natura della catena laterale
in H2O (polare protico)
Ser > Gly > Phe
in CHCl3 (poco polare)
Gly ~ Ser ~ Phe
in benzene (non polare)
Phe > Gly > Ser
Gli amminoacidi "acidi", "basici" o "neutri polari" in grado di formare legami idrogeno
si dicono IDROFILI ed hanno elevata solubilità in acqua. Gli amminoacidi "neutri" si
dicono LIPOFILI (o IDROFOBI) e preferiscono mezzi non polari.
Le proprietà fisiche degli amminoacidi sono determinate da tre fattori
principali:
- la carica complessiva ad un dato pH
- il pH al quale c'è carica complessiva zero (pI)
- l'idrofilicità o la lipofilicità delle catene laterali.
18
9
SINTESI DI α-AMMINOACIDI
Amminazione di α-alogenoacidi
1.
CH3CH2 CO2H
P/Br2
NH3
CH3CH CO2H
in eccesso
Br
CH3CH CO2- NH4+
NH2
E’ il metodo più semplice, ma il MENO UTILE in pratica, perché l’amminoacido prodotto è ancora
nucleofilo e può reagire con il bromoacido.
CH3CH CO2- NH4+
CH3CH CO2- NH +
4
NH
CH3CH CO2 NH4+
NH2 +
Br-
CH3CH CO2H
Prodotto indesiderato.
Si abbassano le rese e si deve
separare
Br
utile solo per preparare industrialmente la glicina
2.
Sintesi di Gabriel
O
O
N - K+ + R
O
H2O, H+
N CH
CO2CH3
O
CH CO2CH3
KBr
Br
O
R
R
+
OH
H3N CH CO2H
+
OH
O
19
3.
Alchilazione di derivati dell'estere malonico
CO2CH3
CH2
CO2CH3
1) CH3ONa
CO2CH3
CH Br
2) Br2
CO2CH3
NH3
in eccesso
CO2CH3
NH4Br
CO2CH3
CO2CH3
1) CH3ONa
CH2 C NH C R
O
2) RX
CO2CH3
CH NH2
H+
OH
CH2 C
O
CO2CH3
PhCH2OCOCl
CH2 C NH CH
O
CO2H
+
H3N C R
CO2H
Δ
+ NH
CO2CH3
3
R CH CO2H
CO2
in alternativa:
O
CO2CH3
N- K+
CH Br +
CO2CH3
H+
H2O
+ NH
O
CO2CH3
O
1) CH3ONa
CH
N
CO2CH3
O
3
R CH CO2H + CH3OH +
2) RX
CO2CH3
O
R C
N
CO2CH3
O
CO2H
CO2H
20
10
4.
O
R
Sintesi di Strecker
NH
OH
R CH NH2
..
+ NH3
H
H2O
R
H
:CN
2) H+
NH2
+
NH3
R CH CO2H
H2O
R CH C N
H+
Tutti i metodi precedenti portano a miscele racemiche
RISOLUZIONE DI MISCELE RACEMICHE DEGLI α-AMMINOACIDI
1) Metodi chimici
Qualche volta è possibile la formazione di sali con un controione chirale, che può precipitare
preferenzialmente con l'amminoacido D o con quello L.
N-acetil-(±)-amminoacido
+ base otticamente attiva
si separano e si
aggiunge acido
sali diastereomeri
H3C
li amminoacidi basici possono essere risolti direttamente, usando l'acido
(1S)-10-canforsolfonico
CH3
H
CH2 O
SO3H
Non ci sono regole per poter prevedere quale
enantiomero dia il sale che precipita, né le
condizioni necessarie perché la cristallizzazione
avvenga. bisogna operare per tentativi.
21
2) Metodi enzimatici
N-acetil-(±)-amminoacido + acilasi
L-amminoacido
+
N-acetil-D-amminoacido
solubile in acqua
insolubile in acqua
da rene di maiale
Se occorre anche l'amminoacido D, si recupera per idrolisi
3) HPLC chirale (metodo analitico)
Con un gruppo chirale legato alla fase
stazionaria diventa possibile separare
glienantiomeri. Sono disponibili colonne
HPLC chirali che usano come componenti
chirali della fase stazionaria carboidrati o
proteine.Le fasi stazionarie chirali più
usate sono quelle con derivati di
amminoacidi legatiad un supporto di
silice.
OEt
O
H
O
Si
O
N
H
NO2
O
NO2
fase stazionaria chiraledi Pirkle
22
11
SINTESI ASIMMETRICA
1) Uso di reagenti chirali
Sono disponibili reagenti ossidanti chirali, reagenti riducenti chirali e catalizzatori
chirali
Esempio:
..
1) [Rh(COD)Cl]2/NaBF4
..
O
P
RhH(R,R-Dipamp)
2) H2
P
O
COD =
(R,R)-Dipamp
H2
O
N
H
CO2H
O H
[RhH(R,R)Dipamp]
CO2H
N
H
resa 100%
e.e. 96%
(1972)
23
2. Uso di ausiliari chirali
Nel composto di partenza c'è un gruppo chirale rimovibile, che indirizza l'andamento
stereochimico nella formazione del nuovo centro chirale; alla fine del processo (e dopo
la purificazione) il gruppo chirale si rimuove
Esempio:
O
H H CH
3
N
OH
NH2
OR'
R
O
1) HNO2
H H CH
3
Al/Hg
O
N
N
CH3OCH2CH2OCH3
O
R
riduzione stereospecifica
sulla faccia inferiore
2) LiAlH4
OH H CH
3 H2 N
1) H2/Pd
C
+
O
N
OH
2) OHH R
H
H H CH
3
H
N
N
O
O
H R
24
12
3. Sintesi chirale
Si parte da materiale otticamente attivo, il cui centro chirale viene poi incorporato nel
prodotto.
Esempio:
O
HO
H2N
OH
2) 2 PrLi
H
L-Ser
SH
1) HS
BF3.Et2O
O
1) TsCl
HO
HN H
Ts
O
O
HBr
[O]
HO
HN H
Ts
HO
HN H
Ts
2) Ni Raney
HO
H2N
H
Acido D-2-amminoesanoico
Resa complessiva: 24%; >99% e.e.
(1984)
Ci sono molti modi per preparare un dato amminoacido: quale via scegliere
in un caso specifico dipende da un'accurata considerazione della struttura da
preparare e dall'esame di sintesi riportate in letteratura per composti simili.
25
Esempio
L'acido γ-amminobutanoico (GABA) è un neurotrasmettitore e molti suoi derivati sono stati
studiati per le loro potenzialità come farmaci. Un importante derivato, il 3-idrossi (GABOB), è
anch'esso un neurotrasmettitore; l'enantiomero R ha attività biologica molto maggiore dell'S.
OH
H2N
CO2H
(R)-GABOB
CO2H
H2N
GABA
acido 4-ammino-3-idrossibutanoico
All'inizio è il GABOB è stato preparato come miscela racemica con metodi tradizionali. La
risoluzione della miscela racemica è stata ottenuta per cristallizzazione del sale canforsolfonico
dell'ammide.
H3C
OH
H2N
CH3
H
H3C
CH3
H
+
H3 N
CONH2 +
(R,S)
CH2 O
SO3H
CH2 O
SO3-
OH
OH
CONH2 + H2N
(R)
(in soluzione)
H2O, OH-
precipitato cristallino
CONH2
(S)
OH
CO2H
H2N
(R)
(1977)
questo metodo ha permesso di ottenere (R)-GABOB, ma è lungo e con sprechi
26
13
Nel 1980 è stata pubblicata una sintesi chirale a partire dall'acido ascorbico (Vitamina C)
H
CH2OH
OH
O
HOH
acido L-ascorbico
(Vitamina C)
O
Metodo 3: sintesi chirale
OH
Sintesi lunga (nove passaggi) e resa bassa (~ 10%).
Metodo 1: reagente chirale
Nel 1983 è stata pubblicata una sintesi asimmetrica
OH
OH O
1) RuO4
O
t-BuOOH/Ti(O-iPr)4
OH
L-(+)Tartrato dietilico
H2N
2) NH3
OH
Resa globale 17%; 55% e.e.
Sintesi breve (tre passaggi), ma resa scarsa ed e.e. modesto
Un miglioramento si è avuto con la pubblicazione nel 1985 di una
sequenza in tre passaggi che comprendono una riduzione enzimatica
O
lievito di
birra
Cl
O
Cl
OH O
1) NMe3
OC8H17
OC8H17
2) H2O/HCl
Metodo 1:
reagente chirale
OH O
+
Me3N
Cl
OH
Resa globale 45%; >95% e.e.
La difficoltà maggiore è stata la ricerca del β-chetoestere migliore
27
A tutt'oggi il metodo migliore comporta una sintesi chirale a partire dall'acido malico (acido
2-idrossibutandioico), disponibile sia come isomero R che S, anche se la sintesi è stata
fatta con l'acido S-malico, meno costoso.
Metodo 3: sintesi chirale
O
OCOCF3
OH
OH
HO
O
O
acido (S)-malico
NH2
O
O
1) Zn(MnO4)2
2) HCl
O
O
H+
HO
O
O
2) MeOH/HCl
OH
NH2
O
O
C(CH3)3
C(CH3)3
O
O
1) NH3
(CF3CO)2O
O
1) LiAlH4
2) (t-BuOCO)2O
HO
NH Boc
OH
NH2
Resa complessiva 25%; ~ 100 % e.e.
(1987)
Fra i molti metodi a disposizione la scelta può dipendere dall'importanza
della purezza ottica (se per esempio l'enantiomero "sbagliato" è tossico)
o dalla resa o dalla versatilità del metodo.
28
14
POLIPEPTIDI
I peptidi conservano molte delle proprietà degli amminoacidi, avendo alle due estremità
un gruppo acido ed un gruppo amminico.
Le proprietà fisiche dei peptidi possono grosso modo essere determinate considerando
insieme gli effetti di tutte le catene laterali, più quelli dei gruppi amminico e carbossilico
alle estremità
- cariche globali tipiche a diversi pH
- punti isoelettrici caratteristici
- affinità specifiche per la fase acquosa e quella non acquosa
R
C
O
H
N
..
R'
R
H
+
N
C
R'
-O
Legame rigido e
planare
Con due amminoacidi diversi si possono avere due dipeptidi diversi, a seconda di
quale gruppo carbossilico e quale gruppo amminico formino il legame peptidico
29
esempio: con glicina e alanina
In un peptide l’amminoacido con l’NH2 libero si chiama estremità amminica o
residuo N-terminale; l’amminoacido con il gruppo –CO2H libero si chiama estremità
carbossilica o residuo C-terminale; la catena che comprende i legami ammidici si
chiama catena principale; i sostituenti R degli amminoacidi costituenti il peptide si
chiamano catene laterali.
30
15
Per convenzione i peptidi si rappresentano scrivendo la sequenza da sinistra verso
destra, a partire dall'estremità con il gruppo amminico:
R'
O
H2N
residuo
N-terminale
N
H
R
primo
residuo
H
N
O
O
OH
residuo
C-terminale
R"
terzo
residuo
secondo
residuo
NOMENCLATURA. Il residuo C-terminale costituisce il nome base; gli altri residui si
chiamano come sostituenti (desinenza -ile).
O
H2 N
CH3
N
H
OH
O
I nomi degli amminoacidi
si abbreviano con le prime
tre lettere, si collegano
con"-" o con "."
glicilalanina
O
Gly-Ala
H2N
SH
H
N
O
H2N
N
CH3 H
N
CH3 H
OH alanilglicina
O
Ala-Gly
O
OH
alanilcisteinilfenilalanina
Ala-Cys-Phe
O
Ala.Cys.Phe
31
In caso di amminoacidi sostituiti, il sostituente si può indicare di seguito alla
abbreviazione del nome dell'amminoacido
H2N CH CO2H
CH2 CH2 CO2CH3
Me
Glu
H2NCH2CONH2
GlyNH2
Si presuppone che gli amminoacidi siano di serie L. Se sono di serie D, va indicato
O
H2N
O
OH
CH3
D-Ala
H2N
N
CH3 H
SH
H
N
O
O
OH
D-Ala-Cys-Phe
Quando si studiano i peptidi (e le proteine) le operazioni importanti sono:
1. Purificazione ed isolamento
2. Analisi degli amminoacidi e determinazione della sequenza
3. Sintesi
1. Perché si estrae dalla matrice biologica, insieme ad altre migliaia di composti
2. L’analisi non solo deve identificare quali amminoacidi costituiscono il peptide,
ma anche la sequenza, cioè l’ordine con cui gli amminoacido sono legati tra
loro, a partire dal residuo N-terminale fino al residuo C-terminale
3. Per avere quantità di peptide sufficiente per gli studi clinici, servono quantità
32
molto maggiori di quelle che si posono ottenere dalla matrice biologica.
16
PURIFICAZIONE ED ISOLAMENTO DEI PEPTIDI
Oltre al pI ed alla affinità per l'acqua o per i solventi organici è importante la dimensione
del
1. peptide
DIALISI
Con membrane semipermeabili è possibile separare molecole piccole (peptidi) da molecole grandi
(proteine)
Il piccolo peptide, però, sarà
distribuito dentro e fuori la
membrana semipermeabile.
il volume esterno deve essere molto
grande: quando la concentrazione dentro
e fuori la membrana semipermeabile è
uguale, c'è molto più peptide fuori.
Quando si ha una miscela complessa, tutte le molecole
al di sotto di una certa dimensione passano attraverso
la membrana, tutte quelle più grandi restano nella
sacca della dialisi
La dialisi è un metodo per una purificazione grossolana,
che permette di maneggiare grandi quantità di materiale
33
2. GEL FILTRATION
La gel filtration impiega un supporto polimerico poroso. Le molecole grandi, che non entrano nei pori,
vengono eluite rapidamente, mentre le molecole più piccole hanno tempi di ritenzione più lunghi.
Se la miscela di peptidi è complessa, più
grandi delle dimensioni dei pori verranno eluiti
insieme ed insieme verranno eluiti quelli più
piccoli
Usando un intervallo di dimensioni dei pori,
le molecole di dimensioni piccole entreranno
in tutti i pori, quelle di dimensioni medie
entreranno solo in alcuni, le molecole grandi
non entreranno in nessuno
Per molecole di dimensione intermedia diventano importanti i fattori di diffusione ed i tempi di
ritenzione sono approssimativamente una funzione lineare di log(MW).
Purificazione per gel filtration di una miscela con 4 peptidi di MW 5000 (A), 3000 (B), 500 (C) e 100 (D)
Colonna di gel filtration con una sola dimensione dei pori
Con pori di dimensione corrispondente a
circa MW 1000 (~12Å) verranno eluiti
prima A+B e poi C+D
MW>1000
MW<1000
34
17
Colonna di gel filtration con un intervallo di dimensione dei pori
I pori differiscono tra loro all’incirca di
12Å : i quattro peptidi vengono separati
Questo è un profilo tipico per una gel
filtration e dà anche un’indicazione del
peso molecolare dei peptidi
Con la gel filtration si ha un miglioramento della purezza del peptide ed una idea del
peso molecolare, ma per isolare un peptide veramente puroservono altri metodi.
3. CROMATOGRAFIA A SCAMBIO IONICO
Se una soluzione di una miscela di peptidi viene fatta passare lungo una colonna che contiene
un supporto polimerico carico, i peptidi verranno eluiti con una velocità diversa, che dipende
soprattutto dalla loro carica complessiva.
La carica del polimero può essere sia positiva che negativa.
35
P
O
L
I
M
E
R
O
H2SO4
NO2
Sn/HCl
NO2
+
N(CH3)3 I-
P
O
L
I
M
E
R
O
P
O
L
I
M
E
R
O
P
O
L
I
M
E
R
O
HNO3
+
N(CH3)3 I-
H2SO4
SO3
P
O
L
I
M
E
R
O
P
O
L
I
M
E
R
O
NH2
CH3I
(eccesso)
NH2
cromatografia a scambio di anione
l'anione ioduro può essere sostituito da altri anioni
SO3H
NaOH
SO3H
P
O
L
I
M
E
R
O
SO3 Na+
SO3 Na+
cromatografia a scambio di catione
il catione sodio può essere sostituito da altri cationi
I peptidi carichi positivamente hanno una elevata affinità per resine anioniche e non vengono
eluiti; i peptidi carichi negativamente non interagiscono con le resine anioniche e vengono36
eluiti rapidamente (il contrario si ha con le resine cationiche).
18
Per essere sicuri che tutto venga eluito in un tempo ragionevole, spesso si varia l'eluente con il
tempo e questo di solito migliora anche la separazione dei componenti. Si può variare il pH o la
forza ionica
A = Ala-Lys
B = Ala-Lys-Ala-Lys
A pH <9 entrambi i peptidi vengono
eluiti lentamente.
Aumentando il pH entrambi vengono
eluiti abbastanza rapidamente ed
escono a valori di pH prossimi al loro pI
C = Lys-Ala-Ala
D = Lys-Glu-Lys
Tra pH 3 e 10 hanno carica complessiva
molto simile
D contiene più gruppi polari: la sua maggiore
affinità per i solventi polari è incrementata
dall’aumento della forza ionica.
37
4. ELETTROFORESI
Nell'elettroforesi, una miscela di peptidi viene applicata su un supporto solido; il
supporto viene permeato con una soluzione di elettrolita, in modo che possa essere
applicata una differenza di potenziale.
Quando si fa passare la corrente,
i peptidi carichi positivamente
sono attratti verso il catodo,
verso cui migrano. Invece i
peptidi carichi negativamente
migrano verso l'anodo.
Il supporto più semplice è una striscia di
carta ed i peptidi si applicano vicino al centro
della striscia. I diversi peptidi migrano con
velocità diversa a seconda della loro carica
complessiva e della loro resistenza al
movimento: peptidi piccoli con carica elevata
migrano più velocemente.
38
19
tipico elettroforetogramma da
una miscela di di- e tri-peptidi,
eseguito a pH 7.
I dipeptidi Phe-Phe e Lys-Glu sono elettricamente neutri e restano vicino all'origine. Più alta è la
carica complessiva, più migrano i peptidi (per es., Lys-Lys > Lys-Phe), ma un aumento di
dimensione riduce la mobilità (per es., Lys-Lys-Phe migra meno di Lys-Lys).
L'elettroforesi su carta è un metodo molto efficace per purificare piccole quantità di peptidi.
Elettroforesi SDS-PAGE (PolyAcrylAmide Electrophoresis)
Come supporto, invece della carta, si preparara un gel di un polimero come la poliacrilammide e
la miscela di peptidi si applica ad una estremità
I gel di poliacriloammide si formano per polimerizzazione radicalica della propenammide
(acrilammide).
39
R.
.
R
NH2
NH2
O.
O
radicale stabilizzato
NH2
O
.
O
iniziatore
radicalico
R
R
NH2
+
NH2
+
O
R
NH2
NH2
.
O
O NH
2
n
R
O
O
O
NH2
O
NH2
O
NH2
NH2
NH
Per dare solidità al gel si
usano agenti di cross-linking.
CH2
O
PAGE si può eseguire come
l'elettroforesi su carta
NH
O
PAGE si esegue in presenza di dodecilsolfato si sodio (SDS)
O
+
CH3CH2CH2 CH2CH2 CH2CH2 CH2CH2 CH2CH2CH2 O S O Na
O
SDS (Sodium DodecylSuplhate)
SDS:
è un tensioattivo e denatura i peptidi (e le proteine)
circonda i peptidi (e le proteine) conferendo loro una carica complessiva negativa e
facendoli quindi migrare verso l'anodo
fa migrare i peptidi (e le proteine) solo in funzione del loro peso molecolare (migrano
40
più rapidamente i più piccoli).
20
(-)
Tipico elettroforetogramma SDS-PAGE;
il peso molecolare si deduce dalla
distanzapercorsa, per confronto con
standard noti
il campione
si applica qui
Peso
molecolare
a scala non è lineare ed è graduata in kilodaltons (1 kD = peso molecolare 1000)
Migrazione
SDS-PAGE è un ottimo metodo per separare peptidi
(e proteine) sulla base del solo peso molecolare e
permette anche di determinare il pesomolecolare
approssimato.
(+)
5. HPLC (High Performance Liquid Chromatography)
L'HPLC è una tecnica che usa supporti con elevata area superficiale e che può sopportare
pressioni abbastanza elevate.
10-100 atm, l'analisi dura 10-30 min
La presenza di un solo segnale all'HPLC è criterio per la purezza del peptide
- metodo analitico (< 1 mg)
- fase inversa
La cromatografia a fase inversa usa una fase stazionaria NON polare ed una fase mobile polare.
41 I
peptidi idrofili vengono eluiti rapidamente, quelli lipofili hanno tempi di ritenzione più lunghi.
Il supporto consiste di granelli di silice ( < 10 mm), in cui i gruppi Si-OH presenti sulla superficie
sono stati sililati per trattamento con RMe2SiCl.
Si(CH3)2R
CH3
H3C
OH
HO
HO
Si Cl
O
R
OH
R(CH3)2 Si
OH
O
R(CH3)2 Si
R = catena idrocarburica
O
O
O
Si(CH3)2R
O
Si(CH3)2R
O
O
O
O
Più lungo è R, più lipofila è la colonna
campione in solvente polare
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
eluente
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
acqua con quantità crescenti di un solvente
meno polare (MeCN, MeOH, i-PrOH), a pH
costante e vicino alla neutralità.
O
O
-----------------------
42
21
HPLC tipico
Il campione viene iniettato (I). A questo
punto inizia il gradiente del solvente. A è
il peptide più idrofilo, D il più lipofilo.
43
RIVELAZIONE DEI PEPTIDI
1. METODI NON DISTRUTTIVI
Assorbimento nell'ultravioletto
λmax ~ 214 nm (π
π* del carbonile ammidico)
di solito si usano λ 230 o 254 nm (spalla), perché la maggior parte degli eluenti ha assorbimento
significativo a 210 nm. Se ci sono sostituenti aromatici (Phe, Tyr), si usa λ = 280 nm
Indice di rifrazione
Quando nell'eluente è presente un composto, cambia l'indice di rifrazione (RI refractive index) del
solvente. Metodo molto sensibile, non può essere usato con gradiente di solventi
Rotazione ottica (OR)
La presenza di C chirali nei peptidi fa sì che questi ruotino la luce polarizzata
rivelatori OR laser, molto sensibili
I metodi non distruttivi non si possono usare per l'analisi di elettroforetogrammi
44
22
2. METODI DISTRUTTIVI
O
O
Ninidrina
H2O
O
OH
OH
O
O
conferisce una colorazione caratteristica viola-porpora
R
O
O
CH
R
O + H2N CH CO2H
N
H2O
O
O
R
ON
O
C
OH
CH H2O, H+
NH2 +
H
CO2, H+
O
R
C
O
Solo l’N del residuo Nterminale viene
incorporato nel prodotto:
il saggio non permette di
distringuere tra i vari
amminoacidi (o peptidi)
H
O
O
OH
O
..
NH2
+
O
OH
O
O
N
H2O
O
O
O
λmax= 570 nm
Fluorescammina
R
O
O
O
45
reagisce con qualsiasi gruppo -NH2
N
+ RNH2
assorbe a 390 nm
riemette a 475 nm
OH O
CO2H
O
Il metodo è molto sensibile, in grado di rivelare picomoli (10-12 moli)
Cloruro di dansile
H3C
N
CH3
H3C
N
reagisce con qualsiasi gruppo -NH2
CH3
+ RNH2
assorbe nell'UV
SO2Cl
SO2 NHR
Il metodo è in grado di rivelare < 1 μg (10-8 moli) di qualsiasi amminoacido (o peptide)
1,2-Benzendicarbaldeide (Aldeide ftalica, OPA o-phthalaldehyde)
in presenza di mercaptoetanolo, reagisce con qualsiasi gruppo -NH2
CHO
HS
+ RNH2
CHO
OH
S
N R
OH
assorbe a 340 nm
riemette a 450 nm
46
23
I metodi distruttivi sono accettabili solo se si usano piccole quantità di materiale.
Se si sta usando l'elettroforesi per purificare i peptidi, si può rimuovere una sottile
striscia di carta, sulla quale vengono visualizzati i peptidi
A
BC
D
A
B
C
------------------------------
D
A
BC
D
Una volta visualizzati i peptidi, si deduce la loro posizione sull'elettroforetogramma, si ritagliano
le strisce contenenti i peptidi, che vengono recuperati lavandoli via con un solvente.
La purificazione di un pentapeptide incognito verrà ottenuta con più passaggi successivi,
iniziando con quelli che permettono di trattare grandi quantità di materiale e passando poi
a tecniche che abbiano risoluzione sempre maggiore, man mano che diminuisce la
quantità di campione.
Una sequenza tipica può essere:
1. Dialisi: per rimuovere le proteine
2. Gel filtration: dà una purificazione significativa ed un PM approssimato
3. Cromatografia a scambio ionico: permette di trattare quantità relativamente
grandi di materiale.
4. HPLC in fase inversa: metodo ottimo per purificare quantità piccole di
peptidi
5. Elettroforesi su carta: per controllare la purezza del peptide e, se
necessario, per isolare in piccola scala il peptide veramente puro.
47
ANALISI DEI PEPTIDI
L’analisi dei peptidi consiste nell’individuare gli amminoacidi presenti e nel determinare la
sequenza con cui sono legati fra loro
ANALISI DEGLI AMMINOACIDI
1. Idrolisi totale dei peptidi
a) Idrolisi acida
I gruppi ammidici sono relativamente poco reattivi e
possono essere idrolizzati incondizioni fortemente acide
o basiche od usando enzimi specifici.
E' il metodo più usato per l'idrolisi totale dei peptidi allo scopo di
analizzare gli amminoacidi
Condizioni standard: HCl acquoso 6M 110°C, 24 ore
pompa da
vuoto
riscaldato
a 110°C
per 24 ore
HCl 6 M
La reazione si esegue di solito in un
tubo di vetro sigillato, che prima di
essere chiuso viene accuratamente
degassato.
fiamma
campione di peptide
Al termine il tubo viene rotto, il solvente viene
evaporato, lasciando gli amminoacidi che
costituivano il campione.
48
24
Alcuni amminoacidi possono essere distrutti nelle condizioni di idrolisi acida:
- Ser e Thr si disidratano ad alcheni (di solito le perdite non sono gravi)
- Met, Cys e Cys2 si ossidano facilmente a 110°C. Non basta degassare, bisogna flussare
accuratamente con azoto.
- Trp viene completamente distrutto.
Anche le catene laterali ammidiche vengono idrolizzate: l'asparagina ad acido aspartico, la
glutammina ad acido glutammico.
b) Idrolisi basica
Condizioni standard: NaOH 2 M in acqua, 100°C.
Arginina, cisteina, serina e treonina sono completamente distrutte, il triptofano no.
c) Idrolisi enzimatica
Gli enzimi peptidasi scindono i legami ammidici
Condizioni standard: pH 7, 37°C, quantità catalitica di enzima
Amminopeptidasi
Carbossipeptidasi
scindono (velocemente) i legami peptidici, liberando gli amminoacidi
uno dopo l'altro, a partire dal residuo N-terminale. La scissione si
interrompe tutte le volte che si arriva:
- ad un residuo Pro: il gruppo amminico è secondario e la
catena laterale non può entrare nel sito attivo dell'enzima
- ad un D-amminoacido: la configurazione D impedisce alla
catena laterale di entrare nella tasca del sito catalitico.
scindono (lentamente) i legami peptidici, liberando gli amminoacidi
uno dopo l'altro, a partire dal residuo C-terminale.
49
2. Separazione degli amminoacidi
Eseguita l'idrolisi totale del peptide, il problema successivo è separare gli amminoacidi liberati.
a) Cromatografia a scambio ionico
Di solito si usano solfonati (resine a scambio di catione).
I tempi di ritenzione relativi sono influenzati dalla carica complessiva
dell'amminoacido.
Gli amminoacidi si separano in base alla carica complesiva.
Si raccolgono più frazioni che poi si analizzano
Supponiamo di avere Gly, Phe, Lys e Glu
a pH 7
Gly: ha H come catena laterale; praticamente non carico
Phe: ha CH2Ph come catena laterale (effetto -I); praticamente non carico
Glu: ha un altro gruppo acido; complessivamente ha una carica negativa
Lys: ha un altro gruppo amminico; complessivamente ha una carica positiva.
Ordine di eluizione a pH 7
Glu (carica complessiva -1)
Gly e Phe (carica complessiva 0)
Lys (carica complessiva +1)
50
25
a pH 2
A pH 2 gli amminoacidi non avranno cariche intere, perché è un valore di pH più
acido del punto isoelettrico.
Gly + 0.7, Phe + 0.4, Glu + 0.6, Lys + 1.6
Phe, Glu, Gly, Lys
Ordine di eluizione a pH 2
eluizione molto lenta (anche
alcuni giorni)
Per separare tutti gli aminoacidi in tempi ragionevoli, nel corso della eluizione il
pH viene gradualmente aumentato da 3 a 10: vengono eluiti prima gli amminoacidi
acidi, poi quelli neutri ed infine quelli basici
La cromatografia a scambio ionico si può effettuare automaticamente, con un analizzatore di
amminoacidi. Le frazioni raccolte sono esaminate spettrofotometricamente, dopo aggiunta di
ninidrina, a 570 nm (sapendo il coefficiente di estinzione molare, si conosce anche la
51
concentrazione.
pH 3.25
A
a 570 nm
(eluente +
ninidrina)
Cys
Asp
pH 4.25
Ser
Thr
Glu
Met
Val
Leu
Ile
Gly Ala
Tyr Phe
pH 9.0
Trp NH
His Lys 3
Cys
Arg
2
Pro
Volume di eluizione, ml
Cromatografia a scambio di catione per la separazione di quantità equimolari degli aa codificati dal DNA
A
(eluente +
ninidrina)
Volume di eluizione, ml
A = Glu, B = Gly, C = Phe, D = Lys, E = ammoniaca
Gli amminoacidi ottenuti dall'idrolisi totale di un peptide, fatti passare attraverso una colonna 52
a scambio di catione, vengono identificati per confronto con gli standard.
26
b) HPLC
L'HPLC in fase inversa è particolarmente efficiente per separare gli amminoacidi, che si possono
rivelare con la ninidrina o facendone i fluorenilmetossicarbonilderivati, che assorbono a circa 280
nm.
R
+
H2N
CO2H
λ = 280 nm
O
O
O
O
Cl
cloruro di fluorenilmetossicarbonile
R
NH
CO2H
Derivato Fmoc dell'amminoacido
(Fmoc-Cl)
vantaggi
si usano strumenti HPLC standard e si rivelano tutti gli amminoacidi, compresa la
prolina.
c) Gascromatografia
Gli amminoacidi, esistendo generalmente come ioni dipolari, non sono volatili e vanno trasformati
in derivati volatili per poter essere analizzati via GC.
1. EtOH, H+
2. (CF3CO)2O
R
H2N
O
N
H
F 3C
CO2H
R
CO2Et
R
Me3SiCl
Me3 Si
Et3N
N
H
CO2SiMe3
Generalmente la temperatura della colonna viene aumentata con il tempo
(+)
fiamma
(-)
Registratore
H
O
2
53
Rivelatore ad ionizzazione di fiamma: il
gas
di
trasporto
(eluente)
viene
convogliato su una fiamma che brucia in
una camera, attraverso la quale è
applicata una differenza di potenziale: la
corrente dipenderà dal numero di
particelle ionizzate prodotte dalla fiamma.
2
gas dal GC
Gly
(92°C)
Quantità
rivelata
Glu
(148°C)
Phe
(135°C)
Lys
(170°C)
vantaggi
Si possono usare gli strumenti GC standard.
Si possono rivelare tutti gli amminoacidi
(anche se danno risposte diverse al f.i.d.)
Il GC può essere direttamente collegato ad
uno spettrometro di massa
Tempo di ritenzione, min
Analisi GC dei trifluoroacetammido esteri degli aa
54
27
d) Elettroforesi su carta
La tecnica si effettua caricarndo la miscela di amminoacidi su una striscia di carta che viene
poi imbevuta con un tampone acquoso ad un pH opportuno. Quando alla carta si applica una
differenza di potenziale, gli amminoacidi con carica globale positiva migrano verso il catodo,
quelli con carica globale negativa migrano verso l'anodo.
(-)
(+)
il campione
Phe
viene
Lys applicato Gly
qui
elettroforesi a pH 8
Glu
scarsa risoluzione-
Svantaggi:
molto difficile eseguire un'analisi quantitativa
Vantaggi:
☺
☺
utile per separare amminoacidi insoliti
utile per separare amminoacidi marcati con isotopi radioattivi
55
a) Cromatografia su carta
La cellulosa funziona da supporto e l'acqua ad essa legata (legame idrogeno) fa da
fase stazionaria. Si usa un eluente acquoso (cromatografia di ripartizione).
La cromatografia su carta separa gli amminoacidi in base alla polarità. Gli
amminoacidi meno polari vengono eluiti più rapidamente.
Al termine dell’eluizione ai spruzza ninidrina, che dà una macchia violetta in
corrispondenza degli amminoacidi.
Eluenti tipici contengono:
- acqua
- soluzione ammoniacale (per aumentare il pH)
- acido acetico (per diminuire il pH)
56
- 1-butanolo (per diminuire la costante dielettrica).
28
Se non si riesce a separare completamente gli amminoacidi con la cromatografia su carta, si
può tentare una cromatografia bidimensionale.
Si fa correre l'eluente in una direzione, si asciuga la carta, si cambia eluente e si fa
correre in direzione perpendicolare alla precedente.
S
O
L
V
E
N
T
E
1 Glu
2 Ser
3 Gly
4 Thr
5 Lys
6 Ala
7 Arg
8 Tyr
9 Val
10 Pro
B
SOLVENTE A
Cromatografia su carta in due dimensioni di una miscela di 10 a
57
DETERMINAZIONE DELLA SEQUENZA
1. Analisi dei residui alle estremità del peptide
I residui alle estremità sono gli unici che hanno, rispettivamente, il gruppo aminico ed
il gruppo carbossilico liberi (a parte quelli che li contengono nelle catene laterali).
Si modificano chimicamente questi gruppi funzionali, si esegue l'idrolisi del
peptide: gli amminoacidi alle estremità vengono liberati in forma modificata
Residuo N-terminale
a. Metodo di Sanger
I gruppi amminici primari e secondari sono abbastanza nucleofili da dare reazione
con il 2,4-dinitrofluorobenzene (reagente di Sanger), dando i 2,4-dinitrofenil derivati
(DNP, dinitrophenyl)
H
F
..
R NH2 +
NO2
R
H
NH
F
R N
+
-
NO2
NO2
HF
NO2
NO2
NO2
58
Frederick Sanger
29
Il gruppo DNP è stabile all'idrolisi acida. Idrolizzando il peptide, si liberano gli
amminoacidi: l’unico con DNP in α è il residuo N-terminale.
F
CO2H
NO2
CO2H
H
N
H2N
O
H
N
N
H
O
O
H
N
NH
O
NO2
CO2H
N
H
O
O
O2N
O
H
N
N
H
N
H
O
CO2H
SMe
SMe
NO2
NH
NO2
NH2
Asp-Met-Phe-Lys-Ala
NO2
+
CO2H
H2O, H+
O
H3N
OH
+
OH
NH
H3N
O
O2N
O
OH
+
+
NH
+
+
NO2
+
H3N
SMe
+
OH
H3N
CO2H
O
NO2
DNP-Asp
Lys(DNP)
NO2
Ala
Phe
Met
Provenendo dall’idrolisi acida, gli amminoacidi sono in forma cationica!
59
L'identificazione si fa per confronto con i DNP derivati degli amminoacidi.
Gli amminoacidi che hanno gruppi amminici in catena laterale saranno sostituiti in
una posizione diversa dalla α.
CO2H
H2N α
γ
β
O2N
δ
ε NH
NO2
derivato Nε-DNP
(tutti i residui di Lys)
NO2
CO2H
N
NO2 H
NH
NO2
derivato Nα,Nε-bis-DNP
(Lys N-terminale)
NO2
l processo di identificazione si può migliorare estraendo i DNP derivati con solventi
organici (cloroformio, acetato di etile).
Più recentemente il cloruro di dansile viene utilizzato a preferenza del
reagente di Sanger (i derivati hanno forte assorbimento nell'UV).
H3C
N
CH3
H3C
N
CH3
+ RNH2
SO2Cl
SO2 NHR
60
30
Residuo C-terminale
L'identificazione dell'estremità carbossilica è meno facile
a. trattamento con NH2NH2
L'idrazina (Nu forte) attacca tutti i legami ammidici e come base dà l'anione
carbossilato. L’unico carbossile libero al termine della reazione è quello del residuo Cterminale (o un carbossile in catena laterale)
H
N
Asp Met Phe
O
H
N
Asp Met Phe
CO2H
N
H
..
H2N
+
NH NH2
+
H2N
NH2
H2N
NH2
Asp NH NH2
O
Met NH NH2
+
NH2
Phe NH NH2
CO2
NH2
+
Lys NH NH2
b. trattamento con LiBH4
Tutti i gruppi carbossilici si trasformano in esteri metilici: il trattamento con LiBH4
riduce le funzioni esteree, ma non quelle ammidiche.
O
N
H
Asp Met Phe Lys
Asp Met Phe Lys
CO2H
N
H
CO2CH3
N
H
61
O
Asp Met Phe Lys
O
MeOH, H+
CO2CH3
O
LiBH4
Asp Met Phe Lys
CH2OH
N
H
Per idrolisi totale del peptide modificato, si ottengono gli amminoacidi ed un
amminoalcool (quello dal residuo C-terminale)
H2O, H+
Δ
Asp + Met + Phe + Lys +
H2N
CH2OH
estraibile con solvente
organico (etossietano)
a pH 11
I metodi non sono molto sensibili ed il limite inferiore è circa 10μg.
2. Rimozione dei residui uno alla volta
Residuo N-terminale
Degradazione di Edman
S
reagente:
isotiocianato di fenile
N
C
Edman
62
31
S
R
H
+
C
N
N
N
Peptide
H H O
S
C
N
R
H
N
H2N
+
S
Peptide
R
C
HN
N
H
S-
O
Peptide
O
R
H
C +
N
N
Peptide
H H O
N
H
N
tiourea
Si aggiunge HCl 6 M che distrugge l'eccesso di Ph-N=C=S e promuove la reazione
successiva
S
HN
R
C
N
H
H+
H
N
Peptide +
H2N
Peptide
HN
N
O
R
S
H
con un residuo in
meno rispetto al
peptide iniziale
O
N
S
O
N
H
R
H
derivato della
feniltioidantoina
(termodinamicamente più stabile)
La tioidantoina si estrae con un solvente organico e si identifica per confronto con le
63
tioidantoine preparate con i vari amminoacidi.
Esempio:
CO2H
H
N
H2N
N
O
H
N
N
H
O
1.
O
N
H
O
CO2H
C
S
S
+
HN
N
2. H+
CO2H
+
O
H3N
N
H
O
O
H
N
SMe
SMe
+
H3N
O
N
O
H
N
N
H
Met-Phe-Lys-Ala
NH2
Asp-Met-Phe-Lys-Ala
N
H
O
CO 2 H
C
1.
N
3
O
H
N
+
+ H3 N
+ NH
N
H
O
O
CO 2 H
S
+
Met-Phe-Lys-Ala
H
N
H3 N
HN
2. H+
SMe
+
S
S
CO2H
N
H
O
NH3
+
Phe-Lys-Ala
O
N
H
O
CO2H
N
1.
2. H+
Phe-Lys-Ala
NH3
+
NH3
C
+
S
S
HN
N
O
H3N
CO2H
N
H
+
O
Lys-Ala
+
NH3
64
32
+
O
H3N
N
H
CO2H
N
1.
S
C
HN
S
+
N
+
2. H+
Lys-Ala
H3N
O
CO2H
N
+ H3
Ala
+
NH3
☺ con 50 μg si può ricostruire la sequenza di un pentapeptide
☺ il processo è stato automatizzato
Vantaggi:
Svantaggi
non è abbastanza sensibile per le piccole quantità di peptide
spesso a disposizione
con la ripetizione del ciclo di reazione il peptide rimanente
contiene sempre più impurezze e dopo 20 residui i risultati
possono essere ambigui
è necessario che l'estremità contenga il gruppo amminico
libero (ed in molti peptidi naturali non è così).
Se si deve ricostruire la sequenza di un peptide contenente più di 20-30
residui di amminoacidi, si effettua una scissione parziale a peptidi più
piccoli.
65
Residuo C-terminale
La carbossipeptidasi scinde gli amminoacidi uno alla volta, partendo dal residuo
C-terminale. L'idrolisi è abbastanza lenta ed interrompendola intempi successivi
(per es., per acidificazione) è possibile determinare i primi residui dagli
amminoacidi liberati.
Esempio: Usando la carbossipeptidasi sul pentapeptide Asp-Met-Phe-Lys-Ala, si
ottengono i seguenti risultati:
tempo di reazione (min)
2
6
20
60
Aa liberati (equivalenti)
Ala (0.34)
Ala (0.73) Lys (0.17)
Ala (0.96), Lys (0.52), Phe (0.07)
Ala (0.96), Lys (0.52), Phe (0.07) Met (0.12)
Con il procedere del tempo, le diverse velocità di idrolisi determinano un quadro più
complesso. Di solito non è possibile risalire la sequenza per più di 3-5 residui.
66
33
3. Idrolisi parziale
L'idrolisi parziale (chimica o enzimatica) scinde il peptide in peptidi più
piccoli, di cui è più facile ricostruire la sequenza: la struttura del peptide
iniziale si ricostruisce trovando i punti in comune dei peptidi più piccoli.
Esempio
Ala-Phe-Gly-Glu-Phe-Ser-Ser-Phe
ottapeptide
idrolisi parziale
eptapeptidi + amminoacidi
Ala + Phe-Gly-Glu-Phe-Ser-Ser-Phe + Ala-Phe-Gly-Glu-Phe-Ser-Ser + Phe
esapeptidi + dipeptidi
Ala-Phe + Gly-Glu-Phe-Ser-Ser-Phe + Ala-Phe-Gly-Glu-Phe-Ser + Ser-Phe
pentapeptidi, tripeptidi
67
Si raccolgono tutti i peptidi della stessa lunghezza: per esempio i tripeptidi
Ala-Phe-Gly-Glu-Phe-Ser-Ser-Phe
Ala-Phe-Gly
Glu-Phe-Ser
Phe-Gly-Glu
Phe-Ser-Ser
Gly-Glu-Phe
Ser-Ser-Phe
Ala-Phe-Gly
Phe-Gly-Glu
Gly-Glu-Phe
Glu-Phe-Ser
Phe-Ser-Ser
Ser-Ser-Phe
Un peptide (o una proteina) può essere idrolizzato parzialmente anche usando enzimi,
detti endopeptidasi, che catalizzano l’idrolisi di un legame ammidico non terminale
Idrolisi enzimatica
Enzima
Tripsina
Chimitripsina
Elastasi
Specificità
idrolizza dal lato carbonilico di Arg e Lys
idrolizza dal lato carbonilico di amminoacidi contenenti
anelli aromatici a 6 termini (Phe, Tyr, Trp)
idrolizza dal lato carbonilico di piccoli amminoacidi (Gly, Ala)
68
34
SINTESI DEI PEPTIDI
La sintesi dei peptidi permette di:
-confermare la struttura di un peptide naturale
- preparare quantità relativamente grandi di peptidi rari
- preparare peptidi nuovi
Supponiamo di dover preparare il pentapeptide Glp-Phe-Gly-Gly-Lys partendo da Lamminoacidi facilmente disponibili.
+
H3N
Affrontiamo il problema iniziando
ad unire insieme due residui a
partire da quello C-terminale: si
tratta di fare il dipeptide Gly-Lys
H3N
+
CO-2 +
CO2
?
H
N
H3N
+
CO2
O
NH2
NH2
si può pensare di trasformare la glicina nel suo cloruro acilico e poi di aggiungere la
lisina
H3N
+
CO-2 + SOCl2
H
N
NH2
Se però si fa questa reazione:
CO2
H2 N
Cl
H2N
H2N
H2N
CO2
O
O
+
NH
H2N
+ polimeri della Gly
NH2
CO2
O
+ polimeri
oltre al dipeptide desiderato si formano un centinaio di sottoprodotti!
69
Per formare un dipeptide dagli amminoacidi che lo costituiscono, bisogna
proteggere tutti i gruppi funzionali, tranne quelli che dovranno essere coinvolti
nella formazione del legame ammidico
H2N
H2N
CO-2
CO2
?
Gly-Lys
+
NH2
posizioni che devono essere protette per avere l'accoppiamento corretto
si devono scegliere gruppi protettori che si possano rimuovere senza rompere il legame
peptidico appena formato
- Protezione del gruppo amminico
si ottiene diminuendo la nucleofilicità dell'N, trasformando il gruppo amminico in
alcossicarbonil derivato
R
NH
O
O
R = PhCH2, t-Bu, Et
Cambiando R, la deprotezione si può ottenere
con varie condizioni blande.
- Protezione del gruppo carbossilico
si ottiene trasformando l'acido nell'estere corrispondente (gli esteri sono più reattivi
70
delle ammidi)
35
La sintesi del dipeptide Gly-Lys si può perciò effettuare nel modo seguente
O
Gly
Et O
Cl
N
H
H2N
H
O
O
Et O
CO2Me
CO2Me
N
N
H
1. OH-, H2O
O
2. H+ acquoso
O Et
HN
Lys
Gly-Lys
O
O Et
HN
O
Questa strategia funziona bene per preparare il dipeptide. Se però si vuole continuare
la sintesi di un peptide più lungo, bisogna introdurre di nuovo i gruppi protettori:
sarebbe meglio poter rimuovere solo il gruppo protettore dell'NH2 in α
H
N
O
Gly
R' O
N
H
CO2R
H
N
H2N
CO2R
accoppiamento del
residuo successivo (X)
X
all'NH2 libero in α
O
O
rimozione
selettiva di R'
Lys
ecc.
CO2R
O R
HN
O R
HN
Gly Lys OR
O
O
71
La sintesi dei peptidi si semplifica notevolmente, se si usano due tipi di gruppi
protettori, ciascuno dei quali può essere rimosso selettivamente.
L'uso di gruppi protettori complementari si dice protezione ortogonale
Un esempio di protezione ortogonale si
ha con i bruppi benzile/terz-butile
RCO2H
RCO2R'
RNH2
R
HN
reagente
TFA
H2/Pd-C
×
√
R'=CH2Ph
√
R'= CMe3 (t-Bu)
O R'
×
O
= stabile
√
×
= deprotezione
entrambi i gruppi si possono rimuovere con HBr/AcOH o HF
Combinando i gruppi protettori benzile e t-butile, si può preparare facilmente un
dipeptide Gly-Lys protetto, pronto per le reazioni successive
O
H3C
H3C
C O N
H3C
H
O
H
N
O
O
Boc Gly
O
HN
O
Lys
OCH2Ph
Z
72
36
il trattamento con TFA deproteggerà solo il gruppo amminico in α, lasciando protetti
il gruppo carbossilico ed il gruppo amminico in catena laterale. L'NH2 su può
accoppiare con il successivo amminoacido protetto e così via, fino ad ottenere la
sequenza desiderata
Il pentapeptide Glp-Phe-Gly-Gly-Lys si può preparare nel modo seguente:
Boc Gly
OH
+
H
Lys OCH2Ph
Z
1. accoppiamento
2. aggiunta di TFA
OH
Boc Gly
+
H
Gly Lys OCH2Ph
Z
1. accoppiamento
2. aggiunta di TFA
Boc Phe
+
OH
H
Gly Gly Lys OCH2Ph
1. accoppiamento Z
2. aggiunta di TFA
OH
Glp
+
H
Phe Gly Gly Lys OCH2Ph
Z
accoppiamento
Glp
Phe Gly Gly Lys OCH2Ph
Z
H2/Pd-C
73
Glp Phe Gly Gly Lys
Un modo abbreviato di rappresentare la sintesi peptidica è quello di indicare ciascun residuo
con una linea verticale, i legami con linee orizzontali, i gruppi protettori con segmenti diagonali
e mettendo i reagenti tra le strutture:
Glp
Gly
Phe
Lys
Gly
Z
Boc
Boc
Boc
Boc
Boc
Boc
OH
H
accoppiamento
H2/Pd-C
OH H
accoppiamento
TFA
OH
H
accoppiamento
TFA
OH
H
accoppiamento
TFA
Z OCH2Ph
OCH2Ph
Z
OCH2Ph
Z
OCH2Ph
Z
OCH2Ph
Z
OCH2Ph
Z
OCH2Ph
Z
OCH2Ph
OH
74
37
- Protezione di altri gruppi
In catena laterale ci possono essere gruppi che devono essere protetti
Amminoacido
protetto
abbreviazione
rimozione
Arg(NO2)
H2/Pd-C
Amminoacido
protetto
abbreviazione
rimozione
NO2
N
NH2
NH
H3N
CO-2
H3N
+
+
Na/NH3liq.
Cys(CH2Ph)
S
CO2
O
N
His(Bom)
N
O
H2/Pd-C
H3N
H3N
+
CO2-
Ser(CH2Ph)
CO-2
HBr/AcOH
o Na/NH3liq.
+
O
Tyr(CH2Ph)
H3N
+
CO-2
HBr/AcOH
o Na/NH3liq.
75
Tutti questi gruppi protettori sono stabili quando si tratta con TFA. Sono tutti rimuovibili con HF.
INTRODUZIONE DEI GRUPPI PROTETTORI
Spesso costa meno comperare gli amminoacidi già protetti (perché preparati ingrandi quantità).
Dovendoli preparare, i gruppi protettori più comuni si introducono nel modo seguente:
O
O
O
R NH2 +
O
R NH2 +
R CO2H
R CO2H
O
Cl
O
O
+
O
NHR
R
Z
NH
R
Boc
NH
O
NEt3
O
O
OH
+
NEt3
NHR
O
H+
R
O
O
H+
R
O
R CO2CH2Ph
R CO2But
Un problema particolare si presenta quando dobbiamo differenziare due gruppi amminici o due
gruppi carbossilici. La soluzione dipende da quale gruppo si deve proteggere.
76
38
Per esempio, la protezione della catena laterale della lisina con Z si può effettuare sul
chelato con un catione, come quello rameico; successivamente il gruppo amminico si
protegge con Boc, dopo aver rimosso il catione
O
CO2
H2N
H2N
H2N ..
Cu2+
2
O
NH2
O
O
. .. O
Cu..
. . NH
O
2
Cl
NEt3
NH2
O
O
N
H
O
.. O
Cu..
. .NH
O
2
H2N .. .
O
H
N
O
O
O
H2S
O
O
O
O
O
O
O
O
N
H
CuS
N
H
NEt3
NH2
H
N
O
O
CO2H
CO2
Boc Lys(Z) OH
77
FORMAZIONE DEL LEGAME PEPTIDICO
Dovendo formare il legame ammidico tra due amminoacidi, opportunamente
protetti, bisogna trasformare il gruppo OH dell'acido in un buon gruppo uscente
O
O
Boc HN
Boc HN
OH
X
Boc-Gly-X
Boc-Gly-OH
Per gli acidi carbossilici l'attivazione più usata nel passato è stata la trasformazione in cloruri acilici
O
R
O
SOCl2
R
OH
O
R'NH2
Cl
R
NHR'
per la formazione del legame peptidico, se l'attivazione è troppo forte, si
hanno dei problemi, il principale dei quali è la racemizzazione del C α
però
O (-)
O
base
O
R (-)
R
X
X
R
OH
H
otticamente
puro
X
R
acido
X
O
O
X
R
+
H
R
H
racemico
X
78
39
L'acido carbossilico libero non dà racemizzazione in ambiente basico, ma il cloruro
acilico la dà, (Cl favorisce la formazione dell'anione)
O
O
H
base
H2 N
N
O
OH
H R
il centro chirale è "al sicuro"
H R
O
H
N
H
H
N
base
X
(dianione sfavorito)
OX
racemizzazione
R
R
Con i peptidi (e con gli amminoacidi con il gruppo amminico protetto come ammide
semplice) c'è un altro meccanismo con cui avviene la racemizzazione quando il
gruppo OH dell'acido carbossilico è sostituito con un gruppo uscente molto buono.
O
H
N
=
X
OH
O
R
H
N
..
R
X
O
N
X
R
H
O
H+
O
ossazolone
Gli ossazoloni sono molecole abbastanza reattive e possono fare legame peptidico per trattamento
con l'opportuno composto con il gruppo amminico
N
N
R
H
O
R'
H+
: NH
O
-O
O
2
N
R
O
O
H
N R'
H
O
H
N
R
H
N R'
H
O H
R
N
H
R'
79
però l'ossazolone dà racemizzazione in condizioni molto blande, soprattutto
inseguito a deprotonazione base-catalizzata, dando un anello aromatico a 6
elettroni π
N
R
:B
N
H
O
BH+
O
O
O
- R
N
- N
R
O
O
R
O
O
-
qualunque formazione di ossazolone potrebbe portare a racemizzazione del centro
chirale, pregiudicando l'integrità del peptide appena preparato
Per ridurre il grado di racemizzazione durante le reazioni di formazione del legame
peptidico si può:
eseguire reazioni di accoppiamento in cui il carbossile attivato sia quello
della glicina (che non è chirale) o della prolina (che non forma ossazolone)
scegliere condizioni di reazione che minimizzino la racemizzazione
(solvente poco polare, pH neutro, bassa temperatura)
scegliere accuratamente le condizioni per attivare il carbossile (v. dopo)
usare nelle reazioni di accoppiamento amminoacidi protetti con gruppi
alcossicarbonile
R'O
H
N
O
O H R
acido
X
}
praticamente nessuna racemizzazione
80
base
40
con questi derivati non si osserva praticamente racemizzazione, tranne che in
condizioni molto estreme (si pensa che gli alcossiossazoloni corrispondenti siano
difficili da deprotonare sul C α).
gli amminoacidi protetti con alcossicarbonile possono essere "attivati" e poi
accoppiati con l'amminoacido appropriato, senza rischio di avere racemizzazione.
REAGENTI PER L'ACCOPPIAMENTO PEPTIDICO
DICICLOESILCARBODIIMMIDE (DCC)
R
O
C
OH
N
C
N
+
R
O
C
HN
O C
N
R' NH2 R
O
C
HN
O C
NH
+
NHR'
DCC
dicicloesilurea
La DCC può essere aggiunta direttamente alla miscela di acido ed ammina, perché
con l'ammina dà solo un equilibrio.
La dicicloesilurea è poco solubile e si separa per filtrazione
L'uso della DCC permette di accoppiare un acido ed un'ammina in una reazione
81
"one-pot" ed è il metodo più semplice di formazione del legame ammidico.
ANIDRIDE
Se l'acido carbossilico si tratta con mezzo equivalente
di DCC, si osserva la formazione del precipitato bianco
di diciloesilurea anche prima dell'aggiunta della DCC,
a causa della formazione di anidride
2
R
O
C
DCC
OH
H2O
R
O
C
O
C
O
R
L'anidride può essere utilizzata per la formazione del legame ammidico
R
O
C
O
C
O
R
+ R' NH
2
R
O
C
+
NHR'
R
O
C
OH
Questo procedimento è molto usato nella sintesi di peptidi, perché la reazione è pulita
ed avviene velocemente (di solito entro un'ora).
Le anidridi simmetriche, formate da acido e DCC, reagiscono con le ammine per
dare ammidi che di solito sono molto pure, ma questo metodo comporta lo spreco
di metà dell'acido carbossilico (costoso).
L'inconveniente si può evitare usando anidridi miste:
R
O
C
O
C
+ H3C
Cl
OH H3C C
CH3
R
O
C
O
C
O
O
CH3 R' NH2
+ (CH3)3CO2H
C
C
R
NHR'
H3C CH3
82
41
ESTERE ATTIVO
Gli esteri metilici sono poco reattivi con le ammine e perciò non
sono buoni substrati per la sintesi di peptidi.
la reazione diventa utile con esteri con gruppi OR migliori gruppi uscenti
(maggiore stabilità do RO- )
R
O
C
F
O R' + H2N R'
R
R
O
C
O
C
O F
C
R
O
NO2
O
esteri pentafluorofenilici
(reagiscono in 12 ore)
+ R'O-
F
F
esteri p-nitrofenilici
NHR'
F
(reagiscono in 1 ora)
Alcuni esteri attivi possono essere preparati in situ. Per esempio, l'1-idrossibenzotriazolo e
la DCC vengono fatti reagire con l'acido carbossilico in uno stadio di "pre-attivazione"; la
successiva aggiunta di ammina porta alla formazione pulita dell'ammide desiderata.
N
R
O
C
DCC
HN
C O
N
OH
O
C
N
N
R
HO
R
O
C
N
N
HN
+ O C
HN
O
N
Quando gli esteri attivi vengono fatti reagire con le ammine, si ottengono ammididi
elevata purezza, ma gli esteri attivi possono essere difficili da preparare (o costosi
83
da comperare).
AZIDI
Le azidi aciliche si possono formare dagli esteri carbossilici per trattamento con
idrazina (che forma l'idrazide dell'acido) ed acido nitroso (fonte di NO+).
R
O
C
O R'
H2N NH2
MeOH
R
O
C
NO+
+
N N N
R
C
O
NH NH2
azide acilica
(stabilizzata per risonanza)
Il gruppo azido è un gruppo uscente moderatamente buono. La reazione con le
ammine avviene in circa 10 ore, dando l'ammide corrispondente.
R
O
C
N3
+ H2N R'
H+, N3-
R
O
C
NHR'
Il metodo dell'azide non viene scelto di solito, perché le azidi aciliche danno reazioni secondarie
(per esempio la trasposizione di Curtius) e la formazione di ammide è piuttosto lenta. Però le azidi
non danno racemizzazione.
La formazione di legame peptidico con azide si usa solo quando la racemizzazione
è un problema serio, soprattutto nell'accoppiamento di due frammenti peptidici.
84
42
Riassumendo, i quattro metodi principali di accoppiamento peptidico sono:
Metodo
Forma attivata
R
DCC
O
C
R
Estere
attivo
R
HN
O C
N
O
C
Anidride
Vantaggi
Svantaggi
qualche reazione
secondaria
semplice
O
C
O
R
reazione
molto pulita
sprechi
piuttosto costoso
reazione
molto pulita
esteri attivi costosi
o di non facile
preparazione
F
O
C
NO2
O
O F
C
R
O
F
F
F
Azide
R
assenza di
racemizzazione
nell'accoppiare
frammenti
O
C
N3
numerose reazioni
secondarie
85
STRATEGIA
Dovendo preparare un peptide, dobbiamo eseguire la sintesi aggiungendo un
amminoacido alla volta o dobbiamo costruire la molecola in pezzi? Ci sono altri
fattori che possono influenzare il progetto della via sintetica?
SINTESI LINEARE o CONVERGENTE ?
Una sintesi di peptide si chiama lineare se la molecola-obbiettivo viene costruita
accoppiando un residuo amminoacidico alla volta.
Una sintesi di peptide convergente comporta la sintesi separata di frammenti
peptidici (contenenti due o più residui) che poi vengono accoppiati, formando il
peptide finale.
Consideriamo la sintesi di un ottapeptide, la cui sequenza di amminoacidi si indichi con:
A-B-C-D-E-F-G-H
Supponiamo di poter garantire una resa del 90% per ciascun passaggio di accoppiamento e
confrontiamo la resa complessiva di una sintesi lineare con quella di una sintesi convergente
Sintesi lineare:
A + B
+ F
+ C
A-B
A-B-C
90%
81%
A-B-C-D-E-F
59%
+ G
+ D
A-B-C-D-E-F-G
53%
+ E
A-B-C-D
A-B-C-D-E
73%
+ H
66%
A-B-C-D-E-F-G-H
48%
86
43
Sintesi convergente:
90%
A + B
C + D
A-B
C-D
E + F
G + H
E-F
G-H
}
}
81%
A-B-C-D
73%
}
A-B-C-D-E-F-G-H
E-F-G-H
La resa complessiva mette in evidenza il vantaggio della sintesi convergente.
Il numero di passaggi è lo stesso, ma il metodo lineare fa sì che si abbia a che fare con peptidi
sempre più grandi ad ogni passaggio di accoppiamento, mentre il metodo convergente
permette di eseguire la maggior parte dei passaggi con frammenti relativamente piccoli.
La sintesi convergente dà rese più elevate e comporta la manipolazione di frammenti
peptidici piccoli e facili da maneggiare per la maggior parte dei passaggi.
QUALI FRAMMENTI ACCOPPIARE?
Per la sintesi convergente di un pentapeptide, per esempio Glp-Phe-Gly-Gly-Lys, ci possono
essere strade diverse
Glp-Phe
Glp +
+
Glp-Phe
Phe-Gly
Gly-Gly-Lys
+
+
Gly-Gly
A
C
Gly-Lys
B
+ Lys
Glp-Phe-Gly-Gly-Lys
D
Glp-Phe-Gly
+
Gly-Lys
87
C'è una strategia significativamente migliore delle altre?
La via D presenta un accoppiamento semplice, perché è coinvolta la
glicina (non chirale): in assenza di problemi di racemizzazione, si può
usare il metodo semplice della DCC. Però i precursori (di- e tri-peptidi)
devono essere preparati con il metodo lineare.
Sintesi lineare
Glp-Phe-Gly
attivazione del residuo C-terminale
H-Gly-Lys-P
P
O
Glp Phe N CH2 C
H
X
Glp-Phe-Gly-Gly-Lys- P
P
(P = gruppo protettore: occorre
proteggere anche la catena laterale
della lisina)
Nel decidere quali frammenti accoppiare, è preferibile scegliere come componente
carbossilico quello che non dà racemizzazione (glicina o prolina) e quindi usare il
metodo semplice della DCC. Se nell'accoppiamento dei frammenti non si può usare
un residuo Glyo Pro C-terminale, bisogna usare l'accoppiamento con l'azide.
LA SINTESI DEL PEPTIDE DEVE INIZIARE DALL'ESTREMITA' N- o C-?
Anche se il metodo complessivo è convergente, quasi sempre richiede qualche sintesi lineare
al suo interno (per es., la via D precedente)
88
44
Glp + Phe
Sintesi lineare
dall'estremità
N-terminale
Phe + Gly
Sintesi lineare
Glp Phe
Gly
Phe
Glp
Gly dall'estremità
C-terminale
Glp Phe Gly
E' meglio costruire il peptide "da destra a sinistra", perché si può minimizzare la racemizzazione.
Per la sintesi lineare di peptidi è meglio partire dall'estremità C-terminale, perché gli
amminoacidi protetti con alcossicarbonile si possono attivare facilmente, senza seri
rischi di racemizzazione.
Boc Phe OH + H Gly OCH2Ph
DCC
Boc Phe Gly OCH2Ph
TFA
H Phe Gly OCH2Ph
Glp/DCC
Glp Phe Gly OCH2Ph
H2, Pd/C
89
Glp Phe Gly
Nonostante i vantaggi della sintesi convergente, in seguito all'avvento della sintesi dei peptidi in fase
solida, la maggior parte della sintesi peptidica si esegue in modo lineare.
SINTESI DEI PEPTIDI IN FASE SOLIDA
Uno dei problemi principali nella sintesi peptidica non sono tanto i passaggi di protezione/
deprotezione o le reazioni di accoppiamento, quanto la necessità di purificare il peptide ad
ogni passaggio, per evitare che si accumulino le impurezze.
Un modo di semplificare notevolmente la purificazione si deve a Merrifield, che ha
sviluppato la tecnica di legare l'estremità C- ad un supporto polimerico insolubile.
Merrifield ha usato un supporto di polistirene trattato con clorometossimetano in
presenza di un acido di Lewis. Questa reazione di Friedel-Crafts dà un polimero
insolubile, in grado di formare un legame di tipo estere benzilico con l'appropriato
derivato di un amminoacido:
Cl
H2C
polimerizzazione
ClCH2OMe
SnCl4
Cl
H2C
Cl
H2C
R
O
Boc N
HR
O
Boc N
H
Boc N
H
O
CH2
CH2
RO
O
CH2
O
Questi polimeri si presentano come palline; l'amminoacido reagisce come se fosse un semplice
estere benzilico; il polimero è insolubile nei solventi organici: il peptide in crescita è l'unica molecola
90
organica legata alla resina. Tutte le impurezze vengono rimosse per lavaggio.
45
Si usano metodi di accoppiamento che assicurano reazione completa entro un'ora e si aggiunge
un eccesso (3-5 equivalenti) dell'amminoacido attivato.
Ancora oggi sono è molto usata la combinazione di protezione ed attivazione
originale di Merrifield: protezione del gruppo amminico con Boc, attivazione con DCC,
protezione di tipo benzilico delle catene laterali. Alla fine della sintesi si usa
HBr/AcOH, che rimuove i gruppi protettori benzilici e contemporaneamente stacca il
peptide dalla resina.
R
O
Boc N
H
Durante la sintesi dei peptidi
si esegue il seguente ciclo di
reazioni:
CH2
O
1) TFA
deprotezione
2) lavaggio con DMF
lavaggio
R
O
H 2N
CH2
O
ciclo
completo
R'
1)
Boc N
H
X
accoppiamento
O
2) lavaggio con DMF
Boc N
H
R'
Bruce
Merrifield
lavaggio
R
O
N
H
O
CH2
O
91
si ripete
Più recentemente sono state sviluppate altre combinazioni di supporto polimerico,
di legame del C-terminale, di protezione e deprotezione.
1. Supporto polimerico
La polimerizzazione radicalica della N,N-dimetilpropenammide (acrilammide), in
presenza di un derivato funzionalizzato e di un agente di "cross-linking" dà un polimero
permeabile in solventi come DMF, che può essere supportato su Kiselguhr (argilla
inorganica), per avere sintesi peptidica in "flusso continuo“ (i reagenti ed il solvente
scorrono attraverso una colonna contenente la resina).
O
O
H3C
N
CH3
O
+
H3C
O
O
Me2 N
O
polimerizzazione
radicalica
N
CH3
O
H3C
N
Me
O O
Me2 N
O
O
N
H
N
H
agente di cross-linking
92
46
2. Collegamento polimero-peptide
Una modifica in due passaggi del gruppo estere metilico dà un idrossi derivato, a cui si
può legare l'amminoacido C-terminale con un semplice legame estereo
HO
NH2
1. H2N
H3C
O
O
2.
O
X
O
HH O
N
N
HO
O
O
O
Il legame è labile in ambiente acido ed il peptide finale può essere rilasciato con ac.
trifluoroacetico.
3. Protezione
Il gruppo protettore Fmoc si rimuove facilmente in condizioni basiche blande (di
solito 20% azaciloesano).
H2C
Fmoc
R
O
O
N
H
COX
Durante la sintesi il peptide in crescita viene in contatto solo con reagenti blandi ed93
il
trattamento finale con TFA libera dalla resina il peptide completamente de-protetto.
4. Attivazione
Gli esteri di Dhbt (3,4-diidro-4-osso-1,2,3-benzotriazol-3-ile, 3,4-dihydro-4-oxo1,2,3-benzotriazol-3-yl) si accoppiano abbastanza velocemente con i gruppi
amminici liberi (circa 30 min). Durante la reazione di accoppiamento la resina si
colora di giallo e quando l'accoppiamento è completo il colore scompare.
O
R
Fmoc N
H
O
O
N
N
ODhbt
N
Quattro fattori hanno fatto sì che il metodo in fase solida sia quelloattualmente più usato nella
sintesi dei peptidi
Le sintesi sono veloci: in un giorno si possono facilmente accoppiare 5-10 residui
(la sintesi convenzionale in soluzione di un ottapeptide può richiedere un mese o
più).
I passaggi sono semplici e ripetitivi ed è stato possibile ottimizzare le reazioni fino a
rese di quasi il 100%.
La purificazione mediante HPLC ha permesso di isolare rapidamente peptidi molto
puri.
Dato che il metodo è così semplice e ripetitivo è stato possibile renderlo
completamente automatico. I sintetizzatori automatici dipeptidi sono costosi, ma
adatti per le ditte farmaceutiche, che li possono far funzionare ventiquattro ore
al giorno.
94
47
La sintesi dei peptidi in fase solida ha però degli inconvenienti
Dopo 15-20 residui le impurezze cominciano a diventare significative
Qualche volta l'accoppiamento può diventare difficile in modo inatteso e
non evidenziato dal metodo, probabilmente per il ripiegamento della catena
peptidica
Ci sono dei limiti alla quantità di peptidi che si possono preparare con
la sintesi in fase solida. La resina non può essere caricata troppo con il
primo residuo, altrimenti diminuisce l'efficienza dell'accoppiamento; 0.5
g di resina (che è la quantità maneggiata nella maggior parte dei
laboratori) possono dare solo 75 mg di un pentapeptide (abbastanza per
semplici prove biologiche, ma non per l'eventuale applicazione medica)
La resina, gli amminoacidi protetti, i reagenti ed i solventi per la
sintesi in fase solida sono molto costosi.
La sintesi dei peptidi in fase solida immobilizza il peptide in crescita su un
polimero insolubile, permettendo una purificazione facile dopo ciascun
accoppiamento. E' un metodo veloce ed affidabile per ottenere piccole
quantità (10-100 mg) di peptide per i test biologici. Quantità maggiori di
peptide si preparano usando la sintesi convergente in soluzione.
95
48